文章信息
- 孔畅, 赵泉霖, 宋振华, 阴永辉
- KONG Chang, ZHAO Quan-lin, SONG Zhen-hua, YIN Yong-hui
- Nrf2:糖尿病防治新领域
- Nrf2: new field of prevention and treatment of diabetes mellitus
- 天津中医药, 2017, 34(5): 295-298
- Tianjin Journal of Traditional Chinese Medicine, 2017, 34(5): 295-298
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.05.03
-
文章历史
- 收稿日期: 2016-12-19
2. 山东中医药大学附属医院, 济南 250014
糖尿病(DM)是由遗传、环境因素共同作用引起的一种胰岛素绝对或相对不足及糖代谢紊乱的代谢障碍性疾病。研究表明,氧化应激与糖尿病关系密切。转录因子NF-E2相关因子2(Nrf2)是一种氧化还原平衡敏感转录因子,通过调控下游的转运蛋白维持细胞氧化还原平衡[1],在抗肿瘤、抗炎、抗凋亡、神经保护等方面均有重要作用。作为关键的内源性抗氧化应激因子,Nrf2在DM及其并发症的防治中发挥了重要作用,本文就这一作用进行综述。
1 氧化应激氧化应激是指机体在遭受各种有害刺激时,活性氧(ROS)和活性氮(RNS)的产生与抗氧化应激系统之间失衡,导致ROS、RNS生成过多,造成组织损伤的过程。大量证据表明,高血糖与氧化应激有关[2]。高糖条件下,超氧产物会大量增加,当其产生速率大于移除速率时则可产生氧化应激。氧化应激诱发DM的机制主要涉及两方面:①损伤胰岛β细胞:高糖诱导生成的ROS通过激活核转录因子NF-κB通路,引起β细胞损伤、凋亡,减少胰岛素合成与分泌。②诱导胰岛素抵抗(IR):氧化应激可致胰岛素受体、胰岛素受体底物磷酸化异常、胰岛素信号传导受阻,导致IR。严重者更会引起糖尿病神经病[3]、糖尿病视网膜病[4]和糖尿病心血管病[5]等多种并发症。可见,氧化应激是DM及其并发症发生、发展的核心因素。
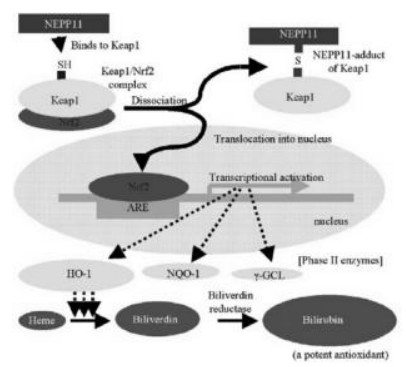
2 Nrf2与氧化应激Nrf2是由NFE2L2基因编码的转录因子,属亮氨酸拉链结构家族成员,主要表达在肝、肾、皮肤、肺、消化道等组织中。生理状态下,绝大部分Nrf2以非活性状态储存于细胞质中,与Kelch样环氧氯丙烷相关蛋白1(Keap1)形成络合物,并不断被蛋白酶体降解,使抗氧化物和保护细胞的酶类处于基础表达水平,细胞处于稳定状态;另一部分Nrf2以活性状态存在于细胞核中介导基因的转录。当受到ROS或亲电试剂刺激时,Nrf2与Keap1解离,Keap1修饰及构象变化使得Nrf2易位到细胞核中调控转录[6],进入细胞核后,Nrf2激活抗氧化反应元件(ARE)、多种抗氧化基因及Ⅱ相解毒酶基因的转录,提高细胞的抗氧化应激能力,维持机体氧化-抗氧化的生理平衡。一旦氧化还原稳态被打破,组织细胞就会出现肥大、凋亡甚至纤维化,进而引起组织结构变化、诱发疾病。目前研究证实由Nrf2通路激活表达的抗氧化蛋白酶包括血红素氧合酶1(HO-1),γ-谷氨酸半胱氨酸合成酶(γ-GCS),超氧化物歧化酶(SOD),醌氧化还原酶1(NQO-1)等[7],由于其靶基因广泛,Nrf2无疑在氧化应激中发挥着重要的调控作用,见图 1。此外,Nrf2还参与调控免疫、炎症、组织重构、癌症发生及转移相关的基因,在免疫调节、抗炎、抗组织损伤、抗肿瘤等方面发挥积极作用。
|
| 图 1 Nrf2的激活及其调控的下游因子示意图 Fig. 1 Abridged general view of the activation of Nrf2 and controlled downstream factors |
氧化应激在IR中起着关键作用[8],且氧化应激可加重IR的程度。高糖诱导线粒体产生过量的超氧化物,造成氧化应激损伤,并通过激活氧化应激相关通路引起IR。目前研究对Nrf2与IR的关系尚无定论,主要存在两种观点:一种认为Nrf2可改善IR,另一种相反,认为Nrf2可促进IR[9]。
有研究显示,激活Nrf2可以减轻IR,这与其抗氧化应激作用有关。He等[10]研究采用高脂饮食喂养C57BL/6J小鼠,发现姜黄素能够改善小鼠的胰岛素敏感性,而这一作用是通过激活Nrf2通路实现的。此外,鞣花酸、白藜芦醇也被证实可改善IR。也有研究发现Nrf2激动剂奥体普拉可减少高脂小鼠体内氧化应激的生成、抑制IR、提高胰岛素敏感性,提示Nrf2系统在调节氧化还原平衡及抵抗IR方面发挥着重要作用[11]。
相反,另有研究表明Nrf2活化可能损害胰岛素信号和葡萄糖摄取。Charto-umpekis等[12]给予高脂饮食喂养野生型和Nrf2基因敲除小鼠180 d,发现Nrf2基因敲除小鼠的葡萄糖耐受性和胰岛素敏感性更强。也有学者通过葡萄糖耐量试验评估IR的程度,发现在高脂饮食喂养条件下,Nrf2基因缺乏小鼠的血糖较低且葡萄糖清除率正常[13]。可见,激活Nrf2可能会促进IR的发展。
3.2 Nrf2与胰岛β细胞氧化应激状态下,过量的ROS可导致胰岛β细胞功能异常,并减弱胰岛素的作用。而Nrf2不仅能够保护胰岛β细胞免受氧化反应损伤,还能减少胰岛β细胞凋亡、促进其增殖。Yagishita等[14]利用转基因小鼠模型发现,Nrf2可显著抑制胰岛β细胞内ROS的蓄积并减少其对胰岛β细胞的损伤,同时还可减少一氧化氮介导的胰岛β细胞凋亡。另有研究显示[15],花青素能够激活胰岛β细胞中的Nrf2以阻止细胞自噬,从而增加细胞活性、减少细胞死亡。Mitsuishi等[16]证实了Nrf2能够促使葡萄糖与谷氨酸盐进入合成代谢途径,从而促进细胞增殖。以上研究结果均表明在ROS环境下,Nrf2能够保护胰岛β细胞,在其生理和病理防御机制中至关重要。
4 Nrf2与糖尿病并发症 4.1 糖尿病心肌病(DCM)DCM是DM引起的一组独立心肌病变,发病机制涉及细胞内钙调节受损、线粒体功能失调、糖基化终产物蓄积、细胞内代谢异常等方面,而且上述致病因素均与氧化应激相关[17]。大量证据证实,Nrf2能够抑制氧化应激、改善心肌重构、减少心肌细胞凋亡,在维持心血管氧化还原稳态中发挥关键作用。在DCM的研究中发现[18],患者体内抗氧化反应减弱,氧化应激导致ROS明显增多,可损伤心肌细胞并诱发DCM,且在DM心肌细胞中Nrf2的表达明显降低。Chen等[19]发现,当体外心肌细胞受到高糖刺激、体内心脏处在高糖环境时,Nrf2对心肌细胞均有保护作用。另有研究显示[20],汞(33 mm)能够刺激Nrf2蛋白的表达并转位到心肌细胞的细胞核,提高下游抗氧化蛋白的水平。Xu等[21]应用雄性db/db小鼠、年龄匹配的野生型小鼠进行实验,分别给予Nrf2活化剂莱菔硫烷及其天然来源花椰菜提取物,证实二者均可上调Nrf2的活性,通过增加Nrf2核积累及其下游基因的表达,预防DM诱导的心脏功能紊乱、心肌肥厚和纤维化。因此,Nrf2激动剂将成为防治DCM的研究热点。
4.2 糖尿病肾病(DN)DN是DM主要的微血管并发症,氧化应激在DN的发病中起到关键作用。持续的高血糖会产生大量的ROS,蓄积于肾实质细胞中可致肾脏内基质重构、组织纤维化,促进DN的发展[22],而激活Nrf2能够缓解肾脏纤维化、肾缺血再灌注损伤等。Shahzad等[23]发现米诺环素可降低Nrf2的泛素化并增加其蛋白的表达,抑制ROS诱导的肾脏炎症反应,从而减轻糖尿病肾损害。非诺贝特也被证实可激活Nrf2抑制氧化应激,同时增加成纤维细胞生长因子21(FGF21)的表达来改善肾功能[24]。另外白藜芦醇、柚皮苷、花青素、积雪草酸等亦可上调Nrf2水平,启动抗氧化防御系统来减轻肾损伤。然而,激活Nrf2并非对所有DN患者均有益。Pergola等[25]的三期临床研究发现,Nrf2激动剂甲基巴多索隆治疗组的肾小球滤过率、血压及尿白蛋白/肌酐均显著增加,加剧DN进展。可见,Nrf2对DN的调节作用是双向的,氧化应激激活Nrf2的同时可能激活肾素-血管紧张素系统,从而引起高血压、肾小管细胞的凋亡,加重DN进展。
4.3 糖尿病视网膜病变(DR)氧化应激是DR的重要致病因素,高血糖时ROS生成增加,而ROS可启动血糖异常代谢途径,诱导氧化应激反应,加重视网膜的缺血缺氧及毛细血管微血栓形成。因此,抗氧化治疗DR的作用也备受重视,大量研究证实Nrf2在DR视网膜细胞中具有保护作用。Song等[26]观察了蓝莓花色苷对DM大鼠视网膜的影响,结果显示它能够增加Nrf2和HO-1mRNA的表达、降低丙二醛及ROS的水平,由此推测BA可通过调节Nrf2/HO-1信号通路发挥其对视网膜的保护作用。Liu等[27]的体内体外实验也发现木质素可通过Nrf2/HO-1调节视网膜内皮细胞的氧化应激反应,并指出木质素可作为治疗DM诱导的微血管功能障碍的药物。也有研究观察高糖环境下的牛视网膜周细胞,发现萝卜硫素能够抑制晚期糖基化终产物的表达,提高抗氧化及抗细胞凋亡的能力,进而治疗DR[28]。此外,芒柄花黄素、α-硫辛酸、槲皮素、祛黑素等也被证实可延缓DR的发展。
4.4 糖尿病周围神经病变(DPN)DPN作为糖尿病神经病变最常见的类型,是由高血糖或胰岛素缺乏引起的神经功能障碍,主要表现为新陈代谢紊乱、神经血管功能障碍。目前认为DPN的发病多涉及高血糖、多元醇通路、氨基己糖途径、蛋白激酶C激活、炎症等途径,而这些途径均与氧化应激相关,其中线粒体的氧化应激在DPN中处于中心地位。Yama等[29]采用大鼠雪旺细胞和人类SH-SY5Y细胞进行实验,首次证明了依帕司他(EPS)可以通过激活Nrf2上调HO-1、SOD和过氧化氢酶(CAT),并指出可将EPS用于治疗其他神经系统病变。Tian等[30]观察了芦丁在DPN中的作用,发现芦丁可明显抑制机械性痛觉过敏、热痛觉过敏和冷痛,并能使DM大鼠坐骨神经传导速度得以部分恢复,进一步的研究表明降低血糖和激活Nrf2有助于芦丁对DPN的保护作用。
4.5 糖尿病骨关节病糖尿病骨关节病是老年DM者常见的并发症,其发病多由代谢紊乱及血管神经并发症而引起,以骨质疏松、骨关节炎、风湿性关节炎等病变类型为主。大量证据显示,Nrf2在糖尿病骨关节病中发挥重要作用,氧化应激能够引起软骨下骨增生、滑膜炎反应及软骨细胞损伤,诱发糖尿病骨关节炎的发生。研究发现[31-32]激活Nrf2基因能够限制软骨破坏、保护软骨细胞免受氧化应激损伤,另一方面,抑制Nrf2的活性及抗氧化能力都会诱导软骨细胞凋亡、软骨破坏,提示Nrf2活性的维持可能是改善糖尿病骨关节病的关键。
5 展望综上所述,高糖引起的氧化应激可引起胰岛β细胞功能障碍、IR,诱导DM的发生、发展,而激活Nrf2可抑制机体的氧化应激反应,对DM及其并发症均有保护作用,亦有研究指出Nrf2具有抗炎、抗凋亡、抗动脉粥样硬化等作用。但是,Nrf2在DM发病机制中究竟发生了怎样的变化,况且Nrf2激动剂至今尚无临床应用指征,这预示着寻找理想的防治措施仍需进一步的研究。
| [1] | DeNicola GM, Karreth FA, Humpton TJ, et al. Oncogene-induced Nrf2 transcription promotes ROS detoxification and tumorigenesis[J]. Nature, 2011, 475 (7354): 106–109. DOI:10.1038/nature10189 |
| [2] | Chaudhuri A, Umpierrez GE. Oxidative stress and inflammation in hyperglycemic crises and resolution with insulin:implications for the acute and chronic complications of hyperglycemia[J]. J Diabetes Complications, 2012, 26 (4): 257–258. DOI:10.1016/j.jdiacomp.2012.04.016 |
| [3] | Hernandez-Beltran N, Moreno CB, Gutierrez-Alvarez AM. Contribution of mitochondria to pain in diabetic neuropathy[J]. Endocrinol Nutr, 2013, 60 (1): 25–32. DOI:10.1016/j.endonu.2012.03.005 |
| [4] | Souza BM, Assmann TS, Kliemann LM, et al. The role of uncoupling protein 2(UCP2) on the development of type 2 diabetes mellitus and its chronic complications[J]. Arq Bras Endocrinol Metabol, 2011, 55 (4): 239–248. DOI:10.1590/S0004-27302011000400001 |
| [5] | Selvaraju V, Joshi M, Suresh S, et al. Diabetes, oxidative stress, molecular mechanism, and cardiovascular disease——an overview[J]. Toxicol Mech Methods, 2012, 22 (5): 330–335. DOI:10.3109/15376516.2012.666648 |
| [6] | Niture SK, Kaspar JW, Shen J, et al. Nrf2 signaling and cell survival[J]. Toxicol Appl Pharmacol, 2010, 244 (1): 37–42. DOI:10.1016/j.taap.2009.06.009 |
| [7] | Vrba J, Gazak R, Kuzma M, et al. A novel semisynthetic flavonoid 7-O-galloyltaxifolin upregulates heme oxygenase-1 in RAW264.7 cells via MAPK/Nrf2 pathway[J]. J Med Chem, 2013, 56 (3): 856–866. DOI:10.1021/jm3013344 |
| [8] | Stadler K. Oxidative stress in diabetes[J]. Adv Exp Med Biol, 2012, 771 (771): 272–287. |
| [9] | Seo HA, Lee IK. The role of Nrf2:adipocyte differentiation, obesity, and insulin resistance[J]. Oxid Med Cell Longev, 2013, 2013 (1): 184598. |
| [10] | He HJ, Wang GY, Gao Y, et al. Curcumin attenuates Nrf2 signaling defect, oxidative stress in muscle and glucose intolerance in high fat diet-fed mice[J]. World J Diabetes, 2012, 3 (5): 94–104. DOI:10.4239/wjd.v3.i5.94 |
| [11] | Yu Z, Shao W, Chiang Y, et al. Oltipraz upregulates the nuclear factor (erythroid-derived 2)-like 2[corrected](NRF2) antioxidant system and prevents insulin resistance and obesity induced by a high-fat diet in C57BL/6J mice[J]. Diabetologia, 2011, 54 (4): 922–934. DOI:10.1007/s00125-010-2001-8 |
| [12] | Chartoumpekis DV, Ziros PG, Psyrogiannis AI, et al. Nrf2 represses FGF21 during long-term high-fat diet-induced obesity in mice[J]. Diabetes, 2011, 60 (10): 2465–2473. DOI:10.2337/db11-0112 |
| [13] | Zhang YK, Wu KC, Liu J, et al. Nrf2 deficiency improves glucose tolerance in mice fed a high-fat diet[J]. Toxicol Appl Pharmacol, 2012, 264 (3): 305–314. DOI:10.1016/j.taap.2012.09.014 |
| [14] | Yagishita Y, Fukutomi T, Sugawara A, et al. Nrf2 protects pancreatic beta-cells from oxidative and nitrosative stress in diabetic model mice[J]. Diabetes, 2014, 63 (2): 605–618. DOI:10.2337/db13-0909 |
| [15] | Zhang B, Buya M, Qin W, et al. Anthocyanins from Chinese bayberry extract activate transcription factor Nrf2 in beta cells and negatively regulate oxidative stress-induced autophagy[J]. J Agric Food Chem, 2013, 61 (37): 8765–8772. DOI:10.1021/jf4012399 |
| [16] | Mitsuishi Y, Taguchi K, Kawatani Y, et al. Nrf2 redirects glucose and glutamine into anabolic pathways in metabolic reprogramming[J]. Cancer Cell, 2012, 22 (1): 66–79. DOI:10.1016/j.ccr.2012.05.016 |
| [17] | Kayama Y, Raaz U, Jagger A, et al. Diabetic Cardiovascular Disease Induced by Oxidative Stress[J]. Int J Mol Sci, 2015, 16 (10): 25234–25263. DOI:10.3390/ijms161025234 |
| [18] | Ramprasath T, Selvam GS. Potential impact of genetic variants in Nrf2 regulated antioxidant genes and risk prediction of diabetes and associated cardiac complications[J]. Curr Med Chem, 2013, 20 (37): 4680–4693. DOI:10.2174/09298673113209990154 |
| [19] | Chen J, Zhang Z, Cai L. Diabetic cardiomyopathy and its prevention by nrf2:current status[J]. Diabetes Metab J, 2014, 38 (5): 337–345. DOI:10.4093/dmj.2014.38.5.337 |
| [20] | Tsai CY, Wen SY, Cheng SY, et al. Nrf2 Activation as a Protective Feedback to Limit Cell Death in High Glucose-Exposed Cardiomyocytes[J]. J Cell Biochem, 2016 . |
| [21] | Xu Z, Wang S, Ji H, et al. Broccoli sprout extract prevents diabetic cardiomyopathy via Nrf2 activation in db/db T2DM mice[J]. Sci Rep, 2016, 6 : 30252. DOI:10.1038/srep30252 |
| [22] | Singh DK, Winocour P, Farrington K. Oxidative stress in early diabetic nephropathy:fueling the fire[J]. Nat Rev Endocrinol, 2011, 7 (13): 176–184. |
| [23] | Shahzad K, Bock F, Al-Dabet MM, et al. Stabilization of endogenous Nrf2 by minocycline protects against Nlrp3-inflammasome induced diabetic nephropathy[J]. Sci Rep, 2016, 6 : 34228. DOI:10.1038/srep34228 |
| [24] | Cheng Y, Zhang J, Guo W, et al. Up-regulation of Nrf2 is involved in FGF21-mediated fenofibrate protection against type 1 diabetic nephropathy[J]. Free Radic Biol Med, 2016, 93 : 94–109. DOI:10.1016/j.freeradbiomed.2016.02.002 |
| [25] | de Zeeuw D, Akizawa T, Audhya P, et al. Bardoxolone methyl in type 2 diabetes and stage 4 chronic kidney disease[J]. N Engl J Med, 2013, 369 (26): 2492–2503. DOI:10.1056/NEJMoa1306033 |
| [26] | Song Y, Huang L, Yu J. Effects of blueberry anthocyanins on retinal oxidative stress and inflammation in diabetes through Nrf2/HO-1 signaling[J]. J Neuroimmunol, 2016, 301 : 1–6. DOI:10.1016/j.jneuroim.2016.11.001 |
| [27] | Liu B, Li CP, Wang WQ, et al. Lignans Extracted from Eucommia Ulmoides Oliv. Protects Against AGEs-Induced Retinal Endothelial Cell Injury[J]. Cell Physiol Biochem, 2016, 39 (5): 2044–2054. DOI:10.1159/000447900 |
| [28] | Maeda S, Matsui T, Ojima A, et al. Sulforaphane inhibits advanced glycation end product-induced pericyte damage by reducing expression of receptor for advanced glycation end products[J]. Nutr Res, 2014, 34 (9): 807–813. DOI:10.1016/j.nutres.2014.08.010 |
| [29] | Yama K, Sato K, Murao Y, et al. Epalrestat Upregulates Heme Oxygenase-1, Superoxide Dismutase, and Catalase in Cells of the Nervous System[J]. Biol Pharm Bull, 2016, 39 (9): 1523–1530. DOI:10.1248/bpb.b16-00332 |
| [30] | Tian R, Yang W, Xue Q, et al. Rutin ameliorates diabetic neuropathy by lowering plasma glucose and decreasing oxidative stress via Nrf2 signaling pathway in rats[J]. Eur J Pharmacol, 2016, 771 : 84–92. DOI:10.1016/j.ejphar.2015.12.021 |
| [31] | Wruck CJ, Fragoulis A, Gurzynski A, et al. Role of oxidative stress in rheumatoid arthritis:insights from the Nrf2-knockout mice[J]. Ann Rheum Dis, 2011, 70 (15): 844–850. |
| [32] | Maicas N, Ferrandiz ML, Brines R, et al. Deficiency of Nrf2 accelerates the effector phase of arthritis and aggravates joint disease[J]. Antioxid Redox Signal, 2011, 15 (4): 889–901. DOI:10.1089/ars.2010.3835 |
2. Affiliated Hospital of Shandong University of Traditional Chinese Medicine, Jinan 250014, China
 2017, Vol. 34
2017, Vol. 34