文章信息
- 李静, 杨雅娟, 冯艳, 李良宵, 申军华, 董魁, 郭建华
- LI Jing, YANG Ya-juan, FENG Yan, LI Liang-xiao, SHEN Jun-hua, DONG Kui, GUO Jian-hua
- 牛磺酸对实验性肝纤维化大鼠保护作用的研究
- Protective effects of Taurine on the experimental hepatic fibrosis rats
- 天津中医药, 2017, 34(5): 336-340
- Tianjin Journal of Traditional Chinese Medicine, 2017, 34(5): 336-340
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.05.15
-
文章历史
- 收稿日期: 2016-12-02
2. 邯郸市第一医院检验科, 邯郸 056002;
3. 邯郸市第一医院感染性疾病科, 邯郸 056002
肝纤维化是多种慢性肝病发展为肝硬化的必经阶段,但仍处于可逆转病变时期,因此,在该阶段进行药物干预治疗,阻断其发生和发展,或许是防治肝硬化的有效途径[1-2]。近年来,随着病理生理学研究的深入,发现氧化应激、炎症反应是肝纤维化发生发展以及向肝硬化转化的重要病理机制[3-7],这也为本研究提供了研发新型抗肝纤维化药物的思路。牛磺酸是一种含硫β-氨基酸,是名贵中药“牛黄”的重要成分之一。近年来研究发现,牛磺酸具有促进胆汁排泄、抗炎、抗氧化等多种生物学作用[8-11], 但牛磺酸对实验性肝纤维化大鼠肝组织保护作用的文献报道尚不多见。本实验通过CCl4复合法制备实验性肝纤维化大鼠模型并灌胃给予牛磺酸进行干预治疗,以复方鳖甲软肝片为阳性对照药,研究牛磺酸对实验性肝纤维化大鼠的保护作用并探讨其可能的作用机制。
1 材料与方法 1.1 药物与试剂牛磺酸(美国Sigma公司,批号:140213,含量≥98%);复方鳖甲软肝片(内蒙古福瑞中蒙药科技股份有限公司,批号:20140624);丙氨酸氨基转移酶(ALT)、氨基转移酶(AST)、总胆红素(TBIL)测定试剂盒购自深圳迈瑞生物医疗电子股份有限公司;超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)测定试剂盒和白细胞介素-10(IL-10)、肿瘤坏死因子-α(TNF-α)测定试剂盒购自南京建成生物工程研究所;Ⅳ型胶原(CⅣ)、Ⅲ型前胶原(PCⅢ)、层黏蛋白(LN)、透明质酸(HA)测定试剂盒和天狼星染色试剂盒均购自北京博奥森生物工程有限公司。
1.2 动物清洁级SD大鼠(雄性,7周龄,200~250 g),购自河北省实验动物中心,动物许可证号:SCXK(冀)2013-1-003,动物合格证号:201410009。
1.3 方法 1.3.1 动物分组、模型制备与给药将120只实验用SD大鼠随机分为正常对照组、模型组、牛磺酸低(150 mg/kg)、中(300 mg/kg)、高(600 mg/kg)剂量组和复方鳖甲软肝片540 mg/kg组,每组20只。除正常对照组外,其余各组大鼠经皮下注射CCl4溶液(浓度40%,0.3 mL/100 g,每3天1次),喂给高脂高胆固醇饲料,并饮用15%乙醇,6周后采用病理学检查是否造模成功。取牛磺酸准确称量,用生理盐水配制成浓度为300 mg/mL的溶液,并依此稀释制备150 mg/kg和75 mg/kg的牛磺酸溶液;取复方鳖甲软肝片并准确称量,用生理盐水配制成浓度为270 mg/mL的溶液。为保证给药容积一致,各治疗均灌胃给药2 mL/kg;假手术组和模型对照组均给予生理盐水,剂量为2 mL/kg;每天1次,1个疗程4周。
1.3.2 血清中ALT、AST、TBIL含量肝纤四项指标(CⅣ、PCⅢ、LN、HA)的测定实施麻醉后开腹经腹主动脉取血,离心(1 500 rpm,10 min)取血清,然后按照试剂盒操作方法步骤通过生化检测仪测定各组大鼠血清中ALT、AST、TBIL含量,通过酶标仪平行测定各组大鼠血清中CⅣ、PCⅢ、LN、HA含量。
1.3.3 肝脏组织病理性形态结果改变的观察及肝组织细胞坏死和组织增生分级待1.3.2取血完成后取肝脏组织,置于4%多聚甲醛溶液中固定72 h,依次行石蜡包埋、切片(厚度约5 μm)和展片处理,然后行常规HE染色,通过倒置光学显微镜观察各组大鼠肝脏组织病理性形态结构改变。参照马玉珍[8]等报道的方法对肝细胞坏死和纤维组织增生程度进行分级,肝细胞坏死:呈点灶状坏死、弥散分布(+++),分布范围较广(++),散在分布(+),无变化者为(0);肝纤维组织增生:胶原纤维呈宽条索状、增加明显,表现为分隔成假小叶(+++),胶原纤维呈细条索状、散在分布,表现为不完全假小叶(++),胶原纤维含量增加,很少形成条索状,可见汇管区扩大,纤维化(+),无变化者为(0)。
1.3.4 肝脏组织纤维化状况观察取1.3.3所制备的石蜡组织切片经脱蜡水化处理后,按照天狼星染色试剂盒方法步骤进行天狼星染色,然后通过光学显微镜观察各组大鼠肝脏组织纤维化状况。
1.3.5 肝脏组织中抗氧化酶活性和MDA含量的测定参照1.3.3取肝脏组织,研磨匀浆后低温离心(4 ℃,12 000 r/min,15 min)取上清液,根据试剂盒方法步骤,通过紫外-可见分光光度计测定各组大鼠肝脏组织中抗氧化酶(SOD、GSH-Px)活性和MDA含量。
1.3.6 血清中炎症细胞因子水平的测定取1.3.2制备的血清,参照ELISA试剂盒操作方法步骤依次进行处理,然后通过酶标仪平行测定各组大鼠血清中细胞因子(IL-10、TNF-α)水平。
1.3.7 统计学方法运用SPSS 18.0对实验数据进行统计分析,计量资料采用x±s方式表示,组间均数比较采用one-way ANOVA进行检验;计数资料采用χ2检验;P<0.05表示差异具有统计学意义,P<0.01表示具有极显著性差异。
2 结果 2.1 牛磺酸对实验性肝纤维化大鼠血清中ALT、AST、TBIL含量的影响模型组大鼠血清中ALT、AST、TBIL含量较正常对照组均显著升高(P<0.01);经牛磺酸和复方鳖甲软肝片治疗4周后,牛磺酸中、高剂量组和复方鳖甲软肝片组ALT、AST、TBIL含量均显著降低(P<0.05,P<0.01),结果见表 1。
| 组别 | 动物数 | ALT (U/L) | AUT (U/L) | TBIL (μmol/L) |
| 正常对照组 | 20 | 51.1± 6.0 | 43.5± 8.2 | 8.3±1.7 |
| 模型组 | 20 | 93.8±17.6△△ | 91.1±14.5△△ | 17.0±3.2△△ |
| 牛磺酸低剂量组 | 20 | 85.2±16.5 | 82.3±16.4 | 13.5±4.0 |
| 牛磺酸中剂量组 | 20 | 74.3±15.9* | 69.7±12.5* | 11.6±3.1* |
| 牛磺酸高剂量组 | 20 | 62.0± 9.8** | 58.4±10.2** | 10.9±2.5* |
| 复方鳖甲软肝片组 | 20 | 71.8±14.0* | 68.2±13.8* | 12.6±2.7* |
| 注:与正常对照组比较,△△P<0.01;与模型组比较,*P<0.05,**P<0.01。 | ||||
模型组大鼠血清中CⅣ、PCⅢ、LN、HA含量较正常对照组显著升高(P<0.01);经牛磺酸和复方鳖甲软肝片治疗4周后,牛磺酸中、高剂量组和复方鳖甲软肝片组大鼠血清中CⅣ、PCⅢ、HA含量显著降低(P<0.05,P<0.01),牛磺酸高剂量组和复方鳖甲软肝片组LN含量显著降低(P<0.05),结果见表 2。
| 组别 | 动物数 | CⅣ(μg/L) | PCⅢ (μg/L) | LN (μg/L) | HA (μg/L) |
| 正常对照组 | 20 | 34.6± 7.8 | 75.6±13.1 | 25.4±10.8 | 23.5± 6.7 |
| 模型组 | 20 | 67.9±12.2△△ | 213.5±34.9△△ | 117.6±35.7△△ | 85.2±11.7△△ |
| 牛磺酸低剂量组 | 20 | 60.1±13.8 | 178.8±35.6 | 108.1±40.9 | 76.1±13.8 |
| 牛磺酸中剂量组 | 20 | 48.0± 9.9* | 143.2±28.7* | 98.5±38.4 | 61.4±10.5* |
| 牛磺酸高剂量组 | 20 | 39.4±10.3** | 120.4±25.1** | 82.8±29.4* | 53.5± 9.1** |
| 复方鳖甲软肝片组 | 20 | 47.0±11.2* | 152.9±31.7* | 84.6±27.1* | 61.9±12.7* |
| 注:与正常对照组比较,△△P<0.01;与模型组比较,*P<0.05,**P<0.01。 | |||||
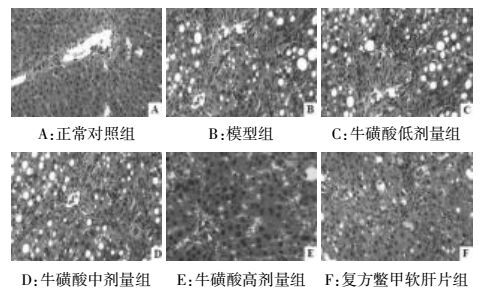
通过观察病理切片发现,正常对照组大鼠肝脏组织形态和细胞结构均未见异常;模型组大鼠肝脏组织呈纤维组织增生、纤维间隔形成、汇管区及中央静脉周围可见炎细胞侵润等明显的病理性改变;经牛磺酸或复方鳖甲软肝片治疗4周后,与模型组比较,各治疗大鼠肝脏组织病变呈不同程度改善,其中以牛磺酸高剂量组改善效果最为显著,见图 1。通过对肝细胞坏死和肝纤维组织增生程度进行分级评分发现:模型组肝细胞坏死和肝纤维组织增生程度显著高于正常对照组;与模型组比较,牛磺酸中、高剂量组和复方鳖甲软肝片组肝细胞坏死和肝纤维组织增生程度显著减轻,差异均具有统计学意义(P<0.05,P<0.01),结果见表 3。
|
| 图 1 各组大鼠肝脏组织形态结构变化(HE,×200) Fig. 1 Morphological changes of liver tissue in each group (HE, ×200) |
| 组别 | 动物数 | 肝细胞坏死 | 纤维组织增生 | ||||||||
| - | + | ++ | +++ | 评分 | - | + | ++ | +++ | 评分 | ||
| 正常对照组 | 10 | 2 | 8 | 0 | 0 | 8 | 1 | 9 | 0 | 0 | 9 |
| 模型组 | 10 | 0 | 1 | 2 | 7 | 26△△ | 0 | 0 | 5 | 5 | 25△△ |
| 牛磺酸150 mg/kg治疗组 | 10 | 0 | 2 | 2 | 6 | 24 | 0 | 1 | 6 | 3 | 22 |
| 牛磺酸300 mg/kg治疗组 | 10 | 0 | 4 | 3 | 3 | 19* | 1 | 3 | 5 | 1 | 16** |
| 牛磺酸600 mg/kg治疗组 | 10 | 0 | 7 | 2 | 1 | 14** | 3 | 5 | 2 | 0 | 9** |
| 复方鳖甲软肝片540 mg/kg治疗组 | 10 | 0 | 4 | 2 | 4 | 20* | 1 | 2 | 6 | 1 | 17** |
| 注:与正常对照组比较,△△P<0.01;与模型组比较,*P<0.05,**P<0.01。 | |||||||||||
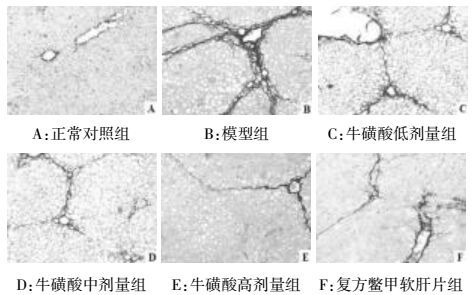
观察各组大鼠肝脏组织天狼星染色切片发现正常对照组大鼠肝组织结构未见异常;模型对照组大鼠肝脏组织纤维化程度较正常对照组明显加重,表现为细胞外基质(ECM)增生并形成胶原纤维,形成不完全纤维隔、薄厚不一,部分肝小叶结构被ECM形成的假小叶代替;而经熊果酸干预能够显著改善肝纤维化门静脉高压大鼠肝脏组织纤维化病变程度,其中以熊果酸40 mg/kg组效果最为显著,见图 2。
|
| 图 2 各组大鼠肝脏组织纤维化状况(天狼星染色,×200) Fig. 2 Hepatic fibrosis status of liver tissue in each group (Sirius staining, ×200) |
模型组大鼠肝脏组织中SOD、GSH-Px活性较正常对照组显著降低且MDA含量显著升高(P<0.01);经牛磺酸和复方鳖甲软肝片治疗4周后,牛磺酸中、高剂量组和复方鳖甲软肝片组SOD活性显著升高、MDA含量显著降低(P<0.05,P<0.01),牛磺酸中、高剂量组GSH-Px活性显著升高(P<0.05,P<0.01),结果见表 4。
| 组别 | 动物数 | SOD(U/mg prot) | GSH-Px(U/mg prot) | MDA(U/mg prot) |
| 正常对照组 | 20 | 11.8±1.6 | 17.6±2.4 | 5.9±1.1 |
| 模型组 | 20 | 7.9±1.3△△ | 10.8±1.6△△ | 13.0±2.8△△ |
| 牛磺酸低剂量组 | 20 | 8.5±1.2 | 11.5±2.3 | 10.9±2.6 |
| 牛磺酸中剂量组 | 20 | 9.6±1.5* | 12.7±2.4* | 8.1±2.2** |
| 牛磺酸高剂量组 | 20 | 10.8±1.9** | 14.2±2.7* | 6.6±1.4** |
| 复方鳖甲软肝片组 | 20 | 9.4±1.3* | 11.8±2.1 | 8.7±2.1* |
| 注:与正常对照组比较,△△P<0.01;与模型组比较,*P<0.05,**P<0.01。 | ||||
模型组大鼠血清中IL-10、TNF-α含量显著升高(P<0.05,P<0.01);经牛磺酸和复方鳖甲软肝片治疗4周,牛磺酸中、高剂量组IL-10、TNF-α含量显著降低(P<0.05),结果见表 5。
| 组别 | 动物数 | IL-10(ng/L) | TNF-α(μg/L) |
| 正常对照组 | 20 | 783.5±57.1 | 0.83±0.20 |
| 模型组 | 20 | 694.7±48.2△ | 1.34±0.29△ |
| 牛磺酸低剂量组 | 20 | 728.1±50.6 | 1.22±0.35 |
| 牛磺酸中剂量组 | 20 | 775.9±52.4* | 0.98±0.24* |
| 牛磺酸高剂量组 | 20 | 813.4±61.9* | 0.91±2.20* |
| 复方鳖甲软肝片组 | 20 | 742.5±53.6 | 1.26±0.33 |
| 注:与正常对照组比较,△P<0.01;与模型组比较,*P<0.05。 | |||
肝脏组织中肝纤四项(CⅣ、PCⅢ、LN、HA)的含量是临床上用来监测肝纤维化进展程度的常用指标,并且在肝纤维化发生发展过程中,胶原纤维大量增生,其主要成分为胶原蛋白,因此肝纤4项的含量也能够反映肝纤维化程度[12]。牛磺酸是一种具有多种生物学活性的含硫β-氨基酸[8-13],本实验通过四氯化碳(CCl4)复合法制备肝纤维化大鼠模型[14]后给予牛磺酸进行干预治疗研究发现,牛磺酸能够有效降低肝纤维化大鼠血清中CⅣ、PCⅢ、LN、HA含量,降低血清中ALT、AST、TBIL含量,改善肝脏组织病理形态变化,抑制肝细胞坏死和肝纤维化组织增生,改善肝脏组织纤维化状况,提示牛磺酸对实验性肝纤维化大鼠具有保护作用。
近年来,病理生理学研究发现氧化应激和炎症反应是肝纤维化发生发展以及向肝硬化转化的重要病理机制[3-7]。超氧化物歧化酶(SOD)能够通过提供氢原子配体而还原氧自由基生成H2O2[15-16],并且在谷胱甘肽过氧化物酶(GSH-Px)的催化作用下,能够进一步被还原生成对人体无害的H2O和O2[17],从而消除氧化应激损伤;脂质过氧化终产物丙二醛(MDA)的含量也能够间接反映机体氧化应激损伤程度。IL-10与TNF-α在体内炎症反应的调节以及肝纤维化的发生发展起着关键的作用[18];IL-10是一种多效细胞因子,Huang YH等[19]研究发现IL-10能够抑制炎症反应、抑制胶原合成,刺激胶原酶的产生,从而起到阻止肝纤维化的发生发展的作用;Loftis等[20]研究发现,TNF-α不但能够增强炎症活动度并直接损伤肝细胞,还具有刺激肝星状细胞增殖、促进细胞外基质的合成而起到促进肝纤维化的作用。本实验研究发现,牛磺酸能够有效改善肝纤维化大鼠肝脏组织中SOD、GSH-Px活性并降低MDA含量,提高血清中IL-10水平并降低TNF-α含量,提示牛磺酸具有抑制肝纤维化大鼠肝脏组织氧化应激和炎症反应的作用。
综上所述,牛磺酸对实验性肝纤维化大鼠具有保护作用,机制可能与牛磺酸能够有效保肝降酶、抑制氧化应激反应和炎症反应、改善肝功能有关。
| [1] | Huang RJ, Liu TW, Pang YS. Taurine dilated left ventricle of transforming growth factor TGF-β1 expression[J]. Modern Diagnosis and Treatment, 2004, 15 (2): 83–85. |
| [2] | 李欣, 朱英. 肝纤维化发生相关信号传导通路研究进展[J]. 实用肝脏病杂志, 2015年, 18 (1): 101–104. |
| [3] | 张丽丽, 李旭炯, 贾建桃, 等. 大黄素对肝纤维化大鼠肝脏氧化应激的影响[J]. 长治医学院学报, 2014, 28 (2): 81–84. |
| [4] | 李俊峰, 郑素军, 段钟平. 氧化应激在肝纤维化中的作用及治疗对策[J]. 世界华人消化杂志, 2013, 21 (17): 1573–1578. |
| [5] | 王艳荣, 张秋瓒. 替米沙坦对非酒精性脂肪肝大鼠炎症反应及肝纤维化的影响[J]. 中国临床药理学杂志, 2016, 32 (17): 1583–1586. |
| [6] | 秦燕, 刘仁贵, 苏娟, 等. 生姜醇提物对四氯化碳致大鼠肝纤维化炎症相关因子的影响[J]. 重庆医学, 2014, 43 (18): 2316–2322. DOI:10.3969/j.issn.1671-8348.2014.18.019 |
| [7] | 郭景珍, 万方, 李忻, 等. 柴胡皂苷d对二甲基亚硝胺致肝纤维化大鼠炎症相关因子的影响[J]. 中华中医药杂志, 2008, 23 (11): 970–974. |
| [8] | 孙宝岩, 祝焕林, 翟桂兰, 等. 牛磺酸对动脉粥样硬化模型兔的抗炎作用研究[J]. 中国药房, 2012, 23 (17): 1582–1584. DOI:10.6039/j.issn.1001-0408.2012.17.16 |
| [9] | Huang RJ, Liu TW, Pang YS. Taurine dilated left ventricle of transforming growth factor TGF-β1 expression[J]. Modern Diagnosis and Treatment, 2004, 15 (2): 83–85. |
| [10] | 徐冬辉, 徐斌, 贺安宁, 等. 牛磺酸和维生素C对锰致大鼠氧化损伤的拮抗作用[J]. 毒理学杂志, 2014, 28 (6): 457–459. |
| [11] | 马玉珍, 韩景田, 陈玮, 等. 四氯化碳皮下注射制备肝纤维化模型的新设计[J]. 四川动物, 2007, 26 (3): 697–698. |
| [12] | 洪燕, 韩燕全, 罗欢, 等. 重楼皂苷对肝纤维化大鼠纤维化标志物的影响及其相关性分析[J]. 山西中医学院学报, 2014, 15 (6): 20–23. |
| [13] | 郭向东, 郭伟, 阿曼古, 等. 肝纤四项联合血小板检测在诊断肝纤维化中的价值[J]. 新疆医学, 2015, 45 : 167–170. |
| [14] | 叶春华, 刘浔阳. 四氯化碳综合法制备大鼠肝硬化模型[J]. 医学临床研究, 2005, 22 (5): 619–622. |
| [15] | Lartigue A, Burlat B, Coutard B, et al. The megavirus chilensis Cu, Zn-superoxide dismutase:the first viral structure of a typical CCS-independent hyperstable dimeric enzyme[J]. J Virol, 2014, 2588 (14): 254–261. |
| [16] | 白剑, 肖漓, 韩永, 等. 护肝片对小鼠肝纤维化模型中SOD和MDA的影响[J]. 实用药物与临床, 2015, 18 (8): 906–909. |
| [17] | Jin Y, Liu K, Peng J, et al. Rhizoma Dioscoreae Nipponicae polysaccharides protect HUVECs from H2O2-induced injury by regulating PPARγ factor and the NADPH oxidase/ROS-NF-κB signal pathway[J]. Toxicol Lett, 2014, 4274 (14): 1378–1382. |
| [18] | 郭景珍, 万方, 李忻, 等. 柴胡皂苷d对二甲基亚硝胺致肝纤维化大鼠炎症相关因子的影响[J]. 中华中医药杂志, 2008, 23 (11): 970–972. |
| [19] | Huang YH, Shi MN, Zheng WD, et al. The rapeutic effect of interleukin-10 on CCl4-induced hepatic fibrosis in rats[J]. World J Gastroenterol, 2006, 12 (9): 1386–1391. DOI:10.3748/wjg.v12.i9.1386 |
| [20] | Loftis JM, Huckans M, Ruimy S, et al. Depressive symptoms in patients with chronic hepatitis C are correlated with elevated plasma levels of interleukin-1beta and tumor necrosis factor-alpha[J]. Neurosci Lett, 2008, 430 (3): 264–268. DOI:10.1016/j.neulet.2007.11.001 |
2. Department of Laboratory, First Hospital of Handan, Handan 056002, China;
3. Department of Infectious Diseases, First Hospital of Handan, Handan 056002, China
 2017, Vol. 34
2017, Vol. 34