文章信息
- 曹红波, 张俊华, 翟静波, 刘智
- CAO Hong-bo, ZHANG Jun-hua, ZHAI Jing-bo, LIU Zhi
- 论药物临床试验网络化质控的标准化建设
- Construction of the standardization for drug clinical trials of quality based on network
- 天津中医药, 2017, 34(6): 392-395
- Tianjin Journal of Traditional Chinese Medicine, 2017, 34(6): 392-395
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.06.10
-
文章历史
- 收稿日期: 2017-02-16
2. 天津中医药临床评价研究所, 天津 300193
进入大数据时代, 基于计算机和网络技术的发展与成熟, 药物临床试验数据的电子化和远程管理是大势所趋。美国食品药品监督管理局(FDA)在其发表的关于创新关键路径的白皮书中也指出:电子化临床试验的实现是突破新药临床研究窘境的重要工具之一[1]。而与电子数据管理模式相适应, 积极构建药物临床试验的网络化监管平台也势在必行。网络化管理不但能够节省成本, 而且具有更多的优势[2]。2013年8月, FDA在最新颁布的临床试验新的监查指导原则——《基于风险的监查方法》(A Risk-Based Approach To Monitoring)中提出申办者在适合的条件下更多地使用中心化监查(centralized monitoring)[3]。中心化监查是要求建立基于网络化监管的质量监查体系。中心化监查的提出源于现场监查的种种弊端:现场监查大量占用临床试验的总成本, 约占总费用的25%~30%[4], 却无现场监查确实能够提升临床试验的质量证据[5]; 现场监查约70%的时间用于源数据核查和错误纠正上, 造成资源浪费的同时却对临床研究关键环节的监查力度不够[6]。
实际上, 伴随着药物临床试验数据管理的电子化和远程化发展, 数据体现形式与工作流程发生深刻的转变, 单靠临床监查已经不能完全满足药物试验质量控制的需要, 不但要求监查员、数据管理员、药品管理员、统计师等通过网络平台的通力协作, 而且还需要更多角色的加入[7]。因此, 临床试验质量控制体现了其多元化的特性, 面对这种特性, 试验管理者应当加快质量监管模式的转型, 积极构建药物临床试验中心化质量控制新体系, 见图 1, 即基于网络技术, 实现药物临床试验主要环节和人员的线上互动, 通过角色分配和责任划分, 实现动态质量监管。中心化质量控制新体系势必能够提高药物临床试验质量管理的精度和效度, 促进其更加完善。
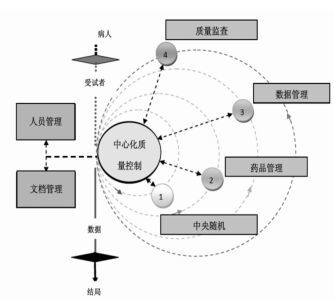
|
| 图 1 中心化质量控制体系 Fig. 1 Centralized quality control system |
实现药物临床试验中心化质量控制的核心是监管方式和管理措施的转型和标准化, 主要涉及线上标准(即人员权限与责任的划分)、线下标准(即文档与编码管理的规范)两个方面, 线上是核心功能的具体体现, 线下是线上功能发挥的有力支撑, 两者相辅相成, 都需要相应的标准进行规范, 不可或缺。
1 线上标准:人员权限与责任的划分由于借助于计算机和互联网技术的支持, 中心化质控需要通过明确的权限/责任划分来实现数据质量的优化。通过对不同角色的权限划分, 可以达到保护数据安全的目的, 同时也赋予每个角色相应的责任[8]。按照角色所处位置的不同, 系统管理平台的人员可以分为前台和后台两种角色。
1.1 前台主要人员包括主要研究者、数据核查员、前台质量监管员、统计分析人员。前台人员与试验数据直接接触, 相互之间应该有相应的互通平台, 通过线上交流, 达到对数据监管的目的。
1.1.1 主要研究者(PI)的权限和责任PI在数据管理平台中的主要权限为受试者的在线随机、数据的在线录入、数据的在线修改、观察结束时的批准完成等; PI应保证数据来源的合格, 负责按照E-CRF的要求通过数据采集管理模块进行研究数据的输入、保障输入数据的有效性、真实性。比如, 进入系统中的数据与原始数据的一致性和完整性, 最终提交的数据是否符合病例的实际情况等。
1.1.2 数据核查员(DI)的权限和责任DI在数据管理平台中的主要权限为数据核查、数据质疑、数据清理、数据锁定、数据冻结、数据提交等; DI应保证进入系统中的数据符合试验的基本设计, 通过数据质疑模块对数据的有效性进行动态核查和质疑、负责数据的日常维护和管理。比如, 病例的基本信息是否符合数据管理系统设计的要求, 是否存在逻辑性错误等。
1.1.3 前台质量监管员(FQS)的权限和责任FQS在数据管理平台中的主要权限为数据的质量监查、数据质疑等; FQS应负责对存在于系统中的所有数据进行阶段性维护, 从设计角度、医学角度全面核查数据, 以保证其最终能满足统计分析的要求。通过数据质疑管理模块和数据痕迹管理模块对试验进程、试验数据的质量进行动态监查, 通过线上沟通和现场监查, 督促并保证数据的有效性和可靠性。比如, 网络数据与实际病例的一致性核查, 数据信息是否有违背医学常识的问题等。
1.1.4 统计分析人员(SA)的权限和责任SA在数据管理平台中的主要权限为数据统计和分析; SA应在试验最后阶段参与数据的在线管理, 有权对不合理数据进行质疑并最终提交统计报告, 负责按照统计要求对提交的数据进行在线核查, 负责按照统计计划书的要求进行统计实施, 保证数据统计结果的信度和效度。比如, 是否有因人为因素导致部分数据的缺失问题等。
1.2 后台主要人员包括中央随机管理员、E-CRF设计人员、数据库测试员、数据库管理员、后台质量管理员。后台人员虽然不与试验数据直接接触, 但其工作十分重要, 主要是保证数据系统的稳定性, 为前台人员的工作提供基本保障。
1.2.1 中央随机管理员(IVA)的权限和责任IVA在数据管理平台中的主要权限为受试者的随机、药品的分配; IVA负责与PI配合工作, 保证中心随机系统的正常运转、保障随机系统产生数据的安全和有效、保证各中心药物发放的有序。比如, 在系统操作中, 由于PI的操作失误, 往往产生很多的废号、空号, 需要IVA人员及时对其进行清理; 在药品的分配中, 需要IVA设置预警和提醒, 保证试验药物的及时运输和发放等。
1.2.2 E-CRF设计人员(ECD)的权限和责任ECD在数据管理平台中的主要权限为数据采集器的设计; 负责基于数据采集器模块将纸质CRF无缝转换为数据采集器; 负责数据采集器各种功能的设计和实现。比如, 试验方案未能完整、有效甚至错误地转化为数据采集器, 将会给前台人员的工作带来巨大困难, 也最终影响到试验的进度和结果。
1.2.3 数据库测试员(DBT)的权限和责任DBT在数据管理平台中的主要权限为数据采集器的测试; DBT负责对数据采集器的质量进行评估、保证其与纸质CRF的一致性和各项功能应用的有效性。DBT的工作应与ECD的工作结合并行, 通过设计测试、测试完善的方式, 最终确定数据采集器的灵敏性。
1.2.4 数据库管理员(DBA)的权限和责任DBA在数据管理平台中的主要权限为数据库管理和数据的导出; DBA负责数据库后台运行稳定、保证试验数据的安全存储和备份、保证数据库中的数据完整的导入统计分析系统。
1.2.5 后台质量管理员(BQS)的权限和责任BQS在数据管理平台中的主要权限为系统管理和角色管理; BQS负责整个数据管理系统的稳定运行、通过用户管理模块实现对各个角色的权限划分, 并及时进行调整。比如:BQS需要为每一位前台人员分配相应的账号和密码, 并给予权限范围, 保证其工作平台的独立性。
2 线下标准文档与编码管理的规范为保证临床试验远程数据管理流程的稳定性, 仅仅依靠线上操作是远远不够的, 线下各种文档管理以及相应的标准操作规程设定非常必要。药物临床试验管理规范(GCP)的重要原则之一是“没有记录, 就没有发生”。ICH GCP 2.10中所述:“所有临床试验资料被记录、处理和储存的方式应当允许资料的准确报告、解释和核对[9]。
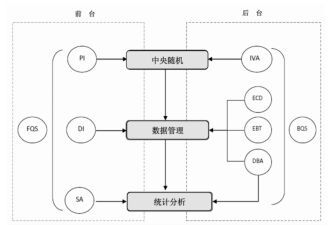
|
| 图 2 权限与责任的划分 Fig. 2 Dmarcation of right and duty |
远程数据管理系统涉及一系列的编码规则, 需要采用统一的标准进行命名, 而这些编码也应被存入文档, 作为日后数据导出和查验的依据。
2.1.1 试验编码规则按照试验类型、疾病类型等对每个试验进行分类, 采用统一的编码标准进行编码并存入文档。比如, 心血管类型(1) 中药注射剂(1) 安全性评价(2), 第101个(101) 试验, 编码为:(1-1-2-101)。
2.1.2 中心编码规则按照国家、地区、试验等规则, 采用统一的编码格式对每个试验中心进行编码。比如, 中国(1) 天津(2) 第一中心医院(5), 编码为:(1-2-5)。
2.1.3 E-CRF设计的编码规则在E-CRF的设计过程中, 很多数据采集形式都需要进行编码后才能正确体现并有效发挥其智能化的作用, 而这些原始编码必须进行分类存储和备份, 便于日后的查找和修改, 而且这些编码应当具有普适性, 进入系统中不同类型的试验都能够使用, 因此, 须建立一套完整的编码体系。
2.1.4 数据交换编码规则数据交换编码是为了保证远程数据管理系统与数据统计分析的有效对接而设定的。在数据导出时, 通过数据交换编码的指引, 远程数据管理系统中的编码将自动转换为统计分析所要求的变量和程序, 从而实现两个系统的无缝衔接, 使整个转换过程标准化。
2.1.5 WHO DrugWHO Drug是国际药品分类标准, 提供了在不同国家被使用的药品名。按照WHO Drug编码字典对试验中涉及的药品进行编码, 有助于试验数据的规范化。替代医学WHO Drug标准的制定是近年来中国研究人员努力的重点, 先后出现了一些兼顾中成药分类及编码标准化的实践和探索, 这些方法不仅借鉴了WHO的Anatomical-Therapeutic-Chemical (ATC)分类法, 同时保留了中成药的分类理论[10-11]。除此之外, 对于中药方剂的编码目前国内研究人员也进行了相关研究[12]。
2.1.6 医学编码医学编码是按照一定的标准对试验中所涉及的部分医学术语进行编码, 使得E-CRF能够自动进行相关术语的分级检索, 最终实现统一表达。目前, 中国也已制定了多项与中医临床术语相关的标准, 尝试建立中医临床术语分类标准框架, 以期为结构化的中医临床术语集的构建奠定基础[13]。
2.2 标准操作规程(SOP)制定根据药物临床试验网络监管的要求, 制定相应的SOP是非常必要的, SOP将有助于对试验当中的主要环节进行约束, 防止或减少人为偏倚。
2.2.1 采集器设计管理SOPE-CRF的设计是一项复杂而繁琐的工程, 期间必须建立各种标准操作规程并形成相关文档。包括:数据采集器适应性分析、数据采集器的设计、数据采集器的测试等。
2.2.2 系统管理SOP系统管理是整个远程数据管理系统运行稳定的关键, 发挥着调控和系统维护的重要作用。包括:访问角色管理、访问权限管理等。
2.2.3 数据管理SOP制定数据管理的标准化操作规程并严格执行, 有利于保证数据的安全和稳定。包括:数据核查、数据质疑、数据修正、数据备份和恢复、数据库锁定、数据库冻结、数据库解锁、数据揭盲、数据提交等。近年来发布的一些行业标准和法规分别从数据管理系统的计算机系统、软件认证、电子签名、电子数据的采集、电子文档和电子源数据、电子申报等方面规定了电子数据管理的基本规范[14-16]。
2.2.4 中央随机化管理SOP指中央随机化系统使用者应采取的规范化操作。包括:受试者的随机、药物的指定、药物的发放、药物的回收等。
2.2.5 远程数据管理系统培训SOP指针对远程数据管理系统使用者的培训, 保证系统使用者操作正确。包括:研究者培训、数据管理者培训、质量监查员培训等。
3 总结药物临床试验的质量控制是一个复杂的、系统的工程, 随着大数据产业的发展和数据共享平台的不断完善, 试验数据的网络化管理将是大势所趋, 积极转化思路, 构建与其相适应的中心化质量控制体系和标准是医学研究人员今后一段时期探索的方向, 该标准的建立应将医学临床研究设计思路与计算机网络技术密切结合, 并能保证在试验数据的质量控制方面起到事半功倍的效果, 结合了近期在临床试验数据管理方面的经验, 希望能抛砖引玉, 启发同行的思考。
| [1] | US Food and Drug Administration. Guidance for industry:computerized systems used in clinical investigations [EB/OL]. http://www.fda.gov/downloads/Drugs/Guidance Compliance Regulatory Information/Guidances/UCM070266.pdf. 2013-06-24. |
| [2] | Babre D. Electronic data capture-Narrowing the gap between clinical and data management[J]. Perspect Clin Res, 2012, 2 (1): 1–3. |
| [3] | FDA. Guidance for industry-oversight of clinical investigations-a risk-based approach to monitoring[EB/OL].http://www.fda.gov/downloads/drugs/guidance compliance regulatory information/guidances/ucm269919.pdf. 2016-07-15. |
| [4] | Getz K. Study monitor workload high & varied with wide disparity by global region[J]. Tufts CSDD Impact Report, 2012, 14 : 1–4. |
| [5] | Eisenstein EL, Lemons II PW, Tardiff BE, et al. Reducing the costs of phase Ⅲ cardiovascular clinical trials[J]. American Heart Journal, 2005, 149 (3): 482–488. DOI:10.1016/j.ahj.2004.04.049 |
| [6] | Morrison BW. Monitoring the quality of conduct of clinical trials: a survey of current practices[J]. Clinical Trials, 2011, 8 (3): 342–349. DOI:10.1177/1740774511402703 |
| [7] | Howells K. E-clinical integration strategies[J]. Drug Discover Today, 2006, 3 (2): 167–171. DOI:10.1016/j.ddtec.2006.06.009 |
| [8] | Khaled E, Elizabeth J, Margaret S, ed al. The use of electronic data capture tools in clinical trials: web survey of 259 canadian trials[J]. J Med Internet Res, 2009, 11 (1): e8. DOI:10.2196/jmir.1120 |
| [9] | International Conference on Harmonization. Guideline for Industry E6 Good Clinical Practice: Consolidated Guideline [EB/OL]. http://www.ich.org/products/guidelines/efficacy/efficacy-single/article/good-clinical-practice.html. 2012-09-20. |
| [10] | 陈红斗, 蒋进广, 朱秀银. ATC分类编码和中成药分类编码比较分析[J]. 南京中医药大学学报, 2013, 29 (6): 510–513. |
| [11] | 赵文光, 詹若挺, 杨显, 等. 基于临床用药的中成药分类探究[J]. 世界科学技术-中医药现代化, 2012, 14 (2): 1357–1362. |
| [12] | 廖利平, 林晓生. 关于中药方剂编码的研究[J]. 中国中医药信息杂志, 2011, 18 (1): 34–35. |
| [13] | 袁敏, 施毅. 中医临床术语分类标准框架的思考与构建探索[J]. 世界科学技术-中医药现代化, 2012, 14 (3): 1599–1603. |
| [14] | 邓亚中, 于嘉, 刘川, 等. 电子化时代临床数据管理现状和未来趋势[J]. 中国新药杂志, 2014, 23 (8): 879–883. |
| [15] | FDA. Guidance for industry electronic source data in clinical investigations [EB/OL]. http://www.fda.gov/downloads/Drugs/Guidance Compliance Regulatory Information/Guidances/UCM328691.pdf. 2015-1-22. |
| [16] | EMA.Reflection paper on expectation for electronic source data and data transcribed to electronic data collection tools in clinical trials [EB/OL]. http://www.ema.europa.eu/dose/en-GB/document-library/Regulatory-and-procedural-guideline/2010/08/WC500095754.pdf. 2010-06-09. |
2. Tianjin Institute of Traditional Chinese Medicine Clinical Evaluation, Tianjin 300193, China
 2017, Vol. 34
2017, Vol. 34