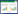文章信息
- 郭洁, 王月平, 张崴, 杜永红, 王玉华, 宋殿荣
- GUO Jie, WANG Yue-ping, ZHANG Wei, DU Yong-hong, WANG Yu-hua, SONG Dian-rong
- 补肾调冲方对PCOS患者子宫内膜保护作用研究
- Study on the effects of endometrium of women with polycystic ovary syndrome by Bushen Tiaochong decoction
- 天津中医药, 2017, 34(6): 403-406
- Tianjin Journal of Traditional Chinese Medicine, 2017, 34(6): 403-406
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.06.14
-
文章历史
- 收稿日期: 2017-01-20
2. 天津中医药大学, 天津 300193
多囊卵巢综合征(PCOS)是青春期及育龄期女性常见的妇科内分泌紊乱性疾病, 在育龄期妇女中的发病率为5%~10%, 临床主要表现为排卵障碍、月经不调或闭经、不孕、多毛、肥胖等。PCOS患者由于长期不排卵, 受单纯雌激素持续刺激, 而无孕激素拮抗, 子宫内膜会出现不同程度增生, 发生率约为35%, 其远期并发症——子宫内膜癌的发生率较非PCOS女性增加3倍[1]。目前本病多采用激素类药物治疗, 但存在不良反应及停药后易复发等弊端[2]。中医药治疗本病具有明显优势[3-4], 且前期研究表明补肾调冲方可以通过改善卵巢功能, 恢复正常月经周期, 促进卵巢排卵[5-10]。本研究拟通过观测补肾调冲方干预后PCOS患者子宫内膜细胞形态学以及分泌期子宫内膜细胞标志物PR、TGF-β1、Smad4表达的变化, 探讨补肾调冲方对PCOS患者子宫内膜的保护作用。
1 实验材料 1.1 标本来源子宫内膜组织来源于在天津中医药大学第二附属医院妇科行诊断性刮宫术的PCOS患者, 年龄20~35岁, 术前半年内未服用过激素类药物, 病理诊断为单纯增生型子宫内膜。所有标本采集均经医院伦理委员会批准并取得患者及家属知情同意。
1.2 实验药材中药颗粒购自北京康仁堂药业有限公司。孕酮标准品(V900699)、17β-雌二醇标准品(E2758) 均购自美国Sigma公司。
2 实验方法 2.1 PCOS子宫内膜间质细胞和腺上皮细胞的体外混合培养无菌条件下获取子宫内膜组织, 清洗、剪碎、消化、筛网过滤、离心、重悬细胞团, 接种于培养瓶, 置于培养箱中培养。消化传代后分别以Gimusa染色法、免疫荧光法鉴定子宫内膜间质细胞及腺上皮细胞。
2.2 子宫内膜细胞体外生长曲线的测定取生长状态良好的子宫内膜细胞接种于96孔板中。采用噻唑蓝(MTT)法测定492 nm处吸收光度值(OD值), 连续检测7 d, 即可绘出细胞的生长曲线。
2.3 药物作用子宫内膜细胞浓度的测定取生长状态良好的子宫内膜细胞, 待细胞生长进入对数生长期时加入含不同浓度药物的无血清培养基培养。继续培养48 h后, MTT法检测每孔492 nm处OD值, 计算细胞生长抑制率。细胞生长抑制率IR=(A492阴性对照-A492加药)/A492阴性对照×100%。在细胞抑制率IR≤10%所对应的药物浓度范围内加药。
2.4 透射电镜观察药物干预后子宫内膜细胞超微结构变化取体外生长状态良好的子宫内膜细胞, 待细胞进入对数生长期时, 实验组予补肾调冲方干预, 阳性对照组予孕激素标准品干预, 阴性对照组予17β-雌二醇标准品干预, 空白对照组只更换培养基, 继续培养48 h后终止培养。收集、固定细胞, 切片, 观察。
2.5 ELISA法检测子宫内膜细胞中孕激素受体的浓度利用酶联免疫吸附测定实验分别检测各实验分组子宫内膜细胞中孕激素受体的浓度, 分别判断实验组子宫内膜细胞在功能学方面的变化。
2.6 RT-PCR检测子宫内膜细胞中TGF-β1和Smad4 mRNA表达PCR产物电泳后经Gel-PRO ANALYZER凝胶定量分析软件对电泳条带进行灰度分析, 目的基因相对表达强度=目的基因电泳条带灰度值/β-actin内参照条带灰度值。
2.7 Western blot检测TGF-β1、Smad4蛋白的表达利用凝胶自动分析成像软件扫描分析结果, 以β-actin为内参照, 对蛋白条带进行分析。
2.8 统计方法采用SPSS 23.0统计软件包处理, 计量资料用均数±标准差(x±s)表示, 多组均数的比较采用单因素方差分析(one-way ANOVA), 组间两两比较采用SNK法。P<0.05为差异有统计学意义。
3 结果 3.1 子宫内膜细胞的体外培养与鉴定子宫内膜腺上皮细胞24 h贴壁基本完成, 贴壁后细胞呈多角形或蝌蚪形, 轮廓清晰; 48 h后细胞呈团状或旋涡状排列, 单层致密平铺生长; 3~4 d后细胞间出现拉网现象, 边界清楚, 细胞周界呈裙边状; 5~6 d后细胞逐渐融合成片; 7~10 d细胞逐渐凋亡。传代培养至3~4代后, 腺上皮细胞基本消失。子宫内膜间质细胞2 h即开始贴壁, 24 h完全贴壁, 贴壁的间质细胞细胞较扁平, 呈长梭形、三角形或星形, 具有成纤维细胞形态, 平铺生长, 约3~4 d融合成片。传代培养后间质细胞多数为具有成纤维细胞形态的梭形细胞。间质细胞易传代, 传至10代细胞形态无明显改变。Gimusa染色后子宫内膜细胞形态清晰可见, 子宫内膜腺上皮细胞贴壁后呈多角形或蝌蚪形, 细胞呈团状或旋涡状排列, 形如玫瑰花; 子宫内膜间质细胞具有成纤维细胞形态, 呈长梭形、三角形或星形。
应用免疫荧光法对体外培养第2代子宫内膜细胞进行鉴定发现, 间质细胞特异性表面蛋白Vimentin表达阳性; 腺上皮细胞特异性表面蛋白CK-19表达阳性。
3.2 MTT法检测子宫内膜细胞体外生长曲线体外培养子宫内膜细胞发现, 第1~2天细胞增殖速度较缓慢, 第3天细胞进入对数生长期, 并可以持续到第5天, 5 d后细胞增殖速度减慢, 第6天细胞生长进入平台期(见图 1)。所以, 本实验选取细胞体外培养第3天开始实施药物干预。
|
| 图 1 子宫内膜细胞体外生长曲线 Fig. 1 Growth of endometrial cells in vitro |
参考细胞生长抑制率IR≤10%所对应药物浓度加药干预子宫内膜细胞。实验结果表明:补肾调冲方加药浓度为2 mg/mL, 48h IR=10.2%;孕酮标准品加药浓度为1×10-6 mol/L, 48h IR=9.9%;17β-雌二醇加药浓度为5×10-7 mol/L, 48h IR=9.7%。
3.4 透射电镜观察药物干预后子宫内膜腺上皮细胞超微结构变化经透射电镜观察发现, 雌激素组与空白对照组子宫内膜腺上皮细胞游离面可见少量微绒毛, 笔直排列, 细胞核位于细胞中部, 核分裂相少见, 粗面内质网池短而窄, 线粒体、核糖体及高尔基体随机分散于细胞质中; 补肾调冲方组与孕激素组子宫内膜腺上皮细胞游离面绒毛丰富, 较长且常有分支, 甚至肿胀, 线粒体体积增大, 呈长形, 粗面内质网扩张, 高尔基体肿胀。
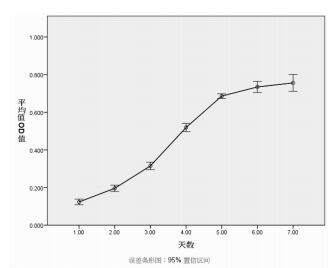
3.5 ELISA法检测药物干预后子宫内膜细胞中孕激素受体的浓度与雌激素组、空白对照组相比, 实验组子宫内膜细胞中的孕激素受体的浓度下降, 差异有统计学意义(P<0.05);实验组子宫内膜细胞中孕激素受体的浓度与孕激素组相当, 差异无统计学意义(P>0.05), 见表 1。
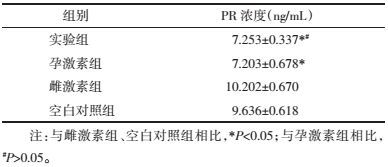 |
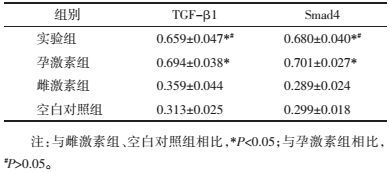
半定量RT-PCR电泳灰度值比较分析, 与雌激素组、空白对照组相比, 实验组TGF-β1 mRNA、Smad4 mRNA表达升高, 差异有统计学意义(P<0.05);与孕激素组相比, 实验组TGF-β1 mRNA、Smad4 mRNA表达相当, 差异无统计学意义(P>0.05), 见表 2, 图 2。
 |
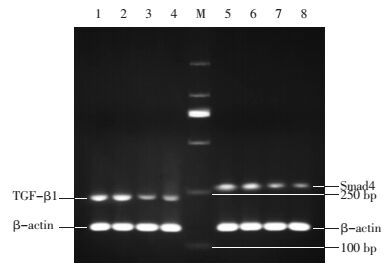
|
| 图 2 目的基因扩增产物电泳图 Fig. 2 Electrophoretic map of target gene amplification product M:DNA Maker; 1:实验组TGF-β1;2:孕激素组TGF-β1;3:雌激素组TGF-β1;4:空白对照组TGF-β1;5:实验组Smad4;6:孕激素组Smad4;7:雌激素组Smad4;8:空白对照组Smad4 |
Western blot结果分析, 与雌激素组、空白对照组相比, 实验组TGF-β1、Smad4蛋白表达升高, 差异有统计学意义(P<0.05);实验组TGF-β1、Smad4蛋白表达与孕激素组相当, 差异无统计学意义(P>0.05), 见表 3, 图 3、4。
 |

|
| 图 3 TGF-β1蛋白印迹电泳图 Fig. 3 Western blot of TGF-β1 1:实验组; 2:雌激素组; 3:孕激素组; 4:空白对照组 |
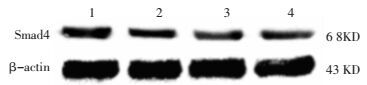
|
| 图 4 Smad4蛋白印迹电泳图 Fig. 4 Western blot of Smad4 1:实验组; 2:雌激素组; 3:孕激素组; 4:空白对照组 |
研究发现, 孕激素受体在增生早期表达量逐渐增加, 至排卵期达高峰, 此后PR逐渐下降, 至分泌晚期消失, 这已成为内膜分化成熟的重要标志[11]。TGF-β1是子宫内膜正常生长、发育不可缺少的一种生长因子。对于正常子宫内膜, TGF-β1在增生期及分泌早期呈低表达, 分泌中期表达上升, 分泌晚期达到峰值[12]。PCOS患者子宫内膜中TGF-β1呈异常表达状态, 并与子宫内膜上皮细胞增生能力降低、子宫内膜敏感性降低有关[13-14]。Smad4是TGF-β1信号转导通路的中心分子, 也是其必需的下游分子, 因此, 检测子宫内膜组织中PR水平、TGF-β1、Smad4 mRNA及蛋白表达量可以作为衡量其周期性变化的客观指标, 有助于客观评价补肾调冲方作用下PCOS患者子宫内膜增殖与分泌的变化。
本实验结果发现, 以补肾调冲方干预PCOS患者子宫内膜细胞后, 子宫内膜腺上皮细胞游离面绒毛丰富, 较长且常有分支, 甚至肿胀, 线粒体体积增大, 呈长形, 粗面内质网扩张, 高尔基体肿胀, 子宫内膜细胞在形态学上呈现出由增生期向分泌期转变的趋势。在分子水平, 补肾调冲方干预后子宫内膜细胞中的孕激素受体的浓度下降, TGF-β1及其效应分子Smad4 mRNA及蛋白表达升高, 且与孕激素组相当(P>0.05), 也进一步佐证补肾调冲方促进了子宫内膜细胞由增生期向分泌期的转变。本研究以阴阳消长理论及肾-天癸-冲任-胞宫理论为基础, 证实补肾调冲方可能发挥了类似孕激素样的作用, 促进子宫内膜细胞由增生期向分泌期转变, 从而保护了PCOS患者子宫内膜, 为进一步探索补肾调冲方治疗PCOS的作用机制奠定了理论基础。
| [1] | Zeina Haoula, Maisa Salman, William Atiomo L. Evaluating the association between endometrial cancer and polycystic ovary syndrome[J]. Human Reprod, 2012, 27 (5): 1327–1331. DOI:10.1093/humrep/des042 |
| [2] | Falsette L, Gambera A, Tisi G. Efficacy of the combination ethiny loestradiol and cyproterone acetate on endocrine, clinical and Ultrasonographic profile in polycystic ovarian syndrome[J]. Hum Reprod, 2001, 16 (1): 36–42. DOI:10.1093/humrep/16.1.36 |
| [3] | 李小平, 林舒, 叶双, 等. 滋癸汤加减治疗肝肾阴虚型多囊卵巢综合征疗效观察[J]. 中国中西医结合杂志, 2011, 31 (8): 1070–1073. |
| [4] | 李丽, 孙维峰. 中药补肾活血法纠正青春期多囊卵巢综合征内分泌状态的临床研究[J]. 实用医学杂志, 2009, 25 (13): 2177–2179. DOI:10.3969/j.issn.1006-5725.2009.13.071 |
| [5] | 夏天, 韩冰. 补肾调冲方含药血清对大鼠卵巢颗粒细胞增殖、激素分泌和mRNA表达的影响[J]. 现代药物与临床, 2011, 26 (5): 384–388. |
| [6] | 夏天, 沈嵘, 侯莉莉, 等. 补肾调冲方对大鼠卵巢颗粒细胞增殖与分泌及其IGF-1mRNA表达的影响[J]. 辽宁中医杂志, 2006, 33 (9): 1084–1086. |
| [7] | 夏天, 付于, 韩冰, 等. 补肾调冲方含药血清对高雄激素培养大鼠卵巢颗粒细胞增殖与分泌的影响[J]. 中国中西医结合杂志, 2006, 26 (4): 348–351. |
| [8] | 高慧, 杨涓, 夏天, 等. 补肾调冲方对卵巢早衰大鼠性激素水平和卵巢组织形态学的影响[J]. 国医论坛, 2008, 23 (1): 35–39. |
| [9] | 王利红, 赵丽颖, 夏天. 补肾调冲方改善促排卵周期中子宫内膜容受性的临床观察[J]. 天津中医药大学学报, 2011, 30 (3): 150–152. DOI:10.11656/j.issn.1673-9043.2011.03.10 |
| [10] | 白瑞, 宋文嘉, 夏天. 补肾调冲方结合西药对促排卵周期中子宫内膜过薄的临床研究[J]. 四川中医, 2012, 30 (11): 78–79. |
| [11] | 李岩, 邢志军, 石心泉, 等. 人月经周期子宫内膜雌、孕激素受体的变化[J]. 中国计划生育学杂志, 1998, 9 (41): 397–398. |
| [12] | 曾品鸿. MUC1和TGF-β1在子宫内膜的表达及其在着床窗期与雌、孕激素相关性的研究[D]. 重庆: 重庆医科大学, 2003. http://cdmd.cnki.com.cn/Article/CDMD-10631-2003099734.htm |
| [13] | Heemers HV, Tindall DJ. Androgen receptor (AR) coregulators: a diversity of functions converging on and regulating the AR transcriptional complex[J]. Endocr Rev, 2007, 28 (7): 778–808. DOI:10.1210/er.2007-0019 |
| [14] | Nasu K, Nishida M, Matsumoto H, et al. Regulation of proliferation, motility, and contractivity of cultured human endometrial stromal cells by transforming growth factor-beta isoforms[J]. Fertil Steril, 2005, 84 (S2): 1114–1123. |
2. Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China
 2017, Vol. 34
2017, Vol. 34