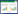文章信息
- 牛子长, 高云航, 王兴业, 毛浩萍
- NIU Zi-chang, GAO Yun-hang, WANG Xing-ye, MAO Hao-ping
- 盐酸药根碱抗异丙肾上腺素诱导的心肌H9c2细胞肥大作用研究
- Anti isoprenaline-induced cardiac hypertrophy effect of Jatrorrhizine hydrochloride on H9c2 cells
- 天津中医药, 2017, 34(6): 411-414
- Tianjin Journal of Traditional Chinese Medicine, 2017, 34(6): 411-414
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.06.16
-
文章历史
- 收稿日期: 2017-03-04
2. 天津中医药大学中医药研究院, 天津 300193
心肌肥大是心肌细胞受激素水平变化或理化刺激时作出的一种基本应答[1], 是一种代偿过程, 它能维持一定心输出量而保证正常心脏功能。然而高血压、冠心病等长时间应激导致的持续性心肌肥大又是导致心血管疾病发病率和病死病残率显著升高的独立危险因素。心肌肥大极易导致心肌缺血、心律失常(包括猝死)的发生, 最终可发展为心力衰竭[2-3]。研究显示长期高水平的β-AR刺激是诱发心肌细胞肥大的重要因素[4-5]。因此, 从β-AR角度阐明药物对心肌细胞肥大的影响对开发有效药物和降低病死病残率有重大意义。
黄连为毛莨科植物黄连的干燥根茎, 味苦, 寒, 归心、脾、胃、肝、胆、大肠经, 具有清热燥湿, 泻火解毒的功效。主要用于湿热痞满, 呕吐吞酸, 心火亢盛, 心烦不寐, 心悸不宁等症的治疗[6-7]。盐酸药根碱是中药黄连中的主要有效成分之一, 研究显示盐酸药根碱具有抗心律失常及调节脂肪细胞糖脂代谢的作用[8-9], 但未见盐酸药根碱对心肌肥大相关研究。鉴于上述原因, 从β-AR角度研究盐酸药根碱是否具有抗心肌细胞肥大作用及其相关机制。
1 材料与方法 1.1 试剂盐酸药根碱购自天津食品药品检验所。异丙肾上腺素(ISO)(美国Sigma公司)。DMEM培养液、胎牛血清、0.25%胰酶和Lipofectamine 2000(美国Invitrogen公司)。75 U/mL青霉素和75 μg/mg链霉素(美国Hyclone公司)。BCA蛋白检测试剂盒(中国碧云天生物技术有限公司)。β1受体质粒和Tag-lite试剂(法国Cisbio公司)。钙-4试剂盒(美国Molecular Devices公司)。
1.2 H9c2细胞H9c2细胞(美国ATCC公司)。
2 方法 2.1 细胞培养H9c2心肌细胞株培养于完全培养基(含10%胎牛血清的DMEM培养液)中, 置于37 ℃, 5%二氧化碳(CO2)培养箱中传代培养, 取对数生长期、生长良好的细胞进行实验。
2.2 CCK-8法检测不同浓度盐酸药根碱对H9c2细胞活力的影响H9c2心肌细胞胰酶消化后使用完全培养基种于24孔板中, 24 h后换含1%胎牛血清培养基同步化。24 h后分为对照组及盐酸药根碱10-8、10-7和10-6 mol/L组给予含相应浓度药根碱的完全培养基。48 h后吸弃细胞上清液, 加入含10%CCK-8的完全培养基溶液培养2 h后450 nm波长下检测光密度(OD)值。
2.3 细胞肥大模型及给药分组H9c2心肌细胞胰酶消化后使用完全培养基种于24孔板中, 24 h后换含1%胎牛血清培养基同步化。24 h后分为对照组及ISO 2、5和10 μmol/L浓度组给予相应浓度ISO。48 h后0.25%胰酶消化, 采用Vicell细胞计数仪(Beckman Coulter, 美国)计数后进行蛋白含量检测。
细胞给药分组如下:对照组、2 μmol/L ISO组、2 μmol/L ISO+盐酸药根碱10-8 mol/L组、2 μmol/L ISO+盐酸药根碱10-7 mol/L组和2 μmol/L ISO+盐酸药根碱10-6 mol/L组。给药方法同模型。
2.4 细胞蛋白含量测定药物作用48 h后消化各组细胞并在倒置显微镜下记录细胞数。提取细胞总蛋白按BCA蛋白含量检测试剂盒说明书检测各组细胞中总蛋白含量。以总蛋白含量/细胞数为指标研究药物对ISO诱导的心肌细胞肥大的影响。
2.5 实时-聚合酶链反应(PCR)法检测细胞内心钠肽(ANP)和脑钠钛(BNP) mRNA含量细胞接种于6孔板培养24 h后更换1%血清培基, 继续培养24 h。吸出培养板中各孔的培养液, 分别加入不同浓度药物。48 h后弃去培养液, 磷酸缓冲盐溶液(PBS)洗涤2次, 加入Trizol试剂完全裂解细胞, 收集裂解后的细胞液, 取1 mL裂解液, 氯仿抽提, 异丙醇沉淀, 回收总RNA, 贮存于-70 ℃待用。紫外分光光度计A260/A280鉴定RNA纯度和浓度。取约1 μg总RNA, 进行反转录。反转录条件为:42 ℃ 60 min, 99 ℃ 2 min, 4 ℃保存。ANP mRNA引物序列:上游序列GCCGGTAGAAGATGAGGTCA, 下游序列GGGCTC-CAATCCTGTCAATC; BNP mRNA引物序列:上游序列ATCTGTCGCCGCTGGGAGGT, 下游序列TGGAT-CCGGAAGGCGCTGTC; 大鼠GAPDH mRNA引物序列:上游序列TGAAGGTCGGTGTGAACGGATTTGGC, 下游序列CATGTAGGCCATGAGGTCCACCAC。ANP、BNP和内参GADPH的引物用灭菌水溶解并配制成100 μmol/L的上下游引物混合液, 使用浓度为10 μmol/L。实时PCR反应条件:预变性94 ℃ 4 min, 变性94 ℃ 45 s, 退火60 ℃ 45 s, 延伸72 ℃ 45 s, 终末延伸72 ℃ 5 min, 4 ℃终止, 40循环。循环扩增结束后, 记录各组Ct值, 根据2-ΔΔCt法计算各组相对mRNA含量。
2.6 细胞内钙离子浓度检测H9c2细胞种于黑色96孔细胞培养板中。给药48 h后吸弃上清液, 加入钙-4试剂。37 ℃培养箱中孵育90 min。使用多功能读板机Flexstation 3检测各孔的荧光值(检测条件:激发波长为485 nm, 发射波长为525 nm)。
2.7 竞争性结合法考察ISO和盐酸药根碱与β1AR的结合β1 AR质粒采用Lipofectamine 2000按照转染试剂盒说明进行质粒转染。24 h后使用Tag-lite标记液标记1 h。收集标记好的细胞调整细胞浓度为106个/mL。每孔10 μL细胞悬液加入384孔板中。每孔分别加入4X浓度的ISO及盐酸药根碱溶液。再向每孔细胞中加入5 μL 400 nmol/L荧光标记盐酸阿普洛尔(β1 AR特异性结合配体)。采用时间分辨荧光方法检测不同浓度ISO及盐酸药根碱与盐酸阿普洛尔与β1 AR的竞争性结合能力, 计算IC50。
2.8 Westernblot H9c2细胞接种于6孔板培养24 h后更换1%血清培基, 继续培养24 h。吸出培养板中各孔的培养液, 分别加入不同浓度药物。48 h后弃去培养液, PBS洗涤2次, 加入细胞裂解液后提取蛋白进行蛋白定量。取适量蛋白进行SDS-PAGE凝胶电泳、转膜、蛋白封闭、一抗及二抗孵育后曝光。蛋白量用BIO-RAD软件进行定量。
2.9 统计学分析全部数据均采用SPSS 19.0分析软件对数据进行统计分析。数据用均数±标准差(x±s)表示。组间比较采用单因素方差分析, 组间的两两比较采用LSD法, P<0.05或P<0.01为差异有统计学意义。
3 结果 3.1 不同浓度盐酸药根碱对H9c2细胞活性的影响采用CCK-8法发现, 10-8~10-6 mol/L盐酸药根碱作用48 h后心肌H9c2细胞OD值与空白对照组OD值无统计学差异(P>0.05)。说明10-8~10-6 mol/L盐酸药根碱作用48 h对心肌H9c2细胞活性无显著影响, 可应用于后续实验研究。
3.2 异丙肾上腺素(ISO)诱导的心肌H9c2细胞肥大模型的建立及盐酸药根碱对ISO诱导的H9c2细胞肥大的影响结果显示, 作用48 h后2~10 μmol/L ISO均能显著促进单个H9c2细胞总蛋白含量增加, 但是以2 μmol/L ISO效果最佳, 见表 1。因此, 选择2 μmol/L ISO为后续实验中的模型浓度。
 |
与对照组相比, 2 μmol/L ISO显著增加单个细胞内总蛋白含量。与2 μmol/L ISO组相比, 10-6mol/L盐酸药根碱能显著减少由2 μmol/L ISO引起的细胞内总蛋白含量的增加(P<0.01)。见表 1。
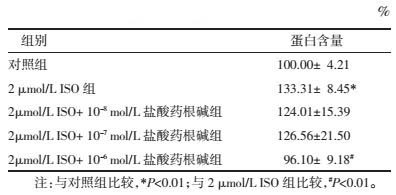
3.3 盐酸药根碱对ISO引起的H9c2细胞ANP和BNP mRNA含量升高的影响2 μmol/L ISO显著增加细胞内ANP和BNP mRNA表达, 10-7mol/L和10-6mol/L药根碱能有效抑制ISO诱导的ANP和BNP mRNA表达, 差异具有统计学意义(P<0.01)。见表 2。
 |
细胞内钙离子浓度升高是ISO诱导心肌细胞肥大的机制之一。研究结果显示, 与正常对照组相比, ISO显著升高细胞内钙离子浓度(P<0.01)。同时, 研究还发现与ISO组相比, 盐酸药根碱呈浓度依赖性方式显著抑制异丙肾上腺素诱导的H9c2细胞内钙离子浓度的升高(P<0.05或P<0.01)。见表 3。
 |
将β1肾上腺素受体转染入HEK293T细胞后, 用Tag-lite荧光物质标记细胞。采用均相时间分辨荧光(HTRF)技术通过竞争性结合的方法分别研究ISO与盐酸药根碱与β1肾上腺素的结合能力。结果显示ISO的IC50为96.7 nmol/L, 而盐酸药根碱的IC50值为283 nmol/L。
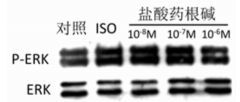
3.6 盐酸药根碱对ISO诱导的ERK信号通路激活的影响结果发现盐酸药根碱显著抑制ISO诱导的ERK信号通路的激活。见图 1。
|
| 图 1 盐酸药根碱对ISO诱导的ERK信号通路激活的影响 Fig. 1 Effect of Jatrorrhizine hydrochloride on ISO induced activation of ERK signaling pathway |
心室重构过程中, 心脏为维持有效循环量、保持血压稳定, 在心输出量减少时首先激活交感神经系统(SNS)。交感神经系统的激活在心力衰竭早期是有益的, 它的激活能够代偿由于左心室功能障碍导致的心肌功能下降, 早期心肌肥大是一种强有力的代偿形式[10-11], 然而它不是无限度的。SNS的持续激活则肥大心肌的功能便不能长期维持而导致心肌细胞凋亡, 从而造成心功能下降和血流动力学紊乱, 这又反过来刺激交感神经系统兴奋, 形成恶性循环, 最终导致心力衰竭的发生和发展。因此, 研究控制心肌细胞肥大的药物及其作用对抗心力衰竭治疗具有重要意义。
研究显示交感神经系统诱导的心肌细胞肥大过程中β肾上腺素受体(βAR)系统起了至关重要的作用[12]。βAR家族是G蛋白偶联受体家族(GPCRs)的成员[13]。该受体可调控一系列的生命活动, 包括心脏起搏、心肌收缩、血管和支气管平滑肌的舒张以及糖和脂的代谢[14-15]。研究βAR系统在心肌细胞肥大和凋亡过程中的作用及机制成为了目前抗慢性心力衰竭研究的热点之一。本实验将β1受体激动剂异丙肾上腺素作用于培养的心肌H9c2细胞, 48 h后发现单个细胞中总蛋白含量显著增加, 成功制作心肌细胞肥大模型。
研究显示盐酸药根碱显著抑制ISO诱导的H9c2细胞肥大作用。ANP和BNP是心肌肥大的两个特异性指标, 10-7 mol/L和10-6 mol/L药根碱能有效抑制ISO诱导的ANP和BNP mRNA表达, 进一步验证了药根碱抗心肌肥大作用。此外, 研究发现ISO显著升高细胞内钙离子浓度, 这与文献报道的一致[16]。给予盐酸药根碱能显著抑制ISO诱导的细胞内钙离子浓度升高; 采用竞争性结合实验, 将带Tag-lite荧光标记的β1肾上腺素受体质粒转染HEK293T细胞后, 发现盐酸药根碱与β1肾上腺素受体竞争性结合IC50值为283 nmol/L; 而ISO与β1肾上腺素受体竞争性结合的IC50为96.7 nmol/L。虽然盐酸药根碱与β1肾上腺素受体的结合能力低于ISO, 但盐酸药根碱亦显示出一定的β1肾上腺素受体结合能力。这可能是其抑制ISO诱导的心肌细胞肥大的作用机制之一。
结果提示盐酸药根碱可通过与ISO竞争性的与β1肾上腺受体结合, 抑制ISO诱导的ANP及BNP的上调, 从而达到抑制心肌肥大, 保护心肌的作用。
| [1] | 柏丹娜, 高延, 王海昌, 等. Inpp5f抑制血管紧张素Ⅱ诱导的心肌细胞肥大反应[J]. 心脏杂志, 2016, 28 (2): 145–148. |
| [2] | Lyon RC, Zanella F, Omens JH, et al. Mechanotransduction in cardiac hypertrophy and failure[J]. Circulation research, 2015, 116 (8): 1462–1476. DOI:10.1161/CIRCRESAHA.116.304937 |
| [3] | McLenachan JM, Dargie HJ. Left ventricular hypertrophy as a factor in arrhythmias and sudden death[J]. Am J Hypertens, 1989, 2 (2 pt 1): 128–131. |
| [4] | 孙丹云, 刘红梅, 唐渊, 等. G蛋白抑制多肽汇利欣康对心肌肥大microRNA表达的影响[J]. 中国药理学通报, 2014, 30 (2): 175–179. |
| [5] | 王明丰, 蒋青松. 一氧化氮参与非诺贝特抗高糖高胰岛素诱导的心肌肥大[J]. 中国药理学通报, 2009, 25 (9): 1210–1214. |
| [6] | 王星, 陈康寅, 贾忠伟, 等. 黄连解毒汤合五味消毒饮治疗急性感染性心内膜炎的临床观察[J]. 中国中医急症, 2016, 25 (6): 1226–1228. |
| [7] | 朱宇雯, 何晓婕, 杨青. IDO抑制剂黄连碱对Aβ与IFN-γ联用诱导的PC12细胞凋亡的影响[J]. 复旦学报(医学版), 2015, 42 (5): 684–688. |
| [8] | 陈超, 韩虹, 方达超. 药根碱对实验动物心肌缺血和复灌性损伤的保护作用[J]. 中国药理学通报, 1989, 5 (6): 373–375. |
| [9] | 王慧, 陈刘, 姜友昭, 等. 药根碱对脂肪细胞糖脂代谢的影响及其机制研究[J]. 解放军医学杂志, 2012, 37 (6): 585–589. |
| [10] | Tank AW, Wong DL. Peripheral and Central Effects of Circulating Catecholamines[J]. Comprehensive Physiology, 2015, 5 (1): 1–15. |
| [11] | Grassi G. Sympathetic overdrive and cardiovascular risk in the metabolic syndrome[J]. Hypertension Research, 2006, 29 (11): 839–847. DOI:10.1291/hypres.29.839 |
| [12] | Feng XJ, Gao H, Gao S, et al. The orphan receptor NOR1 participates in isoprenaline-induced cardiac hypertrophy by regulating PARP-1[J]. British Journal of Pharmacology, 2015, 172 (11): 2852–2863. DOI:10.1111/bph.13091 |
| [13] | Zhu W, Woo AY, Zhang Y, et al. Beta-adrenergic receptor subtype signaling in the heart: from bench to the bedside[J]. Current topics in membranes, 2011, 67 : 191–204. DOI:10.1016/B978-0-12-384921-2.00009-4 |
| [14] | 张秋芳, 谭艳, 汪选斌, 等. RISK信号通路在β2-肾上腺素受体激动剂Clenbuterol减轻心肌细胞缺氧/复氧损伤中的作用[J]. 中国药理学通报, 2015, 31 (10): 1368–1374. DOI:10.3969/j.issn.1001-1978.2015.10.009 |
| [15] | 邢玲, 杨育红, 王洪新, 等. 腺苷A1受体激活在钙调磷酸酶信号通路上对异丙肾上腺素诱导的心肌细胞肥大的抑制作用[J]. 中国药理学通报, 2012, 28 (6): 847–852. |
| [16] | 赵素玲, 王洪新, 周振华, 等. 黄芪多糖对异丙肾上腺素诱导的乳大鼠心肌细胞肥大的保护作用[J]. 中国药理学通报, 2011, 27 (12): 1682–1686. DOI:10.3969/j.issn.1001-1978.2011.12.013 |
2. Institute of Traditional Chinese Medicine of Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China
 2017, Vol. 34
2017, Vol. 34