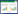文章信息
- 田吉, 李晋, 何俊, 关秀伟, 张纲, 李志刚, 常艳旭
- TIAN Ji, LI Jin, HE Jun, GUAN Xiu-wei, ZHANG Gang, LI Zhi-gang, CHANG Yan-xu
- 高效液相色谱法测定舒血宁注射液总黄酮醇苷的含量
- Determination of total flavonoid glycosides in Shuxuening injection by HPLC
- 天津中医药, 2017, 34(6): 415-418
- Tianjin Journal of Traditional Chinese Medicine, 2017, 34(6): 415-418
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.06.17
-
文章历史
- 收稿日期: 2017-02-05
2. 河北神威药业有限公司, 廊坊 065200;
3. 中药注射剂新药开发技术国家地方联合工程实验室, 廊坊 065200;
4. 河北省中药注射工程技术研究中心, 廊坊 065200
舒血宁注射液为银杏叶提取物经加工制成的灭菌水溶液[1-2], 主要包括黄酮类(24%)、萜内酯类(6%)化合物和微量元素等[3-5]。舒血宁注射液具有使动脉扩张, 增加血流量, 促进血液循环, 调节胆固醇, 改善脑功能障碍、高血压、老年痴呆、记忆力减退等功效[6~8], 主要用于治疗缺血性心脑血管疾病如冠心病、心绞痛、脑栓塞、脑血管痉挛等[9]。近年来, 由于中药成分复杂, 关于中药注射液不良反应报道增多, 安全性问题日益突出[10-12], 为了更好地控制舒血宁注射液的产品质量, 提高其安全性, 对舒血宁注射液中黄酮类和内酯类成分进行含量测定是十分必要的。
目前主要采用高效液相色谱-蒸发光散射检测散射检测器(HPLC-ELSD)法测定银杏制剂中萜内酯类化合物和高效液相色谱-紫外检测器(HPLC-UV)法测定黄酮类化合物含量[13-19]。由于部分黄酮类化合物标准品价格较高或市场不可获得而限制多种黄酮类成分定量分析方法的应用。以槲皮素、山奈酚和异鼠李素为指标, 通过按照美国药典规定的转换因子, 可实现银杏叶制剂中总黄酮含量的测定, 是中药银杏制剂一种较好的质量评价方法。但由于银杏叶提取物中本身含有槲皮素、山奈酚、异鼠李素3种苷元, 直接测定水解后3种该化合物含量按照传统算法会导致总黄酮醇苷含量测量偏高; 同时, 一些银杏制品中如果人为掺有上述3种苷元或色谱峰相似的其他成分, 也会导致测量结果偏高[20]。因此, 本研究拟以常见3种黄酮苷槲皮素、山奈酚、异鼠李素为指标, 水解舒血宁注射液黄酮醇苷成分, 通过水解前后3种黄酮含量差异, 建立舒血宁注射液总黄酮醇苷含量测定适宜的方法, 为舒血宁注射液的质量控制提供手段。
1 材料与试药 1.1 仪器Aglient1260高效液相色谱系统(Extend-C18色谱柱, UV检测器); 高速离心机(美国Sigma公司, 3K15);超纯水器(美国Millipore公司, Mill-QⅡ型); 涡旋混合器(上海沪西分析仪器厂, XW-80A); 超声波清洗器(昆山市超声仪器有限公司, KQ-250E); 十万分之一天平(瑞士Mettler Toledo公司, AX205);电热恒温水浴锅(上海博讯实业有限公司医疗设备厂, HHS型)。
1.2 试剂与药品槲皮素、山奈酚、异鼠李素标准品纯度均大于98%, 购自于成都德思特生物科技有限公司; 实验用水为Milli-Q超纯水(美国Millipore公司, Mill-QⅡ型); 甲酸为色谱纯(Tedia); 甲醇、乙醇、乙腈为色谱纯(天津市康科德科技有限公司); 其余试剂均为分析纯; 30批舒血宁注射液为河北神威药业股份有限公司提供。
1.3 色谱条件色谱柱为Extend-C18柱(4.6 mm×250 mm, 5 μm); 流动相:0.1%甲酸水(A)和乙腈(B); 梯度洗脱; 梯度程序:0~10 min, 10%→25%B; 10~25 min, 25%→28%B; 25~34 min, 28%→40%B; 34~35 min, 40%B→10%B; 流速为1 mL/min; 进样体积为15 μL; 柱温为35 ℃, 紫外检测波长为360 nm。
1.4对照品溶液精密称取槲皮素、山奈酚和异鼠李素对照品5 mg, 加甲醇配成浓度分别为1 mg/mL的单一对照品母液, 再加甲醇分别稀释成不同浓度储备液, 置4 ℃冰箱中保存备用。
1.5供试品溶液取舒血宁注射液, 精密量取4 mL, 置于100 mL圆底烧瓶中, 加入37%盐酸-水-乙醇(4:10:25) 78 mL, 90 ℃加热回流水解2.5 h, 冷却至室温, 转移至100 mL容量瓶中, 加水至刻度线, 摇匀。将水解后溶液以14 000 r/min的速度离心10 min, 取上清液, 进样分析。
2 方法与结果 2.1 方法学验证 2.1.1 线性关系、线性范围、检测限(LOD)和定量限(LOQ)将上述槲皮素、山奈酚、异鼠李素配制成母液分别为250、250、100 μg/mL的混合溶液, 将母液以2.5倍逐级稀释成8个点, 按照上述确定的色谱条件进样15 μL, 记录峰面积。以进样浓度X (μg/mL)为横坐标、峰面积Y为纵坐标, 绘制标准曲线。将混合对照品逐级稀释, 分别以信噪比S/N=3和S/N=10时各对照品的浓度作为LOD和LOQ。线性关系结果如表 1所示。
精密取同一批水解后舒血宁注射液样品, 按上述色谱条件进样15 μL, 连续进样6次, 记录色谱峰的峰面积, 相对标准偏差(RSD)值在0.29%~0.70%, 均小于5%, 符合精密度实验要求, 说明该方法精密度良好。
2.1.3 重复性实验精密取同一批舒血宁注射液样品6份, 按上述方法制备供试品溶液, 按色谱条件进样15 μL, 连续进样6次, 记录色谱峰的峰面积, RSD值在0.18%~0.35%范围内, 均小于5%, 符合重复性实验要求, 说明该方法重复性良好。
2.1.4 稳定性实验取同一批供试品溶液, 分别在0、2、4、8、12、24 h按照色谱条件进行色谱分析。记录峰面积, 计算RSD值, 在0.28%~0.49%, 结果符合稳定性实验要求, 说明该方法稳定性良好。
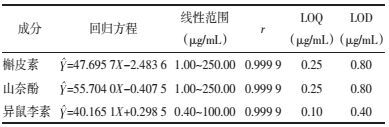
2.1.5 加样回收率精密量取适量的槲皮素、山奈酚、异鼠李素对照品溶液, 配制成浓度分别为3、3、2 μg/mL的混合对照品溶液, 取0.5 mL混合对照品溶液加入已知含量的0.5 mL水解舒血宁注射液中, 配制供试品溶液。结果显示槲皮素、山奈酚、异鼠李素的回收率在98.8%~100%范围内, RSD值在0.070%~0.039%范围内, 表明该方法回收率良好。结果见表 2。
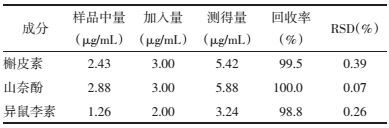
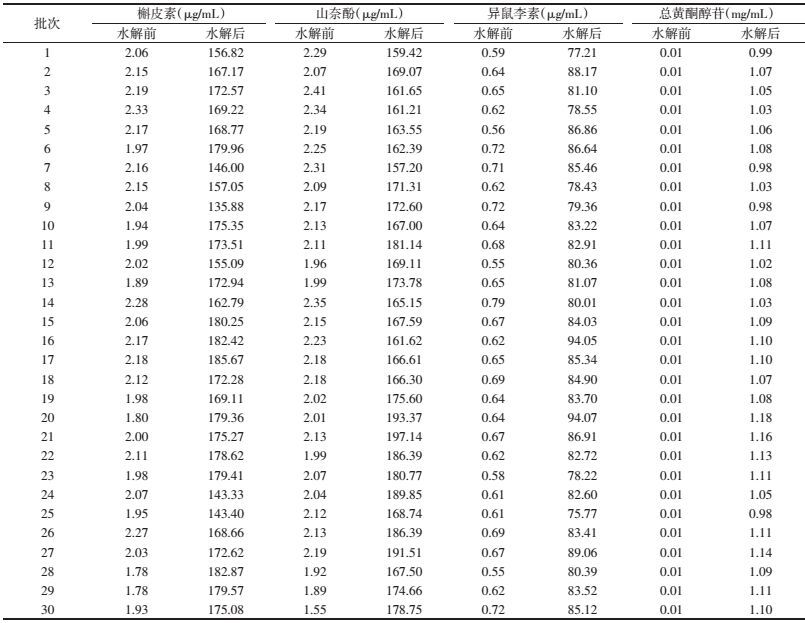
取30批注射液, 按照上述方法制备供试品溶液, 按色谱条件进行测定, 记录色谱峰面积。将样品中3个待测成分的色谱峰面积代入相对应的回归方程中, 分别计算舒血宁注射液水解前后黄酮苷元的含量, 每批样品测定3份。按美国药典槲皮素、山奈酚和异鼠李素的转换因子分别为:2.504、2.580和2.437。按下面公式:总黄酮醇苷的含量=槲皮素含量×2.504+山奈酚含量×2.580+异鼠李素含量×2.437计算总黄酮苷含量, 其中槲皮素、山奈酚及异鼠李素含量均为水解后含量减去水解前含量。色谱图如图 1所示, 样品测定结果如表 3所示。
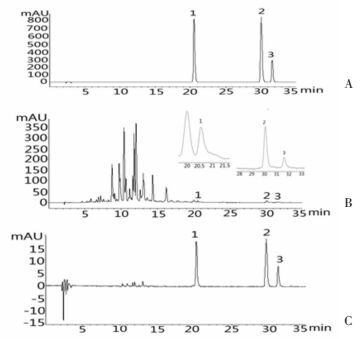
|
| 图 1 典型色谱图 Fig. 1 Typical chromatogram A:3种黄酮苷元混合标准品; B:舒血宁注射液水解前; C:舒血宁注射液水解后; 1:槲皮素; 2:山奈酚; 3:异鼠李素 |
本研究在对舒血宁注射液进行水解时, 通过含量测定考察了不同水解时间的水解效果, 最终确定最佳水解时间为2.5 h。在对舒血宁注射液水解后样品进行含量测定的过程中, 供试品溶液需现用现配, 需在12 h内测定完全, 避免槲皮素不稳定而测定结果不准确。笔者在先前研究的基础上, 对总黄酮醇苷含量的计算方法稍作改进, 即通过查阅美国药典, 以槲皮素、山奈酚和异鼠李素为指标, 通过相对的转换因子, 分别计算舒血宁注射液水解前后的总黄酮醇苷含量, 避免了由于自身含有3种苷元而造成测量结果偏高, 使结果更加准确可靠。
本研究利用所建的HPLC法测定了30批舒血宁注射液中总黄酮醇苷含量, 发现30批舒血宁注射液总黄酮醇苷含量在0.97~1.17 mg/mL范围内。由实验结果可知, 该方法色谱分离较好, 线性关系良好, 且精密度、稳定性、重复率及回收率RSD值均小于5%, 说明该方法准确可靠, 可用于舒血宁注射液总黄酮苷的含量测定, 为其提供了有力的技术支撑。
4 结论本研究分别以槲皮素、山奈酚和异鼠李素为指标, 通过对应的转换因子, 建立了同时测定样品水解后的总黄酮苷含量HPLC法。该方法操作简便, 准确快速, 可用于舒血宁注射液中总黄酮苷类化合物的质量控制。
| [1] | 王京辉, 陈有根, 赵一懿, 等. 舒血宁注射液中6种黄酮醇苷的快速液相色谱测定[J]. 药物分析杂志, 2010, 30 (8): 1574–1577. |
| [2] | 高曦明. 舒血宁注射液临床应用近况[J]. 现代医药卫生, 2006, 22 (7): 997–999. |
| [3] | 佘佳红, 袁伯俊, 柳正良. 银杏叶活性成分的提取制备及测定方法的研究进展[J]. 中国新药杂志, 2000, 9 (4): 221–224. |
| [4] | 孙芳, 王璐, 闫滨, 等. 银杏叶提取物活性成分及其药理作用[J]. 山东中医杂志, 2014, 34 (3): 221–223. |
| [5] | 刘花, 高卉. 银杏叶提取物药理作用的研究进展[J]. 湖北科技学报(医学版), 2015, 36 (3): 259–262. |
| [6] | 郭迎新, 潘卫三, 李非, 等. 不同检测方法在银杏叶缓释制剂处方设计中的比较研究[J]. 天津中医药大学学报, 2013, 32 (3): 157–160. DOI:10.11656/j.issn.1673-9043.2013.03.10 |
| [7] | 宋伟峰, 李瑞明. HPLC测定银杏叶茶中总黄酮的含量[J]. 中国中医药现代远程教育, 2011, 9 (2): 213–214. |
| [8] | 王强, 姜希娟, 范英昌, 等. 银杏叶提取物EGB761对高胆固醇血症家兔血脑屏障通透性的影响[J]. 天津中医药大学学报, 2010, 29 (1): 30–32. DOI:10.11656/j.issn.1673-9043.2010.01.11 |
| [9] | 杨薇, 李霖, 谢雁鸣, 等. 舒血宁注射液临床用药剂量对肝功能影响的临床实效研究[J]. 中国中药杂志, 2013, 38 (18): 174–181. |
| [10] | 黄玮. 舒血宁注射液致不良反应的文献分析与评价[J]. 中国医院用药评价与分析, 2015, 15 (3): 407–409. |
| [11] | 纪立伟, 李晓翠, 李可欣. 26例舒血宁注射液不良反应报告分析[J]. 中国药物应用与监测, 2011, 8 (4): 228–230. |
| [12] | 杨德平. 154例舒血宁注射液的严重不良反应分析[J]. 中国药物警戒, 2010, 7 (10): 620–622. DOI:10.3969/j.issn.1672-8629.2010.10.015 |
| [13] | 刘晓谦, 王跃生, 罗晓健, 等. HPLC-ELSD法测定不同厂家银杏叶提取物中4种银杏内酯的含量研究[J]. 江西中医药大学学报, 2008, 20 (1): 89–90. |
| [14] | 张亚中, 周亚球, 王娟, 等. HPLC-ELSD法测定银杏叶软胶囊中萜类内酯的含量[J]. 中成药, 2005, 27 (1): 22–24. |
| [15] | 颜玉贞, 谢培山. HPLC-ELSD法测定银杏叶中的4种萜类内酯含量[J]. 药物分析杂志, 2001, 21 (3): 173–176. |
| [16] | 刘利群, 刘天扬, 金涛, 等. HPLC-ELSD法测定银杏叶口腔崩解片中的银杏内酯含量[J]. 中国药师, 2006, 9 (6): 529–531. |
| [17] | 姜国芳, 谢宗波, 乐长高. 银杏叶黄酮类化合物的研究进展[J]. 时珍国医国药, 2004, 15 (5): 306–308. |
| [18] | 欧琴, 张芦燕, 钱一鑫, 等. HPLC法测定舒血宁注射剂黄酮和内酯的含量[J]. 贵州大学学报(自然版), 2010, 27 (5): 34–37. |
| [19] | 刘近荣. HPLC法测定注射用舒血宁中总黄酮醇苷的含量[J]. 中国药房, 2007, 18 (12): 932–934. DOI:10.3969/j.issn.1001-0408.2007.12.023 |
| [20] | Wohlmuth H, Savage K, Dowell A, et al. Adulteration of Ginkgo biloba products and a simple method to improve its detection[J]. Phytomedicine, 2014, 21 (6): 912–918. DOI:10.1016/j.phymed.2014.01.010 |
2. Hebei Shineway Pharmaceutical Co. Ltd., Langfang 065200, China;
3. State-Local Joint Engineering Laboratory of New Drugs Department Technology for Traditional Chinese Medicine Injection, Langfang 065200, China;
4. Hebei Province Engineering Research Center for Traditional Chinese Medicine Injection, Langfang 065200, China
 2017, Vol. 34
2017, Vol. 34