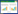文章信息
- 李小江, 易丹, 贾英杰
- LI Xiao-jiang, YI Dan, JIA Ying-jie
- 癌热宁栓剂直肠给药相关解热机制探索
- Exploring the antipyretic mechanism of Airening suppository by rectal drug administration
- 天津中医药, 2017, 34(7): 466-470
- Tianjin Journal of Traditional Chinese Medicine, 2017, 34(7): 466-470
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.07.11
-
文章历史
- 收稿日期: 2017-03-30
癌性发热,又称为“癌热”、“肿瘤热”,是指肿瘤患者在排除感染、抗生素治疗无效的情况下出现的直接与肿瘤有关的非感染性发热,以及患者在肿瘤发展过程中因治疗而引起的发热[1]。癌性发热是中晚期肿瘤患者的常见症状之一,有报道约2/3恶性肿瘤患者病程中伴有发热,而其中癌性发热占40%[2],严重影响患者的生活质量和生存期,其机制尚不十分清楚,目前尚缺乏有效的治疗手段,寻找持久、稳定、安全的解决癌性发热的方法成为目前研究的热点。癌热宁栓剂是根据中医理论,经科学研制而成的中药复方制剂。具有清热解毒、祛瘀凉血的功效。临床主要用于癌性发热或非感染性发热。为进一步研究该药物的解热作用及机制,通过以下体内实验研究可进一步为临床用药提供更有力的证据支持。
1 实验材料 1.1 实验动物长耳大白兔24只,雌雄各半,体质量(2.5±0.5) kg,由天津中医药大学实验动物中心提供。
1.2 实验主要药品及试剂癌热宁栓剂,由银柴胡、地骨皮、虎杖、青蒿、白花蛇舌草、土贝母等药物组成,栓剂由天津中医药大学中医药研究院制备,3 g/粒。中药浸膏,水煮醇沉法,用于动物直肠给药,每毫升含生药1.5 g。消炎痛栓,每粒100 mg,批号:H11021391,北京双吉制药有限公司。2,4-二硝基酚,每瓶25 g,批号:1601192,由上海市景颜化工科技有限公司提供。兔抗人NF-κB p65多克隆抗体、生物素化第二抗、山羊血清、苏木素染色液、SABC试剂盒、HRP-DAB底物显色试剂盒、白介素-6(IL-6) 酶联免疫反应(ELISA)分析试剂盒、前列腺素E2(PGE2)ELISA分析试剂盒、环氧化酶(COX-2) ELISA分析试剂盒、精氨酸加压素(AVP)ELISA分析试剂盒、α-黑色素细胞刺激素(α-MSH)ELISA分析试剂盒:由天津优瑞尔生物技术有限公司提供。无水乙醇、4%多聚甲醛、二甲苯、70%乙醇、生理盐水、80%乙醇、蒸馏水、95%乙醇、3%双氧水、100%乙醇、磷酸盐缓冲液(PBS),由天津易生源生物技术有限公司提供。
1.3 实验设备电子秤,手术剪,眼科剪,石蜡切片机,石蜡包埋机,光学显微镜,分析天平,烘片机,恒温烤箱,高压锅,电磁炉,微量加样枪,湿盒,载玻片,盖玻片:天津中医药大学实验室提供。MGA-Ⅲ219型电子测温仪:北京师范大学司南仪器厂。3550型酶联免疫检测仪:美国BIO-RAD产品。SG-800型低速台式离心机:上海摩速科学器材有限公司。石蜡切片机:德国莱卡RM2015。深冻冰箱(-70 ℃):日本三洋MDF-382E型。恒温水浴箱(HH-W420型):江苏太仓医用仪器厂。倒置相差显微镜(LH50A型):日本Olympus。多功能真彩色细胞图象分析管理系统:美国Media Cybernetics公司。
2 实验方法 2.1 实验前家兔处理实验室温度保持在(21±1) ℃,湿度保持在(50±5)%。以紫外线灯照射消毒。实验前3天每日分早、中、晚测家兔体温3次,使其适应体温测量的刺激,测体温时以MGA-Ⅲ219型电子测温仪探头插入家兔肛门内4~5 cm处,记录直肠温度,取得平均值作为基础体温。家兔于实验前14 h禁食备用,可自由饮水。
2.2 药物制备与致热量的确定根据前期实验研究,经预实验后将2,4-二硝基酚致热量确定为30 mg/kg,电子秤准确称量2 g 2,4-二硝基酚,加入无水乙醇100 mL,配置成浓度为20 mg/mL的亮黄色透明2,4-二硝基酚乙醇溶液,2~5 ℃保存,待用。
2.3 造模与分组利用2,4-二硝基酚刺激家兔出现无菌性炎症,模拟临床癌性发热模型[3]。实验第1~3天测得24只家兔基础肛温在38~39.6 ℃,体温波动在0.5 ℃以内,且每只家兔生长状况良好,符合实验要求,全部纳入实验。第4天开展实验,随机取6只设为空白对照组,背部皮下注射生理盐水1.5 mL/kg,剩余18只家兔用2,4-二硝基酚乙醇溶液背部皮下注射1.5 mL/kg进行造模,造模后筛选出2 h内体温升高超过1 ℃的家兔17只,按照随机数字表法随机分为模型组5只,癌热宁栓组6只,消炎痛栓组6只。
2.4 给药方法造模后3 h给药,癌热宁栓组直肠给药癌热宁栓1粒/只,消炎痛栓组直肠给药消炎痛栓1粒/只。
2.5 观察指标 2.5.1 家兔一般生活状态实验过程中观察不同组别家兔的精神状态、皮毛色泽、活动等有无变化。
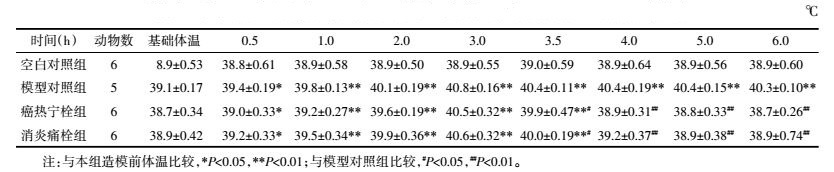
2.5.2 对体温的影响观察造模后0.5、1.0、2.0、3.0、3.5、4.0、5.0、6.0 h各组动物直肠温度变化。
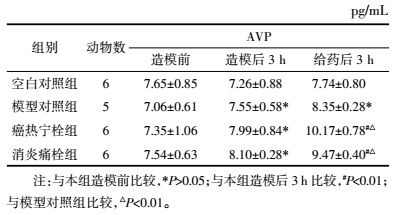
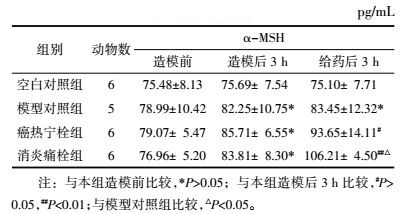
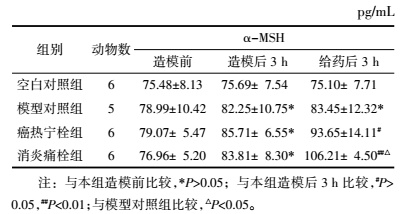
2.5.3 对外周血IL-6、COX-2、PGE2、AVP、α-MSH含量的影响各组家兔于造模前、造模后3 h及给药后3 h从耳缘静脉采血约2 mL,用高速离心机将采取的血液离心10 min,取上清液血清,-70 ℃保存待测。检测采用酶联免疫吸附法,按试剂盒说明书操作,分别检测血清中IL-6、COX-2、PGE2、AVP、α-MSH的含量。
2.5.4 对肝脏NF-κB表达的影响 2.5.4.1 免疫组化方法具体步骤家兔处死后,快速剪切肝脏中叶靠近中间部分的1/3,大小约1×1×0.3 cm(厚度不超过0.5 cm)。对标本进行固定和包埋、切片、脱蜡、水化、抗原热修复、加入一抗、二抗、DAB显色和复染,最后在显微镜下观察切片,并进行×100和×400显微照相。
2.5.4.2 结果判定NF-κB阳性表达为细胞核深染、细胞质出现棕色或棕黄色颗粒,细胞核未见染色、细胞质内无或少量棕色或棕黄色颗粒为阳性染色。根据阳性细胞率和阳性细胞着色强度分别记分。
评分标准:A为阳性细胞数所占比分级0~1%=0、1~10%=1、11~50%=2、51~75%=3、76~100%=4,0分为阴性,1分为阳性细胞数≦10%,2分为11%~50%,3分为51%~75%,4分为>75%。B为阳性细胞显色强度分级0(阴性,无色)、1(弱阳性,淡黄色)、2(阳性,棕黄色)、3(强阳性,棕色,棕褐色),IHS=A×B>4为有统计学意义。使用SPSS 19.0统计软件数据包处理,本实验数据类型为单因素多组,各组间实验数据用均数±标准差(x±s)表示,组间的均数比较用方差分析,实验数据标准取α=0.05,若P < 0.05,则代表组间差异显著。
3 统计学方法使用SPSS 18.0统计软件数据包处理,各组实验数据用均数±标准差(x±s)表示,单因素设计资料组间比较采用单因素方差分析,重复测量资料的组间比较用重复测量方差分析,P < 0.05为差异有统计学意义。
4 结果与分析 4.1 家兔一般生活状态空白对照组家兔活动正常,无发热、耸毛、抖动等表现。模型对照组、癌热宁栓组、消炎痛栓组家兔在注射2,4-二硝基酚30 min后体温开始上升,并出现耸毛、抖动、蜷缩等症状;约至3 h后,随着体温的明显升高,家兔耸毛、抖动、蜷缩等症状逐渐消失,但呼吸变明显急促,伴心跳加快。触其皮毛亦可扪及灼热,由于全身发热,家兔还表现出耳廓发红发热,部分扩张的血管周围可见出血点,眼结膜充血,个别家兔有稀便情况,但神志清醒。用癌热宁栓剂、消炎痛栓剂治疗约1 h后其症状与体征开始逐渐减轻。
4.2 体温经时变化值如表 1所示,皮下注射2,4-二硝基酚后,模型家兔体温开始升高,0.5 h即出现发热,1 h后与空白对照组比较,模型动物体温明显升高,约3 h体温达峰值,发热呈单峰热。给药0.5 h后,癌热宁栓组与消炎痛栓组家兔体温较模型对照组体温开始下降(P < 0.05),给药1 h后,癌热宁栓组与消炎痛栓组家兔体温较模型对照组体温明显降低(P < 0.01),与空白对照组比较无统计学差异(P>0.05)。说明癌热宁栓与消炎痛栓具有退热作用,能完全对抗2,4-二硝基酚引起的发热效应。
 |
如表 2所示,造模后3 h各组造模家兔血清IL-6含量明显升高(P < 0.05)。给药后3 h,模型对照组家兔血清IL-6含量进一步升高,癌热宁栓组较模型对照组家兔血清IL-6含量显著下降(P < 0.05),说明癌热宁栓对模型家兔血清IL-6升高效应具有抑制作用。
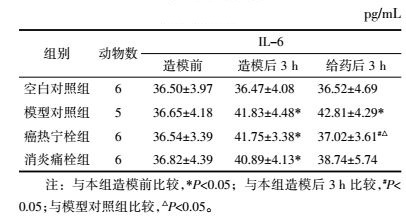
如表 3所示,造模后3 h各组造模家兔血清COX-2含量明显升高(P < 0.05)。给药后3 h,癌热宁栓组与消炎痛栓组较模型对照组家兔血清COX-2含量显著下降(P < 0.01),说明癌热宁栓与消炎痛栓对模型家兔血清COX-2升高效应具有抑制作用。
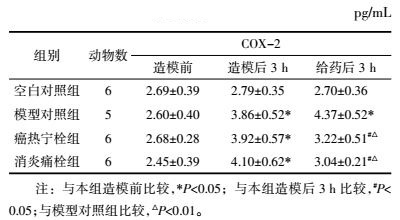
如表 4所示,造模后3 h各组造模家兔血清PGE2含量明显升高(P < 0.05)。给药后3 h,癌热宁栓组与消炎痛栓组较模型对照组家兔血清PGE2含量显著下降(P < 0.01),癌热宁栓组与消炎痛检组无统计学意义(P>0.05),表明癌热宁栓与消炎痛栓对模型家兔血清PGE2升高效应具有抑制作用。
如表 5所示,给药后3 h,癌热宁栓组与消炎痛栓组较模型对照组家兔血清AVP含量显著上升(P < 0.01),癌热宁栓组与消炎痛栓组无统计学意义(P>0.05),说明癌热宁栓与消炎痛栓均能促进解热因子AVP的含量上升。
如表 6所示,给药后3 h,癌热宁栓组家兔血清α-MSH含量稍增,差异无统计意义(P>0.05),而消炎痛栓组较组内造模后3 h血清α-MSH含量显著上升(P < 0.01),较模型对照组亦明显升高(P < 0.01),说明消炎痛栓能促进解热因子α-MSH含量上升,发挥退热作用。
如图 1及表 7所示,空白对照组(图 1A)家兔肝脏NF-κB的表达呈弱阳性,阳性细胞数较少。模型对照组(图 1B)较空白对照组NF-κB的表达呈胞核强阳性(3分)、胞质阳性(2分),差异有统计学意义(P < 0.05)。癌热宁栓组(图 1C)和消炎痛栓组(图 1D)NF-κB的表达明显低于造模对照组(P < 0.05)。提示癌热宁栓与消炎痛栓对2,4-二硝基酚引起的家兔肝脏NF-κB的表达增多有明显抑制作用。
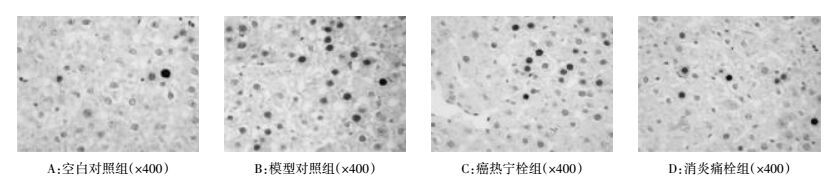
|
| 图 1 各组家兔肝脏NF-κB的表达 Fig. 1 Expression of NF-κB in liver of rabbits of each group |
尽管目前癌性发热的机制尚不十分清楚,但多数学者认为可能与肿瘤细胞本身产生内源性致热源有关。NF-κB是一种分布广泛的转录因子,普遍存在于真核细胞中,许多基因的启动子中都有功能性NF-κB的结合位点,在细胞因子诱导的基因表达中起关键性的调控作用[4]。研究显示[5-6],NF-κB调控的炎性途径有助于调节大脑控制的病症如发热,包括感染与非感染性发热。NF-κB调控的靶基因包括细胞因子(TNF-ɑ、IL-1β、IL-6等)、黏附分子(ICAM-1、VCAM-1等)、酶[COX-2、PLA2、诱导型一氧化氮合酶(iNOS)等]、化学趋化因子(IL-8)、免疫受体、生长因子[粒细胞集落刺激因子(G-CSF)、巨噬细胞集落刺激因子(GM-CSF)]、急性期蛋白(C反应蛋白)等[7-9]。本实验结果发现,家兔造模后体温升高的同时,伴有血清IL-6、COX-2、PGE2的明显升高,及AVP、α-MSH含量的轻度升高。经癌热宁栓给药后,约0.5 h家兔体温下降即有统计学意义,随着时间推移,家兔体温也随之下降达正常水平,疗效与消炎痛栓相当,进一步肯定了癌热宁栓的退热效果。癌热宁栓发挥退热疗效的同时,发热家兔血清中IL-6、COX-2、PGE2的含量也明显下降。结合本实验结果推导,癌热宁栓退热效果快,可能与抑制COX-2的活性从而抑制PGE2的合成有关。并且癌热宁栓还能明显抑制IL-6的升高效应,而优于消炎痛栓,与该方中药如地骨皮、虎杖、白花蛇舌草等现代药理学研究结果相一致。此外,癌热宁栓还能明显提高发热家兔血清解热因子AVP的含量,对解热因子α-MSH的含量也有一定的促进作用,体现了中医药多靶点作用的特色。因此推导,癌热宁栓发挥疗效的机制可能与调控NF-κB通路有关。
癌性发热多出现在恶性肿瘤中晚期,由于放疗、化疗等积极的抗肿瘤治疗后,多数患者会出现不同程度的食欲不振,口服给药困难,对于这类患者,中药直肠给药方式简便廉验,栓剂给药有以下优点[10]:可避免与胃、肠等消化道相互作用而使药物失活或药物刺激胃肠;中药经直肠吸收后,可避免受到肝脏的“首过效应”;中药大多苦涩,直肠给药更能耐受,同时也解决了中晚期肿瘤患者口服给药的困难。本实验充分利用栓剂作用优势,尝试改良汤型为栓剂,亦体现中医药外治特色。
癌热宁方疗效确切,作用迅速、持久、稳定,且无明显毒副作用,既能治疗发热之标,且能针对癌瘤之本而治,对控制患者病情,延缓进展,提高生存质量方面具有很大的优势。同时剂型的改良拓宽了给药的途径,亦是发挥了中医药外治法的特色。
| [1] | 段建华, 王园园. 癌性发热的中医药治疗进展[J]. 黑龙江中医药, 2014, 13 (1): 69–69. |
| [2] | 陆宁, 郭勇, 阮善明. 癌性发热中西医结合治疗模式探讨[J]. 实用中西医结合临床, 2008, 8 (1): 66–67. |
| [3] | 陈孟溪, 廖敏, 宋琳, 等. 清热散瘀解毒方对发热大鼠血清TNF-α、IL-1β、COX-2含量的影响[J]. 中国中医急症, 2013, 22 (7): 1108–1110. |
| [4] | 李勇, 张培建, 金成. NF-κB与肝脏缺血再灌注损伤的研究进展[J]. 普通外科进展, 2008, 11 (1): 48–50. |
| [5] | Rummel C. Inflammatory transcription factors as activation markers and functional readouts in immune-to-brain communication[J]. Brain Behay Immun, 2016, 54 (3): 1–14. |
| [6] | Simmons LJ, Surles-Zeiqler MC, Li Y, et al. Regulation of inflammatory responses by neuregulin-1 in brain ischemia and microglial cells in vitro involver the NF-kappa B pathway[J]. J Neuroinflammation, 2016, 13 (1): 237. DOI:10.1186/s12974-016-0703-7 |
| [7] | Shembade N, Pujari R, Harhaj NS, et al. The kinse IKKɑ inhibits activation of the transcription factor NF-κB by phosphorylating the regulatory molecule TAX1BP1[J]. Natlmmunol, 2011, 12 (9): 834–843. |
| [8] | Lee HJ, Oh TH, Yoon WJ, et al. Eutigoside C inhibits the production of inflammatory mediators (NO, PGE2, IL-6) by down-regulating NF-κB and MAP kinase activity in LPS-stimulated RAW 264.7 cells[J]. J Pharm Pharmacol, 2008, 60 (7): 917–924. DOI:10.1211/jpp.60.7.0014 |
| [9] | Brown KD, Clandio E, Siebenlist U. The roles of the clssical and alternative nuclear factor-κB pathways:potential implications for autoimmunity and rheumatoid arthritis[J]. Arthritis Res Ther, 2008, 10 (4): 212–225. DOI:10.1186/ar2457 |
| [10] | 张恒, 普俊学, 王乙鸿, 等. 中药栓剂的临床应用及其新剂型[J]. 安徽医药, 2015, 19 (10): 1841–1844. DOI:10.3969/j.issn.1009-6469.2015.10.002 |
 2017, Vol. 34
2017, Vol. 34