文章信息
- 焦毅, 张雪竹
- JIAO Yi, ZHANG Xue-zhu
- 舒肝明目汤含药血清调节HIF1α-VEGF-Notch1通路活性影响脉络膜血管新生作用的研究
- Effect of medicated serum prepared with Shugan Mingmu decoction on choroidal neovascularization by HIF1α-VEGF-Notch1 pathway
- 天津中医药, 2017, 34(7): 471-474
- Tianjin Journal of Traditional Chinese Medicine, 2017, 34(7): 471-474
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.07.12
-
文章历史
- 收稿日期: 2017-02-26
年龄相关性黄斑变性(AMD)是导致老年人视力损害的主要疾病,表现为慢性进行性视力下降。脉络膜新生血管(CNV)形成及伴随的出血、增生等病理改变则是AMD的病理基础和重要原因[1]。而脉络膜血管内皮细胞(CECs)缺氧是促使CNV血管生成的原因之一,在缺血缺氧等损伤性因素的刺激下,内皮细胞功能受损,导致各种血管生成因子分泌失衡,从而引发CNV[2-3]。
缺氧诱导因子1(HIF1) 是转录调节因子,能够诱导和血管发生、红细胞生成、糖代谢有关的多种基因表达,参与调节细胞对缺氧的反应[4]。血管内皮生长因子(VEGF)是HIF1的下游靶因子,低氧时VEGF表达增高,促进新的血管系统形成以增加氧供,由此启动CNV形成。但单纯高表达VEGF不足以诱发CNV,尚需其它血管生成因子的启动及协同配合[5]。近年研究发现,Notch信号在血管生成中扮演重要角色,在内皮细胞增殖、迁移、血管分化和血管形成等过程中发挥重要作用[6]。鉴于VEGF和Notch1均与缺氧后血管发生有关,提示二者间存在某些联系,但目前尚缺少相关证据。
笔者在临床应用舒肝明目汤治疗老年AMD取得良好疗效。文章拟将VEGF和Notch1联系起来,探讨舒肝明目汤含药血清影响CNV形成的作用机制。
1 材料与方法 1.1 试剂和仪器大鼠CECs购自美国ATCC公司;Ham F12培养基、胎牛血清、内皮细胞生长因子(ECGF)、0.25%胰酶、青链霉素双抗均为美国Gibco公司产品;胰酶、四甲基偶氮唑蓝(MTT)、二甲基亚砜、肝素、胰岛素为美国Sigma公司产品。CCK-8试剂盒购自日本同仁化学研究所;细胞裂解液、RNA提取试剂盒、逆转录试剂盒、UltraSYBR Mixture、RIPA细胞裂解液、电泳缓冲液、转膜缓冲液、高灵敏度化学发光检测试剂盒等购自北京康为世纪公司;低氧诱导因子1α(HIF1α)、VEGFA和Notch1抗体购自Abcam公司。所用仪器为酶标仪(ELX800,美国Bio-Tek公司)、倒置显微镜(IX71,日本Olympus公司)、7500型Real-time PCR仪(美国ABI公司)、ChemiDoc XRS凝胶成像仪(美国Biorad公司)。
1.2 含药血清制备 1.2.1 疏肝明目汤提取浓缩液制备取10倍量的处方(柴胡、当归、白芍、白术、桑寄生各10 g,茯苓20 g,桑葚30 g,草决明和何首乌藤各15 g),水煎2次,合并滤液,滤液浓缩至含生药量为1.73 g/mL,保存备用。
1.2.2 含药血清的制备取30只健康Wistar大鼠,雌雄各半,体质量(220±10) g,等分为空白组和给药组。灌胃给药,每日1次,连续7 d。给药组给予疏肝明目汤提取液(每天1 mL/100 g体质量,相当于成人日剂量的10倍);空白组给予等量的生理盐水。末次给药后1 h,将动物用乙醚麻醉,腹主动脉取血,分离血清,0.22 μm微孔滤膜过滤除菌,-80 ℃保存备用。
1.3 大鼠CECs培养将大鼠CECs复苏,用含20%胎牛血清、100 mg/L ECGF、100 mg/L肝素、0.3 IU/mL胰岛素、1 g/L青链霉素双抗的Ham F12完全培养基接种于2 g/L明胶包被的培养瓶,置常氧条件下(37 ℃、5%CO2)培养。达80%融合时,以0.25%胰酶消化,收集细胞再以1:2的比例进行传代。取第3~6代细胞用于实验。
1.4 最佳含药血清浓度的确定将细胞接种于96孔板,接种量200 μL,接种密度1×105个/mL,常氧条件下培养至对数生长期后,更换含5%、10%、15%(体积分数)空白血清或含药血清的培养基(维持20%总血清浓度不变)继续培养24 h,每孔加入20 μL MTT溶液使其终浓度为5 g/L,继续培养4 h。弃去孔内培养液,每孔加入150 μL二甲亚砜,37 ℃孵育10 min,490 nm测定吸光度。每孔设3个复孔,取均值分析。
1.5 细胞培养细胞在常氧条件下贴壁培养至对数生长期后,更换无血清培养基继续培养4 h使细胞同步。后±据处理方式的不同分为3组,对照组更换含最佳浓度空白血清的培养基后继续在常氧条件下培养,而低氧组和给药组分别更换含最佳浓度空白血清和含药血清的培养基后转至37 ℃低氧培养箱(含1% O2、5% CO2和94% N2),均继续培养24 h后进行以下实验。
1.6 含药血清对CECs的增殖及迁移能力的影响CCK-8法测定细胞的增殖能力:取3组细胞,每孔加入10 μL CCK-8,继续培养4 h,450 nm检测吸光度。每孔设3个复孔,取均值分析。细胞增殖率=各组A450/正常组A450
划痕法测定细胞的迁移能力:将3组细胞培养至融合,用无菌的200 μL吸头划痕,磷酸盐缓冲液(PBS)冲洗划下的细胞,加入原培养基继续培养24 h后,镜下观察细胞的迁移距离。
1.7 含药血清对HIF1α、VEGF和Notch1 mRNA及蛋白表达的影响收集3组细胞,Trizol法抽提总RNA,取2 μL总RNA逆转录为cDNA。将cDNA±UltraSYBR Mixture试剂盒说明书进行PCR扩增。反应条件:95 ℃预变性10 min;变性95 ℃ 5 s;退火、延伸60 ℃ 34 s;重复40个循环,70~95 ℃绘制融解曲线。反应体系为25 μL。HIF1α的正反向引物序列为5’-CGTTCCTTCGATCAGTTGTC-3’和5’-TCAGT-GGTGGCAGTGGTAGT-3’;VEGF正反向引物序列为5’-GCCCTGAGTCAAGAGGACAG-3’和5’-CAGGCTCCTGATTCTTCCAG-3’;Notch1正反向引物序列为5’-GTTTGTGCAAGGATGGTGTG-3’和5’-CCTTGAGGCATAAGCAGAGG-3’。实验以β-actin为内参,其正反向引物序列为5’-TGTTACCA-GGGAGGAGCAGT-3’和5’-TGCCCTTCCTTTCCT-GTGT-3’。引物由苏州金唯智公司合成。所有实验重复3次,2-ΔΔCt法计算mRNA相对表达量。
收集3组细胞,RIPA裂解液提取总蛋白,取100 μg总蛋白行10% SDS-PAGE电泳,将蛋白转印到0.45 μm PVDF膜上,5%脱脂奶封闭1 h后,分别与HIF1α(1:500)、VEGFA(1:1 000) 和Notch1(1:500) 一抗4 ℃孵育过夜。后常规进行二抗杂交、洗膜、ECL显影。实验以β-actin(1:500) 为内参,计算蛋白的相对表达量。所有实验重复3次。
1.8 统计分析采用SPSS 18.0软件进行统计,计量资料以均数±标准差(x±s)表示。组间比较采用单因素方差分析,组间两两比较采用LSD法。P < 0.05为差异有统计学意义。
2 结果 2.1 最佳含药血清浓度的确定空白组细胞活力随空白血清浓度增加而轻微增加,但给药组细胞活力在含药血清浓度为10%的时候最高,且明显高于15%的浓度。因此选择10%含药血清为最佳浓度,并进行其后实验。
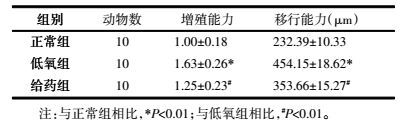
2.2 含药血清对CECs增殖、移行的影响低氧组CECs增殖和移动能力较正常组显著增高,差异具有统计学意义(P < 0.01);经含药血清处理后,CECs增殖和移行能力较低氧组明显下降(P < 0.01)。见表 1。
 |
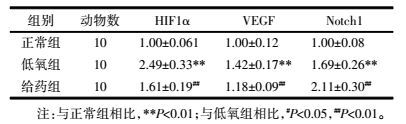
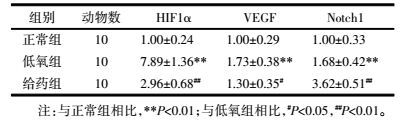
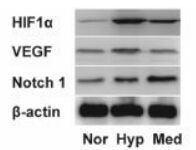
常氧培养时HIF1α和VEGF的mRNA和蛋白表达均处于较低水平;低氧处理明显增加二者表达,与常氧培养相比具有显著性差异(P < 0.01)。而经含药血清处理后,CECs中HIF1α和VEGF的mRNA和蛋白表达水平明显降低,与低氧组差异明显(P < 0.01,P < 0.05)。低氧组Notch1 mRNA及蛋白表达较正常组明显升高(P < 0.01),经含药血清处理后,CECs表达Notch1进一步升高,与低氧组差异显著(P < 0.01)。见表 2、表 3,图 1。
 |
 |
|
| 图 1 含药血清对HIF1α、VEGF、Notch1蛋白表达的影响 Fig. 1 Effect of medicated serum on the protein expression levels of HIF1α, VEGF and Notch1 |
CNV是脉络膜毛细血管的增殖血管,常见于黄斑区,是许多眼底疾病共同的病理基础[1]。CNV的血管壁薄、脆性大、极易渗漏出血,出血后引起局部炎症反应[7],导致新生血管纤维化,形成纤维瘢痕,引起视力不可逆损害。
研究发现,AMD患者脉络膜血流量较年龄相当者显著减少[8];许多发生CNV的疾病中都有Bruch膜变性增厚,造成脉络膜、色素上皮及视网膜的氧弥散障碍;提示缺血缺氧参与了CNV的病理过程[9]。而血流异常和局部炎症反应引起组织缺血缺氧,并导致多种促血管生长因子分泌释放,促进新的血管生成以增加氧供,可能是导致CNV形成的重要原因[2]。
HIF1是多功能转录因子,HIF1α是其功能亚基,在缺氧时表达增高,通过调控下游基因的表达参与调节细胞对缺氧的反应。VEGF是目前发现的功能最强的血管形成促进因子,其中VEGFA是该家族最重要的成员。VEGF以浓度±赖方式通过不同环节调控血管新生。VEGF基因的增强子序列可与HIF1α特异结合,促使VEGF基因转录增强并不易降解,间接提高了VEGF的活性[4]。抑制HIF-1α表达可降低缺氧时视网膜色素上皮细胞VEGF的表达,抑制CECs的血管发生[10]。
正常情况下,机体内促进和抑制血管新生的因子处于平衡状态。病理条件下该平衡打破,内皮细胞等发生增殖迁移增多,凋亡减少,从而出现血管新生。Notch信号在血管生成中扮演重要角色,Notch及其多种配体如Dll1、Dll4和Jagl等在血管发生和形成过程中的内皮细胞上均有表达[6]。Notch1在眼底血管的发育和稳态维持过程中发挥作用,其缺失可导致胚胎期视网膜血管发育缺陷。同时视网膜病理性血管形成过程中也见Notch参与,激活Notch可降低内皮细胞对血管内皮生长因子的反应灵敏性,抑制内皮细胞增殖和眼内血管生长[11]。
中医学将AMD归纳“视瞻昏渺”范畴,认为与肝肾功能失调有关。临床应用舒肝明目汤治疗AMD取得良好疗效。方中柴胡疏肝解郁;当归、白芍养血柔肝;草决明清肝明目;桑葚补益肝肾;白术、茯苓健脾去湿;首乌藤养血安神。诸药合用达到补益肝肾、舒肝明目的作用。本研究结果显示,正常情况下大鼠CECs几乎不表达HIF1α,而VEGF和Notch1表达也很低。但低氧条件促进CECs发生明显的增殖与迁移,表达HIF1α和VEGF增多,而Notch1表达稍有提高。含药血清可抑制CECs增殖与迁移,使CECs表达HIF1α和VEGF明显降低,而Notch1表达明显增高。提示病理条件下,舒肝明目汤含药血清能通过促进Notch1来抑制VEGF表达,从而负调控内皮细胞的增殖迁移及血管生成,对AMD产生积极的影响。
目前,脉络膜血管新生的机制仍然不很清晰,微环境内的相关多种血管生长调控因子如VEGF与Notch1等的相互作用关系也需进一步阐明。抗VEGF药物作为治疗AMD的新型药物仍有作用难以持久、长期使用有不良反应等不利之处。舒肝明目汤作为相对安全的中医药疗法,对AMD治疗是一个有益的补充。
| [1] | Zarbin MA. Current concepts in the pathogenesis of age-related macular degeneration[J]. Archives of Ophthalmology, 2004, 122 (4): 598–614. DOI:10.1001/archopht.122.4.598 |
| [2] | Brown DM, Heier JS, Ciulla T, et al. Primary endpoint results of a phase Ⅱ study of vascular endothelial growth factor trap-eye in wet age-related macular degeneration[J]. Ophthalmology, 2011, 118 (6): 1089–1097. DOI:10.1016/j.ophtha.2011.02.039 |
| [3] | Vadlapatla RK, Vadlapudi AD, Mitra AK. Hypoxia-Inducible Factor-1 (HIF-1): A Potential Target for Intervention in Ocular Neovascular Diseases[J]. Current Drug Targets, 2013, 14 (8): 919–935. DOI:10.2174/13894501113149990015 |
| [4] | Lin CH, Li CH, Liao PL, et al. Silibinin inhibits VEGF secretion and age-related macular degeneration in a hypoxia-dependent manner through the PI-3 kinase/Akt/mTOR pathway[J]. British Journal of Pharmacology, 2013, 168 (4): 920–931. DOI:10.1111/j.1476-5381.2012.02227.x |
| [5] | Campochiaro PA. Molecular pathogenesis of retinal and choroidal vascular diseases[J]. Progress in retinal and eye research, 2015, 49 : 67–81. DOI:10.1016/j.preteyeres.2015.06.002 |
| [6] | Klose R, Berger C, Moll I, et al. Soluble Notch ligand and receptor peptides act antagonistically during angiogenesis[J]. Cardiovascular Research, 2015, 107 (1): 153–163. DOI:10.1093/cvr/cvv151 |
| [7] | Doyle SL, Campbell M, Ozaki E, et al. NLRP3 has a protective role in age-related macular degeneration through the induction of IL-18 by drusen components[J]. Nature medicine, 2012, 18 (5): 791–798. DOI:10.1038/nm.2717 |
| [8] | Riva CE, Geiser M, Petrig BL. Ocular blood flow assessment using continuous laser Doppler flowmetry[J]. Acta Ophthalmologica, 2010, 88 (6): 622–629. DOI:10.1111/j.1755-3768.2009.01621.x |
| [9] | Arjamaa O, Nikinmaa M, Salminen A, et al. Regulatory role of HIF-1α in the pathogenesis of age-related macular degeneration (AMD)[J]. Ageing Research Reviews, 2009, 8 (4): 349–358. DOI:10.1016/j.arr.2009.06.002 |
| [10] | Kudelka MR, Grossniklaus HE, Mandell KJ. Emergence of dual VEGF and PDGF antagonists in the treatment of exudative age-related macular degeneration[J]. Expert Review of Ophthalmology, 2014, 8 (5): 475–484. |
| [11] | Roca C, Adams RH. Regulation of vascular morphogenesis by Notch signaling[J]. Genes & Development, 2007, 21 (20): 2511–2524. |
 2017, Vol. 34
2017, Vol. 34