文章信息
- 吴彤, 郭长青, 张义, 杜宁宇, 张伟, 陈晨, 王彤, 徐菁, 侣思
- WU Tong, GUO Chang-qing, ZHANG Yi, DU Ning-yu, ZHANG Wei, CHEN Chen, WANG Tong, XU Jing, LV Si
- 针刀干预对肌筋膜疼痛综合征模型大鼠5-HT和NE的影响
- Effect of acupotomology on 5-HT and NE in rats with myofascial pain syndrome
- 天津中医药, 2017, 34(7): 478-481
- Tianjin Journal of Traditional Chinese Medicine, 2017, 34(7): 478-481
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.07.14
-
文章历史
- 收稿日期: 2017-04-25
肌筋膜疼痛综合征(MPS)是一种以慢性软组织源性疼痛且伴有一个或多个触发点为主要特征的一组临床证候群, 是引起软组织疼痛最主要的原因之一。该病属临床常见病,在软组织疼痛患者中所占比例高达20%~95%[1],在中老年人群中非常多见,随着互联网、电脑和智能终端的普及青年人中也不罕见。“触发点”由美国学者Janet于1942年首次提出,是该病的特征性表现[2]。故临床治疗多针对触发点局部治疗,治疗方法包括局部注射利多卡因注射液、局部注射肉毒毒素、针刀疗法以及手法治疗等[3]。其中,针刀疗法在临床中应用广泛,对MPS触发点疼痛的缓解效果明显[4-9],且具有疗效持久、副作用小等优点,但其具体治疗机制尚不完全明确。
五羟色胺(5-HT)和去甲肾上腺素(NE)在疼痛的产生中发挥一定作用[10],是重要的疼痛介质,而临床上发现针刀疗法可显著缓解MPS触发点局部的疼痛,故本研究建立肌筋膜疼痛综合征模型鼠,观察针刀干预对血清及触发点局部的5-HT和NE含量的影响,为针刀治疗肌筋膜疼痛综合症提供一定的实验±据。
1 材料和方法 1.1 实验材料大鼠5-HT ELISA检测试剂盒、NE ELISA检测试剂盒(Adlitteram Diagnostic Laboratories公司,美国)、Dako REALTM EnVisiontm Detection SystemPeroxidase/DAB+、Rabbit/Mouse(DAK0公司,丹麦)、DSPT-208动物跑台(立泰科技有限公司,杭州)、MDF-U50A超低温冰箱(SANYO公司, 日本)、TB-718生物组织包埋机(樱花公司,日本)、Leica RM2235组织切片机(莱卡公司,德国)、OlymPus bx51显微镜(奥林帕斯公司,美国)、Anymicro DSSTM图像采集系统(江苏琅珈科技有限公司)、Stat Fax2100全自动酶标仪(Awareness Technology公司,美国)、针刀(汉章牌0.40 mm×40 mm针刀, 北京华夏针刀医疗器械厂)。
1.2 实验方法 1.2.1 实验动物及分组清洁、健康级10周龄雄性SD大鼠24只,体质量300~400 g,按照随机数字表法随机分为4组,每组6只。1) 空白组:正常饲养,不造模,不干预,相同抓取刺激。2) 模型组:造模后,正常饲养,不干预,相同抓取刺激。3) 局部注射组(阳性对照):造模后,在股内侧肌触发点处,用注射器向紧张带内注射1%利多卡因0.5 mL,每周1次,连续3周。4) 针刀组:造模后,在股内侧肌触发点处,用直径0.4 mm针刀,刀口线方向与肌纤维方向一致,直刺进入紧张带,并纵向切开紧张带1刀,每周1次,连续3周。
1.2.2 造模及检测方法按照黄强民教授提出的打击结合离心运动法建立触发筋膜疼痛综合征动物模型:将大鼠分别在其右股内侧肌中段偏近侧端作为打击位置标记[11]。先用10%的水合氯醛按3 mL/kg体质量进行腹腔麻醉,麻醉后把大鼠固定在打击器下面的木板上,使打击器从20 cm的高度自由落下打击标记部位。次日让大鼠在-16°的电动跑台上进行持续性下坡跑训练,速度逐渐增至16 m/min,进行90 min的离心运动。运动中使用声音和小棒驱赶,以保证良好的运动效果。每周进行1次造模,连续8周。第8次造模结束后喂养1周。
随机选取3只大鼠予以局部解剖,暴露股四头肌,寻找股四头肌上的触发点:1) 通过指腹明显检查到紧张带以及膨大结节的列为紧张带阳性。2) 膨大结节处肌电图测试,将无刺激情况下电位持续大于30 s小于10 min的作为阳性。3) 当电极插入膨大结节内,能引出局部抽搐时为阳性。4) 对取得的肌肉结节或条索带行组织病理HE染色,显示肌纤维收缩(挛缩)结节、肌纤维宽度不等、炎性浸润、纤维增生时为阳性[12-13]。3只大鼠以上4条均为阳性则表明造模成功。
1.2.3 检测方法酶联免疫反应(ELISA)检测血清中5-HT、NE含量:造模及分组处理后,禁食12 h,腹主动脉采血1 mL,37 ℃水浴15 min,离心4 000转10 min,分离血清,-20 ℃保存待测。按照检测5-HT和NE的ELISA试剂盒说明书进行操作,于波长450 nm酶标仪上读取各孔的A值。以A值为纵坐标, 相应的标准品含量为横坐标,绘制标准曲线,样品5-HT、NE的含量可据其A值由标准曲线换算出相应的含量。
ELISA检测局部组织中5-HT、NE含量:分离位于股四头肌处的触发点(膨大结节处),低温生理盐水冲洗后, -70 ℃冰箱保存待测。匀浆处理后,行ELISA检测相应因子,方法同上。
1.2.4 统计方法采用SPSS 20.0统计软件进行统计分析,数据采用均数±标准差(x±s)表示。多组间比较,若各组数据均符合正态分布,采用单因素方差分析,若数据呈偏态分布,采用Kruskal-wallis H检验,以P<0.05为差异有统计学意义。
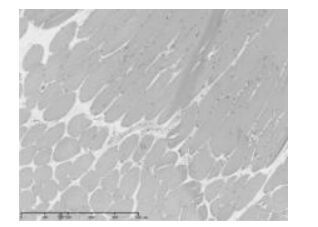
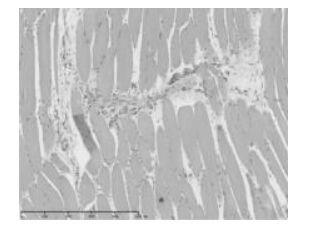
2 结果 2.1 造模结果在连续8周的造模后,随机选取的3只大鼠股四头肌处均可找到触发点。组织病理HE染色,触发点局部组织肌纤维之间可见炎性浸润,以及明显的纤维增生,造模成功。见图 1,图 2。
|
| 图 1 空白组大鼠肌肉组织(HE×100) Fig. 1 Muscle tissue of rats in control group(HE Staining ×100) |
|
| 图 2 造模组大鼠肌肉组织(HE×100) Fig. 2 Muscle tissue in of rats model group(HE Staining ×100) |
经ELISA方法检测各组大鼠血清中5-HT、NE的含量,与空白组相比,模型组大鼠的5-HT、NE和注射组的5-HT显著升高(P<0.05);注射组NE和针刀组的5-HT、NE含量均无统计学差异(P>0.05)。与模型组比较,针刀组和注射组大鼠5-HT、NE含量均显著下降(P<0.05);针刀组和注射组之间无统计学差异(P>0.05)。见表 1。
经ELISA检测股四头肌处触发点肌肉组织中5-HT、NE的含量,因测得的含量太低,用“含量的-log值”来进行统计分析。与空白组相比,模型组大鼠5-HT、NE和注射组5-HT含量均显著升高(P<0.05);注射组NE或针刀组5-HT、NE无统计学差异(P>0.05)。与模型组相比,针刀组大鼠5-HT、NE含量和注射组NE均显著下降(P<0.05);注射组5-HT含量无统计学差异(P>0.05);注射组和针刀组大鼠的NE含量无统计学差异(P>0.05)。见表 2。
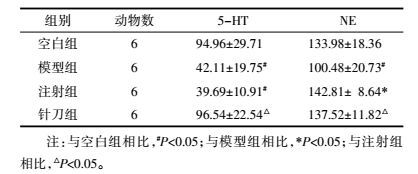 |
肌筋膜疼痛综合征在临床上主要表现为肌肉疼痛,治疗原则是用不同的方法对受累肌肉或肌群牵张或破坏张力带和触发点[14]。近年来国内对针刀疗法治疗肌筋膜疼痛综合征的进行了比较严格的观察,证明这种方法有较好的疗效[15-17]。为了更好地研究其中的作用机制进而推广针刀疗法的应用,本研究采用ELISA法检测针刀治疗后大鼠血清和触发点局部肌肉组织中5-HT、NE含量,并与局部注射利多卡因疗法进行对比,发现针刀干预后血清和组织中5-HT、NE含量均明显下降,注射干预后血清和组织中NE含量明显下降,而5-HT含量只在血清中下降,组织中并未下降。通过与模型组相比,针刀干预可降低5-HT、NE在局部组织和血清中的含量,该效应不低于局部注射利多卡因疗法。这可能是针刀疗法治疗MPS的机制之一。
5-HT和NE均属于单胺类神经递质,对疼痛的影响,在中枢和外周有着不同的作用。在外周尤其是疼痛局部可以加重甚至诱发疼痛[18],如有研究表明针刀疗法可下降血清中5-HT的含量,从而对腰椎间盘突出症根性神经痛起到局部镇痛作用[19];在中枢的作用比较复杂,如有研究者发现针刀和电针对中枢5-HT、NE的作用,在不同位置的作用不用[20]。
本研究有针对性的研究局部及外周血清中5-HT、NE的变化,结果提示降低外周血和局部组织中5-HT、NE的含量可能是针刀治疗MPS的机制之一,为临床治疗MPS提供了实验±据。但疼痛的发生机制较为复杂,参与发生和加重的因子繁多,5-HT、NE故为其中的一部分不能完全标志疼痛的缓解或加重,故关于针刀疗法对MPS疼痛的缓解还需要更进一步全面和深入的研究。
| [1] | Travell JG, Simons DG. Myofascial pain and dysfunction: the trigger point manual[M]. Baltimore: USA.Williams & Wilkins, 1992: 2-10. |
| [2] | Jan D, David GS. Myofascial pain syndrome-trigger points[J]. Journal of Musculoskeletal Pain, 2008, 16 (4): 333–338. DOI:10.1080/10582450802479677 |
| [3] | Hocking MJ. Exploring the central modulation hypothesis: do ancient memory mechanisms underlie the pathophysiology of trigger points[J]. Curr Pain Headache Rep, 2013, 17 (7): 347. DOI:10.1007/s11916-013-0347-6 |
| [4] | 邵大清. 小针刀综合疗法治疗肩背部肌筋膜疼痛综合征44例[J]. 颈腰痛杂志, 2005, 26 (5): 378–379. |
| [5] | 徐小柳, 李殿宁, 周建斌, 等. 针刀治疗枕下肌肌筋膜疼痛综合征临床观察[J]. 中国中医急症, 2016, 25 (7): 1389–1391. |
| [6] | 李晓莉, 曾军. 神经阻滞与小针刀治疗颈肩肌筋膜疼痛综合征疗效分析[J]. 河北医药, 2012, 34 (18): 2795–2796. |
| [7] | 黄明华, 宁宇, 张翔, 等. 针刀疗法治疗腰肌筋膜疼痛综合征[J]. 北京中医药, 2008, 27 (7): 530–531. |
| [8] | 尉泽民. 激痛点针刀疗法治疗腰臀肌筋膜疼痛综合征的临床观察[D]. 广州: 广州中医药大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10572-1015363367.htm |
| [9] | 麻林, 李玉霞. 复合方法治疗颈肩肌筋膜疼痛综合征68例[J]. 白求恩军医学院学报, 2007, 5 (6): 352–353. |
| [10] | 孙凤艳. 医学神经生物学[M]. 上海: 复旦大学出版社, 2016: 150-151. |
| [11] | 姚明华, 黄强民. 肌筋膜触发点疼痛的实验动物模型研究[J]. 中国运动医学杂志, 2009, 28 (4): 415–418. |
| [12] | 韩蓓, 黄强民, 谭树生, 等. 大鼠肌筋膜疼痛触发点自发肌电现象和病理组织学研究[J]. 中国运动医学杂志, 2011, 30 (6): 532–535. |
| [13] | 王永慧, 孟菲, 丁欣利, 等. 大鼠肌紧张带重复低频电刺激后的生物力学及病理学改变[J]. 中华物理医学与康复杂志, 2015, 37 (7): 493–497. |
| [14] | 黄强民. 肌筋膜触发点及肌筋膜疼痛综合征[J]. 颈腰痛杂志, 2004, 25 (5): 360–362. |
| [15] | Simons DG, Travell JG, Simons LS. Travell and Simons myofascial pain and dysfunction: the trigger point manual[M]. Baltimore: USA Williams & Wilkins, 1998: 89-92. |
| [16] | Celiker R, Atalay A, Guven Z. Health-related quality of life in patients with myofascial pain syndrome[J]. Curr Pain Headache Rep, 2010, 14 (5): 361–366. DOI:10.1007/s11916-010-0141-7 |
| [17] | Sikdar S, Ortiz R, Gebreab T, et al. Understanding the vascular environment of myofascial trigger points using ultrasonic imaging and computational modeling[J]. Conf Proc IEEE Eng Med Biol Soc, 2010, 2010 : 5302–5305. |
| [18] | 孟莹, 薛庆生, 于布为, 等. 外周5-羟色胺受体亚型对痛觉传递的双向影响[J]. 中国疼痛医学杂志, 2013, 19 (10): 618–621. DOI:10.3969/j.issn.1006-9852.2013.10.010 |
| [19] | 付伟涛, 郭长青, 梁楚西, 等. 针刀对腰突根性神经痛大鼠外周镇痛机制的实验研究[J]. 吉林中医药, 2014, 34 (10): 1003–1006. |
| [20] | 嵇波, 郭长青, 金燕, 等. 针刀和电针对膝骨关节炎大鼠痛阈和中枢单胺类神经递质的影响[J]. 中国病理生理杂志, 2010, 26 (6): 1091–1095. |
 2017, Vol. 34
2017, Vol. 34