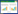文章信息
- 林芳芳, 周琦, 刘树民
- LIN Fang-fang, ZHOU Qi, LIU Shu-min
- 穿山龙总皂苷对痛风性关节炎大鼠尿液中生物标志物的影响
- Effect of total saponins from Rhizoma Dioscorea nipponica on biomarkers in urine of gouty arthritis rats
- 天津中医药, 2017, 34(7): 486-490
- Tianjin Journal of Traditional Chinese Medicine, 2017, 34(7): 486-490
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.07.16
-
文章历史
- 收稿日期: 2017-02-20
2. 黑龙江中医药大学中医药研究院, 哈尔滨 150040;
3. 黑龙江中医药大学黑龙江省高等教育科技创新团队, 哈尔滨 150040
人体的代谢过程中涉及大量的小分子化合物,包括碳水化合物、脂类、核苷酸等。这些化合物作为体内的生物标志物,是解剖学、生理学、生化或影像学中的特征物质,可以确保疾病的诊断预后,并且能对治疗效果进行评价[1]。尿酸是嘌呤在体内代谢的最终产物,嘌呤代谢障碍导致的高尿酸血症是痛风性关节炎发病的重要生化基础。而嘌呤代谢产生尿酸的过程中,鸟苷是重要的中间体。经一系列的酶联反应最终形成尿酸。同时,在痛风性关节炎急性期体内高浓度尿酸沉积形成晶体,引起继发性损伤与炎症,过度细胞因子释放和细胞凋亡等病理过程。鸟苷具有显著的营养和保护作用,可使组织损伤部位细胞凋亡数量减少[2]。鸟苷的保护作用是通过刺激细胞释放和增加合成各种因子实现的,如成纤维细胞生长因子(FGF)、神经生长因子(NGF)等,这些因子有助于损伤组织的修复[3]。所以观察尿液中鸟苷的含量变化,对于确定其是否参与痛风性关节炎的免疫调节具有重要意义。肌酐是肌肉在人体内代谢的产物,主要从尿液中排出。它是临床常用检测项目,是了解肾功能的主要指标之一。它与嘌呤代谢虽无直接关系,但在高尿酸血症和痛风的研究中却有重要作用,Kim等[4]在别嘌呤醇和非布索坦治疗痛风的研究中发现,体内尿酸水平与肌酐水平显著相关。
因此,体液中鸟苷、尿酸和肌酐可作为痛风性关节炎发生发展的生物标志物,对于痛风性关节炎的诊断和治疗具有重要的指示作用[5]。本研究观察穿山龙总皂苷给药前后这些生物标志物在尿液中的含量变化,确定其是否会通过调控体内生物标志物的合成和代谢来实现抗痛风性关节炎的目的。
1 实验材料 1.1 动物雄性Wistar大鼠60只,体质量(200±20) g,购于辽宁长生生物技术有限公司。放置于黑龙江中医药大学GLP实验中心适应性饲养7 d,室温20~25 ℃,相对湿度30%~70%,食用由黑龙江中医药大学实验动物中心提供的饲料,自由摄食、饮水,12 h光照,排风,并且定时清洁、消毒。
1.2 药品、仪器及试剂药材穿山龙购自哈尔滨世一堂饮片厂(批号:090501),产地黑龙江,经黑龙江中医药大学中医药研究院付克教授鉴定为合格品。穿山龙总皂苷,棕色粉末,由穿山龙经乙醇回流提取、大孔吸附树脂洗脱纯化后得到,主要含原薯蓣皂苷等成分。通过紫外分光光度法,以薯蓣皂苷为标准品,测定穿山龙总皂苷的含量>50%,为实验室前期提取获得。秋水仙碱片购于西双版纳药业有限责任公司(批号:151121)。
美国高效液相色谱仪(Waters e2695) 配有UV/Vis Detector(Waters2489)、自动进样器、柱温箱、色谱数据处理系统;C18反相色谱柱(Diamonsil 5 μL,250 mm×4.6 mm);电子天平(Sartorius BS124s);高频数控超声波清洗仪(昆山市超声仪器有限公司);低温冷冻离心机(美国Thermo Scientific);氮吹仪(AutoScience);电热恒温水浴锅(上海博迅实业有限公司医疗设备厂);pH计(Sartorius PB-21)。
乙腈(Dikma Pure,色谱级,批号:70206),甲醇(Dikma Pure,色谱级,批号:81120);尿酸(Sigma, 批号:BCBQ2650V);鸟苷(中国食品药品检定研究院,批号:111977-201501);
2-氯-L-苯丙氨酸(山东西亚化学工业有限公司,批号:N2727),尿酸检测试剂盒(南京建成生物工程研究所,批号:20160729),肌酐检测试剂盒(南京建成生物工程研究所,批号:20160725)。
2 实验方法 2.1 大鼠分组和处理将60只雄性Wistar大鼠适应性饲养7 d后按照随机数字表法随机分为6组,分别为正常组、模型组、阳性药秋水仙碱组(0.3 mg/kg)和穿山龙高剂量组(160 mg/kg)、中剂量组(80 mg/kg)、低剂量组(40 mg/kg)。按上述给药量进行灌胃给药,给药第3天灌胃1 h后造模,腹腔注射10%水合氯醛麻醉大鼠(0.4 mL/100 g),麻醉后将其膝关节轻度弯曲,使用6号注射针在大鼠膝关节上方髌上韧带注射0.2 mL尿酸钠混悬液,造成实验性痛风性关节炎模型,正常组注射等体积生理盐水。造模第5天使用代谢笼法收集24 h尿液,离心取上清液保存于-80 ℃冰箱中保存。同时,灌胃后2 h,大鼠断头处死,于膝关节正中纵行切开皮肤,分离肌肉,露出膝盖骨继续剥离,这时可见到平滑光亮的滑膜组织,用手术刀分离关节囊的滑膜层和纤维层,取出滑膜层组织。将取出的大鼠膝关节滑膜组织10%多聚甲醛固定。经脱水、透明、包埋,制成蜡块,待用。
2.2 病理染色结果分析1) 将包埋好的石蜡进行切片,厚度为4 μm,切片用二甲苯脱蜡,经各级乙醇至水洗:二甲苯(Ⅰ)10 min→二甲苯(Ⅱ)10 min→100%乙醇(Ⅰ)5 min→100%乙醇(Ⅱ)5 min→95%乙醇5 min→75%乙醇5 min→蒸馏水洗2 min。2) 苏木素染胞核5 min,蒸馏水冲洗。3)1%盐酸-酒精分化3 s。4) 温水浸泡(约50 ℃)5 min。5) 伊红染色1 min,蒸馏水洗。6) 脱水,透明,中性树胶封片:75%乙醇5 min→95%乙醇5 min→100%乙醇(Ⅰ)5 min→100%乙醇(Ⅱ)5 min→二甲苯(Ⅰ)5 min→二甲苯(Ⅱ)5 min→中性树胶封片。7) 显微镜下观察各滑膜组织病理变化,并摄片。
2.3 高效液相色谱法(HPLC) 2.3.1 标准溶液的配制精密称取鸟苷、2-氯-L-苯丙氨酸(内标物)10 mg分别置于10 mL用纯水溶解并定溶至刻度,分别配成1 mg/mL的储备液,4 ℃冰箱中密封避光保存。
流动相的配制:精密称取乙酸铵2.312 4 g,用蒸馏水溶解并定至1 000 mL,冰醋酸调pH至4.65,并超声脱气20 min。
2.3.2 尿样的预处理取尿样0.4 mL与1.2 mL的甲醇混合,加入内标物2-氯-L-苯丙氨酸储备液0.2 mL,12 000 r/min离心10 min,取上清液,使用氮吹仪吹干,将沉淀复溶于150 μL纯水中,0.22μm滤膜过滤,取过滤液进样。
2.3.3 色谱条件色谱柱(Diamonsil C18 5 μL,250 mm×4.6 mm),流动相A:甲醇,流动相B:乙酸铵,pH4.65,超声脱气20 min,流速1 mL/min,检测波长254 nm,柱温:25 ℃,进样量10 μL,洗脱程序见表 1[6-9]。
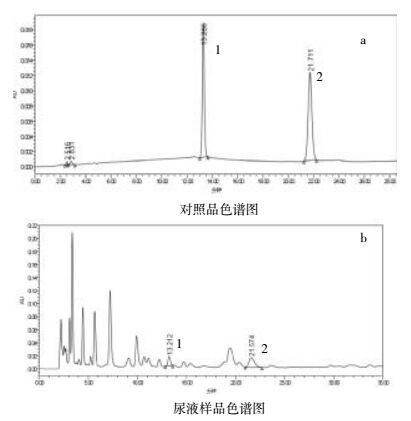
精密吸取2.3.1项下鸟苷对照品溶液与内标对照品溶液混匀,使用0.22 μm滤膜过滤,取过滤液;另取2.3.2项下的尿样,分别进样。记录色谱图,结果见图 1(a和b)。结果鸟苷和内标峰与杂质峰完全分离,其他成分对测定无于扰。
|
| 图 1 混合对照品溶液和尿液样品色谱图 Fig. 1 Mixed standard solution and urine sample chromatogram 1 为鸟苷;2 为 2-氯-L-苯丙氨酸 |
精密吸取2.3.1项下鸟苷对照品溶液0.05、0.1、0.15、0.2、0.25、0.3、0.35 mL,内标对照品溶液0.2 mL,分别置于10 mL容量瓶中,混匀稀释至刻度,0.22 μm滤膜过滤,按2.3.3项下的色谱条件测定,以鸟苷与内标峰面积比值为纵坐标(Y),鸟苷浓度为横坐标(X)进行线性回归,得鸟苷的回归方程Y=0.077 9X+0.028 6,r2=0.999 7,结果表明鸟苷浓度在5.025~35.088 mg/L范围内与峰面积比值呈良好的线性关系。
2.3.6 定量限、检测限实验连续稀释鸟苷与内标的混合对照品溶液,得信噪比为10时鸟苷的定量限为1 mg/L;信噪比为3时鸟苷的检测限为0.9 mg/L。
2.3.7 精密度实验精密吸取鸟苷和内标混合对照品溶液1.0 mL,并按2.3.3项下色谱条件检测,重复进样6次,测定鸟苷与内标峰面积积分比值,结果鸟苷的RSD为0.28%(n=6);另将上述混合对照品溶液连续测定3 d,结果甘氨酸的RSD为0.29%(n=3),RSD<3%,表明仪器精密度良好。
2.3.8 稳定性实验取2.3.2项下尿样l份,按供试品溶液制备方法制样,室温下放置,分别在0,3,6,9,12,24 h时进样,测得鸟苷峰面积与内标峰面积的比值。结果鸟苷RSD为1.70%,表明供试品溶液在24 h内稳定性良好。
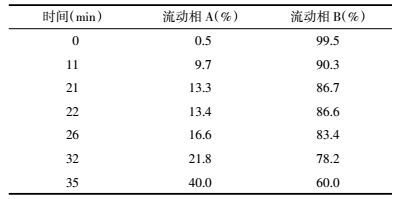
2.3.9 加样回收率实验取2.3.2项下尿样,分别精密加入样品含量120%、100%、80%的鸟苷,混匀,按2.3.3项下色谱条件进样,计算样品回收率,结果见表 2。
按2.3.2项下方法预处理尿样,2.3.3项下的色谱条件进样10 μL,记录鸟苷与内标峰面积的比值,使用已得出的线性关系计算得出尿样中鸟苷的浓度。
2.5 紫外分光光度法检测尿酸、肌酐含量按照尿酸和肌酐试剂盒使用说明书,将试剂与样品±次加入孔板中,在要求波长下使用酶标仪测定吸光度值。
2.6 统计分析采用SPSS 18.0统计软件进行统计分析,所有数据均以平均值±标准差(x±s)的方式表示,多组间的比较采用单因素方差分析(ANOVA),各组与模型组的多重比较采用Dunnett检验。P < 0.05为差异具有统计显著性。
3 实验结果 3.1 病理染色结果分析各组大鼠关节滑膜经HE染色后光镜下观察:正常大鼠滑膜组织的病理学检查滑膜细胞呈单层生长,滑膜组织内未发现异常炎性细胞,无增生;痛风性关节炎大鼠关节炎症状明显,滑膜出现增生,细胞排列不规则,炎性细胞浸润和血管翳形成,见图 2,说明造模成功;穿山龙高、中、低剂量组及阳性药秋水仙碱组均能够减轻滑膜组织增生及炎性细胞浸润。
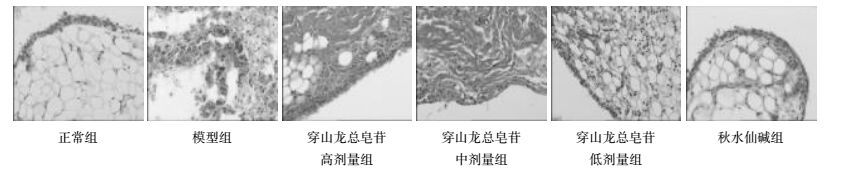
|
| 图 2 HE染色评价穿山龙总皂苷对痛风性关节炎大鼠组织病理学改变的影响(×200) Fig. 2 Influnence of RDN on histopathological changes in rats with gouty arthritis by HE staining(×200) |
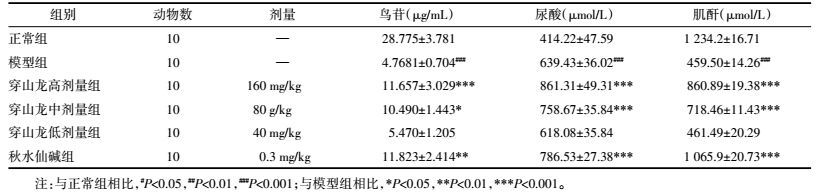
尿样中各生物标志物的含量如表 3所示。
如表 3所示,与正常组相比,模型组中鸟苷和肌酐含量显著降低、尿酸显著升高(P<0.001);穿山龙高中剂量组均显著升高尿液中鸟苷、尿酸和肌酐的含量(P<0.001);秋水仙碱亦能显著升高尿样中鸟苷(P<0.01)、尿酸和肌酐(P<0.001) 的含量。
 |
痛风性关节炎发病率无论是在发达国家还是发展中国家都在逐年升高,近年来更成为诱发急性肾损伤、动脉粥样硬化、脑血管病、心血管疾病及糖尿病的危险因素,所以对这一疾病的及时预测和诊断具有重要的临床治疗价值。
体内嘌呤代谢异常引起的血尿酸浓度升高是痛风性关节炎发病的生化基础,鸟苷作为中间体经嘌呤核苷磷酸化酶催化,在体内代谢成黄嘌呤,再通过黄嘌呤氧化酶形成尿酸。本实验结果表明,模型组鸟苷含量显著下降,提示在病理状态下,鸟苷可能大量转化为尿酸参与痛风性关节炎的发生;这与LiuY等[10]的在痛风性关节炎急性期发作时鸟苷含量降低的研究结果一致。与模型组相比,穿山龙总皂苷给药组能升高尿液中鸟苷的含量,说明穿山龙总皂苷可能通过抑制鸟苷转化成尿酸,增加鸟苷的排泄发挥治疗作用。其具体机制仍有待深入研究。同时,鸟苷含量的升高亦提示其可能发挥了营养与保护作用。
模型组尿液中尿酸的含量较正常组高,这可能是由于在通过将尿酸盐结晶注入大鼠关节滑膜组织的过程中,部分盐进入了体液循环,发生了解离,最终从尿液中排出。穿山龙总皂苷高中低剂量给药后尿液中尿酸的量显著增加,说明穿山龙总皂苷通过促进尿酸的排泄发挥治疗痛风性关节炎的作用。这与本实验室前期关于穿山龙总皂苷对高尿酸血症的降尿酸作用的研究结果一致[11-13]。
肌酐主要经过肾小球过滤后随尿液排出体外,当肾功能受到损伤时,会导致尿肌酐排泄减少。有研究表明,在痛风性关节炎患者体内,尿酸晶体沉积在肾小管、肾间质和肾髓质处,导致肾小管萎缩和血管变性,造成肾损伤[14],影响物质在肾脏的正常排泄。本研究发现,在痛风性关节炎模型组中,尿液肌酐的量显著降低,在穿山龙总皂苷给药后,尿液中肌酐的量显著升高,说明穿山龙总皂苷可能通过修复肾脏损伤,改善肾脏功能促进体内肌酐的排泄。综上所述,本研究从生物标志物及其代谢产物与痛风性关节炎的相关性入手,研究了穿山龙总皂苷对其调控作用。发现灌胃给药穿山龙总皂苷可以影响体内鸟苷、尿酸和肌酐的合成与代谢,这可能为穿山龙治疗痛风性关节炎等炎症疾病的重要机制。但由于生物系统内在的复杂性,其具体机制仍有待深入研究。
| [1] | Guma M, Tiziani S, Firestein GS. Metabolomics in rheumatic diseases: desperately seeking biomarkers[J]. Nat Rev Rheumatol, 2016, 12 (5): 269–281. DOI:10.1038/nrrheum.2016.1 |
| [2] | Jiang S, Bendjelloul F, Ballerini P, et al. Guanosine reduces apoptosis and inflammation associated with restoration of function in rats with acute spinal cord injury[J]. Purinergic Signal, 2007, 3 (4): 411–421. DOI:10.1007/s11302-007-9079-6 |
| [3] | McDonald JW, Belegu V. Demyelination and remyelination after spinal cord injury[J]. J Neurotrauma, 2006, 23 (3-4): 345–359. DOI:10.1089/neu.2006.23.345 |
| [4] | Kim HA, Seo YI, Song YW. Four-week effects of allopurinol and febuxostat treatments on blood pressure and serum creatinine level in gouty men[J]. J Korean Med Sci, 2014, 29 (8): 1077–1081. DOI:10.3346/jkms.2014.29.8.1077 |
| [5] | Liu Y, Sun X, Di D, Quan J, Zhang J, Yang X. A metabolic profiling analysis of symptomatic gout in human serum and urine using high performance liquid chromatography-diode array detector technique[J]. Clin Chim Acta, 2011, 412 (23-24): 2132–2140. DOI:10.1016/j.cca.2011.07.031 |
| [6] | 陆杰霖, 柴尧, 贾梦蛟, 等. 四角蛤蜊、菲律宾蛤仔及文蛤水提醇沉上清液中相关核苷类物质的含量测定[J]. 南京中医药大学学报, 2014, 30 (1): 76–78. |
| [7] | 王欣, 孟宪杰, 张悫. 高效液相法测定板蓝根注射液中三种核苷的含量[J]. 现代中西医结合杂志, 2012, 21 (6): 646–647. |
| [8] | Stentoft C, Vestergaard M, Lovendahl P, et al. Simultaneous quantification of purine and pyrimidine bases, nucleosides and their degradation products in bovine blood plasma by high performance liquid chromatography tandem mass spectrometry[J]. Journal of ChromatographyA, 2014, 1356 : 197–210. DOI:10.1016/j.chroma.2014.06.065 |
| [9] | 许红莉, 邓新. HPLC法测定半贝丸中腺苷、鸟苷、西贝母碱和西贝母碱苷的含量[J]. 中国药房, 2016, 25 (47): 4478–4480. |
| [10] | Liu Y, Sun X, Di D, et al. A metabolic profiling analysis of sympomatic gout in human serum and urine using high performance liquid chromatography-diode array detector technique[J]. Clinica Chimica Acta, 2011, 412 (23-24): 2132–2140. DOI:10.1016/j.cca.2011.07.031 |
| [11] | 周琦, 张翀, 于栋华, 等. 穿山龙总皂背对高尿酸血症的降尿酸及细胞抗炎作用研究[J]. 中华中医药杂志, 2013, 28 (5): 1444–1448. |
| [12] | Zhou Q, Yu DH, Zhang C, et al. Total saponins from Discorea nipponica ameliorate urate excretion in hyperuricemic mice[J]. Planta Md, 2014, 80 : 1259–1268. DOI:10.1055/s-00000058 |
| [13] | Zhou Q, Yu DH, Liu SM, et al. Total saponins from Discorea nipponica ameliorate urate excretion in hyperuricemic rats[J]. Pharmacogn Mag, 2015, 11 (43): 567–573. DOI:10.4103/0973-1296.160442 |
| [14] | Sattui SE, Singh JA, Gaffo AL. Comorbidities in patients with crystal diseases and hyperuricemia[J]. Rheum Dis Clin North Am, 2014, 40 (2): 251–278. DOI:10.1016/j.rdc.2014.01.005 |
2. Research Institute of Chinese Medicine, Heilongjiang University of Chinese Medicine, Harbin 150040, China;
3. Technology Innovation Team of High Education in Heilongjiang Province, Harbin 150040, China
 2017, Vol. 34
2017, Vol. 34