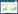文章信息
- 王宏, 康利, 刘庆焕, 郝迪, 王蕾, 陶遵威
- WANG Hong, KANG Li, LIU Qing-huan, HAO Di, WANG Lei, TAO Zun-wei
- 复方红景天对大鼠缺血性脑损伤后海马组织细胞凋亡的影响
- Study on effect of Compound Rhodiola on apoptosis of hippocampus in rats with cerebral ischemia
- 天津中医药, 2017, 34(8): 554-558
- Tianjin Journal of Traditional Chinese Medicine, 2017, 34(8): 554-558
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.08.16
-
文章历史
- 收稿日期: 2017-03-16
缺血性脑损伤常由一条或多条脑血管缺血导致该供血区局灶性功能障碍,因其高致死率和致残率,给患者家庭和社会带来沉重的负担[1]。中医药在脑损伤的防治方面积累了丰富的经验,具有独特的治疗优势[2-3]。天津市医药科学研究所制剂中心紧扣缺血性脑损伤“气虚血滞、脉络瘀阻”的病机,以“益气活血,化瘀通络”为原则,选用红景天、川芎、延胡索、冰片为组分制成复方红景天,并首次使用该方干预缺血性脑损伤,初步药效学和毒性实验表明其对大鼠缺血性脑损伤具有保护作用且安全无毒。本研究在上述基础上,利用大鼠脑缺血模型,观察复方红景天对脑细胞凋亡的影响,探讨复方红景天保护缺血性脑损伤的作用机制。
1 材料和方法 1.1 动物健康雄性SD大鼠80只,体质量160~180 g,SPF级,由北京维通利华实验技术有限公司提供,动物合格证号:SCXK(京)2012-0001。
1.2 药物与试剂复方红景天浸膏,由天津市医药科学研究所制剂中心提供;尼莫地平片,天津市中央药业有限公司,规格:每片30 mg,产品批号:140919,生产日期:2014年9月13日,有效期至2017年8月;2,3,5-氯化三苯基四氮唑(TTC),天津市瑞金特化学品有限公司,产品批号:2015年4月17日;TUNEL试剂盒,罗氏生物公司;Bax、Bcl-2抗体购自北京博奥森生物技术有限公司;线栓,2432-A4,北京西浓科技有限公司。
1.3 动物模型的制备 1.3.1 模型复制采用Zea-Longa线栓法制备大鼠左侧大脑中动脉闭塞模型(MCAO)[4-5]。术前禁食不禁水12 h。10%水合氯醛(3.5 mL/kg)腹腔注射麻醉,将大鼠仰卧位固定于手术台上。常规消毒,颈部正中切口,钝性分离皮下组织,暴露右侧颈总动脉(CCA)、颈内动脉(ICA)和颈外动脉(ECA),小心分离与CCA伴行的迷走神经,用5-0号丝线结扎CCA和ECA,ICA近端备线,在CCA距离分叉处0.5 cm左右用眼科剪剪一小口,将备用线栓送入切口,向内推行,线栓经ICA顺行至中动脉,遇到阻力时停止,从CCA分叉处计算插入深度(1.8±0.5)cm,此即完成一侧的MCAO模型,结扎ICA备线,缝合切口。假手术组只分离血管,不结扎不插线栓。术中白炽灯照射,使肛温保持在(37±0.5)℃。
1.3.2 模型成功标志神经功能评分按Zea-Longa评分法[4]:0分,无神经缺损症状。1分,不能伸展对侧前爪。2分,行走时向偏瘫侧转圈。3分,向偏瘫侧倾倒。4分,不能自发行走,意识丧失。评分1~3分为模型复制成功。
1.4 分组及给药将造模成功的大鼠按体质量随机分为模型组、尼莫地平组(阳性对照,0.012 g/kg,相当于临床用量的6倍)、复方红景天高、低剂量组(2.62、1.31 g生药/kg,相当于临床用量的12、6倍)组。复制模型前7 d开始灌胃给药,1次/日,连续10 d。假手术组和模型组灌胃给予等体积纯净水。
1.5 各组大鼠行为学指标的测定 1.5.1 各组大鼠横木行走实验评分在末次给药1 h后,大鼠进行横木行走实验。横木宽2.5 cm,长120 cm,厚2.5 cm,水平悬空放置,距地面60 cm。术前训练2 d,2次/日。评分标准:0分,通过横木,能够保持平衡,且大鼠4只爪子均位于木条表面。1分,通过横木,大鼠爪子抓住平衡木的边缘。2分,大鼠抓住平衡木,且1只爪子自平衡木垂下。3分,大鼠2只爪子自平衡木垂下,或在平衡木上旋转(>60 s)。4分,大鼠试着在平衡木上维持平衡却跌落下来(>40 s)。5分,大鼠试着在平衡木上维持平衡却跌落下来(>20 s)。6分,大鼠自平衡木上跌落(<10 s)。
1.5.2 各组大鼠前肢抓握力测定在横木行走实验后进行抓握力测定。大鼠双前肢抓住自制拉力测试仪的拉力横杆,测试者左手先固定拉力板,右手向后拉住鼠尾,松开左手,右手向后拉拽大鼠身体。大鼠为了不从横杆滑脱会抓握横杆不放,直至滑脱,读取使大鼠滑脱的最大拉力值。每只大鼠测3次,取平均值。
1.6 各组大鼠脑梗死比例测定复制模型48 h后,10%水合氯醛(3.5 mL/kg)腹腔注射麻醉,迅速断头取脑,冷盐水冲洗,-20 ℃放置10 min。待脑组织稍硬后,取出切掉嗅球、垂体、低位脑干,由前向后冠状切片,脑片厚度约2 mm,等分切成5片。脑片置于1%TTC磷酸盐缓冲液中,37 ℃避光温育30 min,每隔5 min左右翻动1次。4%多聚甲醛固定,正常脑组织呈玫瑰红色,梗死组织呈白色。眼科镊精确剥离梗死部位,电子天平精密称取梗死部位质量与全脑质量并记录。计算脑梗死比例(%)=(梗死部位质量/全脑质量)×100%。
1.7 TUNEL染色测定神经细胞凋亡按照罗氏公司TUNEL细胞凋亡检测程序染色,具体过程如下:石蜡切片烤片,二甲苯脱蜡;梯度乙醇水化后,Proteinase K工作液37 ℃处理组织20 min,磷酸盐缓冲液(PBS)漂洗3次;加入TUNEL反应混合液,孵育1 h后PBS洗3次;待玻片干后,加50 μL Converter POD,37 ℃避光30 min,PBS洗3次;在组织处加入100 μL新鲜配置的DAB底物,显微镜下观察随时终止反应。PBS洗3次后用苏木素复染,几秒后立即用蒸馏水冲洗。梯度乙醇脱水,二甲苯透明,中性树胶封片。烘箱烤片2 h,进行镜检,采集图片。
1.8 免疫印迹法检测Bax、Bcl-2蛋白表达将海马组织切成小块,加入裂解液裂解细胞提取总蛋白,考马斯亮蓝法测定样本蛋白含量。SDS-PAGE分离蛋白后半干法转移到PVDF膜上,封闭1 h,分别加入一抗Bax(1:300)、Bcl-2(1:300)、β-actin(1:800),4 ℃摇床孵育过夜,次日用1×TBST洗膜3次(10分/次),洗净未结合的一抗。加入二抗室温避光摇床孵育60 min,1×TBST洗膜3次(10分/次),洗去游离二抗。曝光及洗片,用Image J软件分析灰度值。以Bax、Bcl-2灰度值与β-actin灰度值的比值反映Bax、Bcl-2蛋白表达水平。
1.9 统计学分析采用SPSS 18.0软件进行统计学分析,计量资料以均数±标准差(x±s)表示,多组组间比较用单因素方差分析,组间两两比较采用LSD法,P<0.05表示差异有统计学意义。
2 结果 2.1 各组大鼠横木行走实验评分与前肢握力测定结果见表 1。与假手术组比较,模型组大鼠横木行走实验评分升高,前肢握力下降(P<0.01);与模型组比较,尼莫地平组与复方红景天高、低剂量组大鼠横木行走实验评分降低,前肢握力增强(P<0.01,P<0.05)。
| 组别 | 动物数 | 剂量 | 横木行走实验评分 | 前肢握力(g) |
| 假手术组 | 10 | 0.00±0.00 | 1 560.20± 73.05 | |
| 模型组 | 10 | 4.15±0.62* | 715.67± 85.13* | |
| 尼莫地平组 | 10 | 0.012 g/kg | 2.35±0.57## | 1 278.95± 94.80## |
| 复方红景天高剂量组 | 10 | 2.62 g生药/kg | 2.95±0.70## | 1 075.47±143.16## |
| 复方红景天低剂量组 | 10 | 1.31 g生药/kg | 3.25±0.81# | 938.85±135.27# |
| 注:与假手术组相比,*P<0.01;与模型组相比,#P<0.05,##P<0.01。 | ||||
如图 1所示,与假手术组相比,模型组大鼠脑梗死比例显著增加(P<0.01);与模型组比较,尼莫地平组与复方红景天高、低剂量组大鼠脑梗死比例下降,差异有统计学意义(P<0.01,P<0.05)。

|
|
图 1 复方红景天对大鼠脑梗死面积的影响
Fig. 1 Effect of Compound Rhodiola on rat the proportion of cerebral ischemia
A假手术组,B模型组,C尼莫地平组,D复方红景天高剂量组,E复方红景天低剂量组 左图为TTC染色图;右图为各组大鼠脑梗死比例柱状图,与假手术组相比,*P<0.01;与模型组相比,#P<0.05,##P<0.01 |
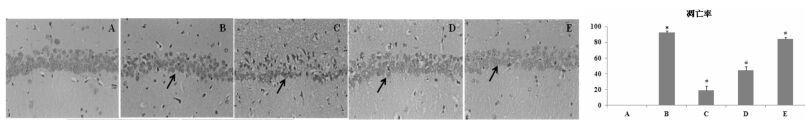
如图 2所示,凋亡阳性细胞被染为棕黄色。与假手术组相比,模型组大鼠海马组织神经细胞凋亡率明显升高;与模型组比较,尼莫地平组与复方红景天高、低剂量组均能降低大鼠海马组织神经细胞凋亡率,差异有统计学意义(P<0.01)。结果见图 2。
|
|
图 2 复方红景天对大鼠海马组织神经细胞凋亡的影响
Fig. 2 Effect of Compound Rhodiola on apoptosis rate of neurons from rat hippocampus tissue
A假手术组,B模型组,C尼莫地平组,D复方红景天高剂量组,E复方红景天低剂量组 左图为TUNEL染色图(×400,箭头所指为凋亡阳性细胞);右图为各组大鼠神经细胞凋亡率的柱状图,与假手术组相比,*P<0.01; 与模型组相比,#P<0.01 |
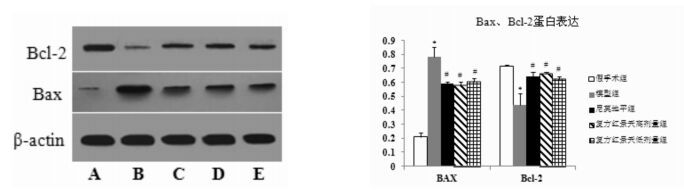
如图 3所示,与假手术组比较,模型组大鼠海马组织Bax蛋白表达升高,Bcl-2蛋白表达降低(P<0.01);与模型组比较,尼莫地平组与复方红景天高、低剂量组大鼠海马组织Bax蛋白表达明显下降,Bcl-2蛋白表达显著增多(P<0.05)。
|
|
图 3 复方红景天对大鼠海马组织Bax、Bcl-2蛋白表达的影响
Fig. 3 Effect of Compound Rhodiola on the expression of Bax and Bcl-2 of rat hippocampus tissue
A假手术组,B模型组,C尼莫地平组,D复方红景天高剂量组,E复方红景天低剂量组 左图为免疫印迹检测结果;右图为各组大鼠海马组织Bax、Bcl-2蛋白表达的柱状图,与假手术组相比,*P<0.01;与模型组相比,#P<0.05 |
缺血性脑损伤属中医学“中风”的范畴,多为气虚血滞、脉络瘀阻所致。由于气虚不能运血,气不能行,血不能荣,以致气血瘀滞于脉络,致使肢体偏瘫。以此为出发点,天津市医药科学研究所制剂中心选用红景天、川芎、延胡索、冰片制成复方红景天。红景天味甘、性寒,归脾、肺经。在此方中益气活血,可有效的改善血液循环,用于气虚血瘀,脑脉瘀阻所致中风头痛,口舌歪斜,语言謇涩之证有良好的益气活血,化瘀通络之功[6]。川芎味辛,性温,归肝、胆、心包经。川芎功善行气活血,祛风通络[7-9]。红景天与川芎合用可以行气活血、疏通脉络,开明清窍,共奏熄风止痉,益气活血,化痰通络之效,共为方中君药。延胡索味辛、苦,温,归肝、脾经,具有活血散瘀,行气止痛的功效[10-11]。冰片清香宣散,通诸窍、散郁火,性善走窜,启发壅闭,开达诸窍,无往不通。用于闭证神昏,有开窍醒神之功[12]。此方行气且又益气,保证了气机的条达通畅,同时活血散瘀,保证了血脉的运流通畅。本研究发现,复方红景天能够明显降低大鼠横木行走实验评分、增加前肢握力,降低脑梗死的比例,对缺血性脑损伤具有明显保护作用。
近年来,细胞凋亡在缺血性脑损伤中的作用日益受重视[13-15]。研究发现,无论是急性的局灶性脑缺血,还是短暂性缺血后的迟发性神经元死亡,都有神经细胞凋亡的参与,且凋亡在迟发型神经元死亡和半暗带的扩大中具有重要作用[16]。因此,在脑缺血早期进行抗凋亡治疗意义显著。
本实验通过检测大鼠海马组织神经细胞凋亡情况来探讨复方红景天在缺血发生后对神经细胞的保护作用。TUNEL染色结果显示,模型组大鼠海马神经细胞凋亡率较假手术组显著增大,证实脑缺血引发细胞损伤过程中,细胞凋亡确实是一种重要损伤形式;复方红景天高、低剂量组大鼠海马神经细胞凋亡率明显低于模型组,提示复方红景天可以明显降低脑缺血损伤后神经细胞的凋亡。
细胞凋亡主要有两条途径,凋亡受体途径及线粒体途径。Bax蛋白和Bcl-2蛋白是线粒体凋亡途径的重要调控蛋白,Bax蛋白能在线粒体膜上形成孔道,使细胞色素C等小分子物质进入胞质从而促进凋亡的发生,Bcl-2蛋白能通过封闭孔道,调控线粒体膜电位等方式抑制凋亡。本实验选用免疫印迹技术对Bax蛋白和Bcl-2蛋白的表达进行研究,检测结果显示,复方红景天高、低剂量组均能显著降低模型大鼠梗死侧海马组织促凋亡蛋白Bax表达,升高抑凋亡蛋白Bcl-2表达,提示复方红景天抗凋亡作用与抑制线粒体凋亡途径有关。
| [1] | Kulik T, Kusano Y, Aronhime S, et al. Regulation of cerebral vasculature in normal and ischemic brain[J]. Neuropharmacol, 2008, 55 (3): 281–8. DOI:10.1016/j.neuropharm.2008.04.017 |
| [2] | 任非非, 刘敬霞. 中医药调控脑源性神经营养因子保护脑缺血再灌注损伤的研究进展[J]. 中华中医药杂志, 2014, 29 (12): 3883–3888. |
| [3] | 尚远宏, 徐晓玉. 中药及其提取物对脑缺血保护作用的实验研究进展[J]. 中国中药杂志, 2013, 38 (8): 1109–1115. |
| [4] | Longa EZ, Weinstein PR, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20 (1): 84–91. DOI:10.1161/01.STR.20.1.84 |
| [5] | 翟小虎, 王斌, 宋亚刚, 等. 线栓法制备大鼠脑缺血模型的研究进展与思路[J]. 实验动物科学, 2015, 32 (5): 55–58. |
| [6] | 王景叶, 于榕, 姚明辉. 红景天苷对缺血再灌注大鼠脑组织损伤的保护作用[J]. 中华中医药杂志, 2010, 25 (3): 456–459. |
| [7] | 杨彭. 川芎类治疗急性缺血性脑卒中的系统评价[D]. 南宁: 广西医科大学, 2008. |
| [8] | 宋向岗, 周威, 陈超, 等. 基于分子对接方法的川芎治疗脑缺血的物质基础及分子机制研究[J]. 中国中药杂志, 2015, 40 (11): 2195–2198. |
| [9] | 高宗桂. 川芎嗪干预大鼠缺血性中风作用及其机制的研究[D]. 北京: 北京中医药大学, 2014. |
| [10] | 贺凯, 高建莉, 赵光树. 延胡索化学成分、药理作用及质量控制研究进展[J]. 中草药, 2007, 38 (12): 1909–1912. DOI:10.3321/j.issn:0253-2670.2007.12.050 |
| [11] | 梁健, 郑平香, 梁京生. 延胡索乙素对大鼠局灶性脑缺血再灌注损伤的保护作用[J]. 中国药理学通报, 1998, 14 (5): 413–415. |
| [12] | 黄萍, 吴清和, 荣向路, 等. 冰片与川芎配伍对脑缺血再灌注损伤的保护作用[J]. 广州中医药大学学报, 2000, 17 (4): 323–326. |
| [13] | Liu J, Li J, Yang Y, et al. Neuronal apoptosis in cerebral ischemia/reperfusion area following electrical stimulation of fastigial nucleus[J]. Neural Regen Res, 2014, 9 (7): 727–734. DOI:10.4103/1673-5374.131577 |
| [14] | 孙梦雅, 崔凯洁, 王雯雯, 等. Bax-抑制肽对新生鼠缺氧缺血性脑损伤神经细胞凋亡的抑制作用[J]. 中国新生儿科杂志, 2015, 30 (5): 372–376. |
| [15] | 李世平, 董梅, 郭彦芳, 等. NBP对器官型脑片糖氧剥夺模型中细胞凋亡的影响[J]. 中风与神经疾病杂志, 2016, 33 (1): 4–8. |
| [16] | 赵秀芹, 毛文静, 李世英, 等. 丁苯酞对局灶性脑缺血再灌注大鼠海马CA1区神经细胞凋亡、SIRT1及PGC-1α表达的影响[J]. 中国动脉硬化杂志, 2016, 24 (8): 774–780. |
 2017, Vol. 34
2017, Vol. 34