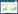文章信息
- 华丹丹, 李沛霖, 王建玲, 王月玲, 李洁, 赵志梅
- HUA Dan-dan, LI Pei-lin, WANG Jian-ling, WANG Yue-ling, LI Jie, ZHAO Zhi-mei
- 妇科灌肠Ⅱ号对子宫内膜细胞凋亡率的影响
- Effect of Fuke Guanchang Ⅱ on apoptosis rate of endometrial cells
- 天津中医药, 2017, 34(8): 562-564
- Tianjin Journal of Traditional Chinese Medicine, 2017, 34(8): 562-564
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.08.18
-
文章历史
- 收稿日期: 2017-03-24
2. 天津中医药大学第二附属医院, 天津 300150;
3. 天津中医药大学第一附属医院, 天津 300193
子宫内膜异位症(EMS),简称内异症,是指子宫内膜在子宫腔以外的部位出现、生长、浸润、周期性出血,引发疼痛、不孕及结节包块等。其在育龄妇女中发病率高达10%,其中50%合并不孕[1],严重影响女性的身体健康和生活质量。EMS的病因病机尚未完全阐明。目前,Sampson的“经血逆流学说”是EMS发病学说的主导理论, 事实上,80%的女性存在着经血逆流现象,而只有10%发生EMS,由此可见,经血逆流学说并不能完全解释EMS发病机制。国内学者郎景和教授提出的“在位内膜决定论”,对经血逆流学说进行了很好的补充说明。1948年Markee通过观察恒河猴月经发生前,子宫内膜螺旋动脉出现痉挛收缩,推测月经期子宫内膜处于缺血、缺氧状态[2]。1976年Maas通过猕猴实验发现输卵管除了在排卵期,其余时间接近无氧状态[3]。由此可见,子宫内膜在发生异位时,必定经过局部缺血缺氧的变化。
1 实验材料 1.1 主要仪器CO2恒温培养箱(德国,Thermo公司),低温高速离心机(美国,Beckman),三气培养箱(美国,Thermo公司),倒置荧光显微镜(日本,OLYNPUS公司),流式细胞仪(美国,BD公司),光学显微镜(日本,OLYNPUS公司)。
1.2 主要试剂DMEM/F12(美国,Corning公司),鼠抗人角蛋白(Cytokeratin)抗体、波形蛋白(Vimentin)抗体(英国,Abcam公司),Annexin V/PI试剂盒(天津,三箭公司)。
2 实验方法 2.1 标本来源选择天津中医药大学第二附属医院手术治疗的EMS患者6例,子宫肌瘤患者8例,入选患者均为25~45岁,月经周期规律,无其他免疫、内分泌或代谢性疾病,术前6个月内未应用过激素类或抗炎类药物。术中取在位内膜于4 ℃无菌磷酸盐缓冲液(PBS)中保存,1 h内带回实验室进行处理。
2.2 间质细胞原代培养1)用无菌PBS冲洗子宫内膜组织2~3次,去除血块及黏液。2)用眼科剪将组织剪碎至约1 mm3的微粒(肉眼成糊状)。3)加PBS将组织移入离心管,用PBS洗涤沉淀2次,弃PBS,加入1:1的0.1%的Ι型胶原酶和0.25%的胰蛋白酶,消化液的体积为组织的2~4倍。混匀后置于37 ℃温箱中消化45~60 min,每10 min摇晃1次离心管。用含10%胎牛血清(FBS)的DMEM/F12培养液终止消化。4)用100目的筛网滤除未消化组织,再将细胞悬液滤过400目筛网分离子宫内膜间质细胞和腺上皮细胞。5)将滤过的细胞悬液离心漂洗1 000 r/min离心5 min。6)弃上清液,用5 mL完全培养基DMEM/F12重悬细胞,反复吹打后种于培养瓶中,于37 ℃,5%CO2条件下培养。24 h后间质细胞贴壁。7)每2天换液1次,每天观察细胞生长情况。当细胞铺满瓶底80%~90%以后进行传代。
2.3 细胞的鉴定原代细胞消化传代2次后,细胞形态规则,以105个/mL的密度种于96孔板,进行细胞免疫荧光染色鉴定,间质细胞应用Vimentin抗体进行免疫荧光染色鉴定,PBS代替一抗作为阴性对照。见图 1。
|
| 图 1 子宫内膜间质细胞鉴定 Fig. 1 Assessment of endometrial stromal cells |
取第3代间质细胞,消化后以2×105/mL的密度种于12孔板,培养24 h。弃原培养基,PBS洗1遍,加DMEM/F12基培。根据间质细胞来源子宫肌瘤和EMS患者分为5组:常氧对照组、常氧EMS组、缺氧对照组、缺氧EMS组、中药+缺氧EMS组。每组设3个复孔。常氧处理:细胞置于5%CO2的细胞培养箱培养。缺氧处理:将细胞培养板放入94%N2+5%CO2+1%O2的3气培养箱缺氧干预24 h后,收集各组细胞,使用冷的PBS洗细胞2次,再用1×Binding Buffer制成1×106/mL的细胞悬液。固定的死细胞行PBS清洗1次。在1.5 mL的培养管中加入100 μL细胞悬液(约1×105个细胞)。加入5 μL的Annexin V-FITC,轻轻混匀,室温避光处放置15 min,再加入5 μL PI,轻轻混匀,室温避光处放置10 min。各试验管中分别加入1×Binding Buffer缓冲液400 μL,混匀后置于冰上,1 h内上流式细胞仪测定结果。
3 统计学处理用SPSS 19.0统计软件进行处理,计量资料以均数±标准差(x±s)表示。多组间比较采用单因素方差分析,组间两两比较采用Dunnett’s T3法,P<0.05为差异有统计学意义。
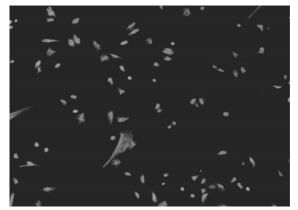
4 结果双变量流式细胞仪的散点图上,左上象限为坏死细胞DNA碎片(FITC-/PI+);左下象限显示活细胞,为(FITC-/PI-);右上象限是坏死细胞或陈旧性凋亡细胞,为(FITC+/PI+),而右下象限为凋亡细胞,显现(FITC+/PI-)。5个实验组凋亡率分别为:常氧对照组(4.20±1.42)%、常氧EMS组(2.93±0.81)%、缺氧对照组(12.53±1.67)%、缺氧EMS组(8.13±0.06)%、中药+缺氧ENS组(10.67±2.51)%。本实验结果表明,在相同氧浓度下比较EMS组及对照组细胞凋亡情况,常氧EMS组凋亡率低于常氧对照组(P>0.05),缺氧EMS组凋亡率低于缺氧对照组(P<0.05);比较不同氧浓度对于培养细胞的影响,缺氧对照组凋亡率高于常氧对照组(P<0.01),缺氧ENS组凋亡率高于常氧ENS组(P<0.01);中药+缺氧EMS组凋亡率高于缺氧EMS组(P>0.05),见表 1,图 2。
|
| 图 2 流式细胞仪检测缺氧培养后细胞凋亡情况 Fig. 2 Condition of apoptosis after an erobic cultivation detective by flow cytometer A:常氧对照组;B:常氧EMS组;C:缺氧对照组;D:缺氧EMS组;E中药+缺氯EMS组 |
| 组别 | 凋亡率(%) |
| 常氧对照组 | 4.20±1.42** |
| 常氧EMS组 | 2.93±0.81# |
| 缺氧对照组 | 12.53±1.67 |
| 缺氧EMS组 | 8.13±0.06* |
| 中药+缺氧EMS组 | 10.67±2.51 |
| 注:与缺氧对照组比较,*P<0.05,**P<0.01;与缺氧EMS组比较,#P<0.01。 | |
缺氧是把双刃剑,缺氧可以促进随经血逆流的子宫内膜细胞凋亡,亦可以导致机体细胞免疫反应下降,不能完全吞噬清除病灶细胞。经过缺氧选择,残存的内膜细胞可能黏附侵入输卵管、卵巢、盆腔、腹膜等处,种植生成异位病灶。缺氧可使缺氧诱导因子-1(HIF-1)大量聚集。HIF-1是由α和β 2个亚基组成的异源二聚体,其中HIF-1α能决定HIF-1的活性和氧分子调节[4]。有研究[5]报道,HIF-1α可以激活多种抗凋亡基因,包括血管内皮生长因子(VEGF)、B淋巴细胞癌-2基因(BCL-2)和Caspase 3等,抑制诱导细胞凋亡的信号,从而阻止细胞凋亡。其中VEGF是目前公认的、最强的促血管生成因子,在缺氧的条件下它与促红细胞生长素(EPO)之间存在正相关,共同促进血管生成[6]。Wnt/β-catenin信号通路是调控细胞生长和增殖的关键途径,Jolly Mazumdar等人研究发现在胚胎干细胞中HIF-1α可以增强β-catenin的活性[7],β-catenin是关键的转录激活剂并传输细胞外信号以激活靶基因[8],在Wnt信号通路激活过程中起关键作用[9]。
中医传统理论认为EMS属于“痛经”、“癥瘕”范畴,著名中医妇科专家韩冰教授提出“气、血、痰”是EMS的3个关键因素,其病机为瘀久夹痰,渐成癥瘕,因此治疗多以活血化瘀、温经通络、散结止痛为主。韩冰教授临床经验方妇科灌肠Ⅱ号(丹参、三棱、莪术各30 g,乳香、没药各20 g,水红花子50 g)治疗EMS取得较好的临床疗效,不仅能明显改善症状和体征,且不良反应小。本实验发现缺氧组细胞凋亡率明显高于常氧组,说明缺氧可以促进随经血逆流的子宫内膜细胞凋亡;而缺氧EMS组细胞的凋亡率明显低于缺氧对照组细胞,说明EMS组在位内膜与对照组内膜存在本质差别,EMS在位内膜在缺氧环境中具有较强的抗凋亡能力。妇科灌肠Ⅱ号干预后,在位内膜的凋亡率升高,但无统计学意义,这可能是妇科灌肠Ⅱ号使局部缺氧环境得到改善,既影响了HIF-1α的表达,又使异位的内膜细胞得到了生长的机会。通过本实验可以认识到缺氧在EMS发生发展中的关键作用,但妇科灌肠Ⅱ号是如何起到治疗作用的,还需进一步研究。
| [1] | Holoch KJ, Lessey BA. Endometriosis and infertility[J]. Clin Obstet Gynecol, 2010, 53 (2): 429–438. DOI:10.1097/GRF.0b013e3181db7d71 |
| [2] | Markee JE. Morphological basis for menstrual bleeding; relation of regression to the initiation of bleeding[J]. Bull New York Acad Med, 1948, 24 (4): 253–268. |
| [3] | Maas DH, Storey BT, Mastroianni LJ. Oxygen tension in the oviduct of the rhesus monkey (Macaca mulatta)[J]. Fertil Steril, 1976, 27 (11): 1312–1317. DOI:10.1016/S0015-0282(16)42201-6 |
| [4] | Zhou J, Schmid T, Schnitzer S, et al. Tumor hypoxia and cancer progression[J]. Cancer Lett, 2006, 237 (1): 10–21. DOI:10.1016/j.canlet.2005.05.028 |
| [5] | Wang D, Weng Q, Zhang L, et al. VEGF and Bcl-2 interact via MAPKs signaling pathway in the response to hypoxia in neuroblas-toma[J]. Cell Mol Neurobiol, 2009, 29 (3): 391–401. DOI:10.1007/s10571-008-9331-9 |
| [6] | 王桂英, 孙咏梅, 李学军, 等. VEGF和EPO在子宫内膜异位症中表达的相关性研究[J]. 河北医药, 2011, 33 (19): 2925–2926. |
| [7] | Mazumdar J, O, Brien WT, Johnson RS, et al. O2 regulates stem cells through Wnt/p-eatenin signaling[J]. Nat Cell Biol, 2010, 12 (10): 1007–1013. DOI:10.1038/ncb2102 |
| [8] | KIM W, KIM M, JHO EH. Wnt/β-catenin signalling:from plasma membrane to nucleus[J]. Biochem J, 2013, 450 (1): 9–21. DOI:10.1042/BJ20121284 |
| [9] | Brembeck FH, Rosario M, Birchmeier W. Balancing cell ad-hesion and Wnt signaling, the key role of β-catenin[J]. Curr Opin Genet Dev, 2006, 16 (1): 51–59. DOI:10.1016/j.gde.2005.12.007 |
2. The Second Affiliated Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300150, China;
3. The First Affiliated Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China
 2017, Vol. 34
2017, Vol. 34