文章信息
- 陈笑南, 黎丹奇, 赵梦迪, 杜守颖, 陆洋, 李鹏跃
- CHEN Xiao-nan, LI Dan-qi, ZHAO Meng-di, DU Shou-ying, LU Yang, LI Peng-yue
- 复方丹参片剂与黏附微丸体外释放对比研究
- Studies on differences between Fufang Danshen tablets and Fufang Danshen adhesion pellets release in vitro
- 天津中医药, 2017, 34(8): 565-569
- Tianjin Journal of Traditional Chinese Medicine, 2017, 34(8): 565-569
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.08.19
-
文章历史
- 收稿日期: 2017-04-24
复方丹参制剂由丹参、三七、冰片配伍而成,治疗瘀血痹阻型冠心病疗效突出[1]。复方丹参片中各成分在溶解性和黏膜透过性上有较大差异,严重影响生物利用度。为提高制剂生物利用度,本课题组将剂型改进为复方丹参黏附微丸,经前期考察,卡波姆934P、壳聚糖和羟丙基甲基纤维素(HPMC K100M)为最终确定黏附材料[2]。剂型改变后以体外溶出实验对其进行评价,方中冰片的体外溶出结果表明冰片在黏附微丸中表现为缓释作用[3],基于前期实验基础,本实验对方中丹参和三七中有效成分进行体外溶出考察。
1 材料LC-20AD型高效液相色谱仪(PDA检测器,日本岛津公司);Agilent 1260高效液相色谱仪(美国Agilent公司);Sartorius BS 110S型电子分析天平(北京赛多利斯科学仪器有限公司);KQ5200DA型数控超声波清洗器(昆山市超声仪器有限公司)。
复方丹参黏附微丸(实验室自制);复方丹参片(广州白云山和记黄埔中药有限公司,批号:I4A002);丹酚酸B对照品(中国药品生物制品检定研究院,批号:111562-201212);丹参酮ⅡA对照品(中国药品生物制品检定研究院,批号:110766-200619);三七皂苷R1对照品(中国药品生物制品检定研究院,批号:110745-201318);人参皂苷Rg1对照品(中国药品生物制品检定研究院,批号:110703-201128);人参皂苷Rb1对照品(中国药品生物制品检定研究院,批号:110704-201213);人参皂苷Rd对照品(中国药品生物制品检定研究院,批号:111818-201302);乙腈、甲醇(美国Fisher公司,质谱级/色谱级);甲酸(质谱级,ROE公司);纯净水(杭州娃哈哈集团);其余试剂均为分析纯。
2 方法 2.1 黏附微丸中皂苷类成分含量测定分析方法的建立 2.1.1 色谱条件流动相A:水,B:乙腈,梯度洗脱,洗脱梯度见表 1,进样量20 μL,检测波长203 nm,体积流量1.5 mL/min,柱温25 ℃。
| 时间(min) | A(%) | B(%) |
| 0 | 80.4 | 19.6 |
| 30 | 80.4 | 19.6 |
| 60 | 61.0 | 39.0 |
| 63 | 61.0 | 39.0 |
| 70 | 40.0 | 60.0 |
精密称取25.24 mg三七总皂苷对照品,置于25 mL量瓶中,加甲醇配制成三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1、人参皂苷Rd浓度分别为0.070、0.283、0.300、0.074 mg/mL的对照品贮备液。
2.1.3 供试品溶液的制备微丸研细过80目筛,精密称取粉末0.3 g置于量瓶中,精密移取甲醇25 mL,称定质量,超声1 h,放冷,补足失重,取上清液过0.45 μm滤膜,注入高效液相色谱仪。
2.1.4 线性关系考察精密移取对照品贮备液适量于量瓶中,加甲醇配置成一系列浓度的对照品溶液,以浓度为横坐标,以峰面积为纵坐标,绘制标准曲线并进行回归,三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1、人参皂苷Rd回归方程分别为: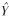
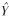
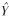
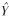
取三七总皂苷对照品溶液进样,测定峰面积,连续测定6次,三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1、人参皂苷Rd的精密度RSD值分别为1.5%、1.7%、1.8%、1.4%,说明仪器精密度良好。
2.1.6 重复性考察称取微丸粉末(过80目筛)约0.3 g,精密称定,按2.1.2项下处理,平行操作6份,分别进样,三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1、人参皂苷Rd的RSD分别为1.12%、1.76%、1.03%、1.35%,符合要求。
2.1.7 稳定性考察取供试品溶液进样,分别测定0、2、4、6、8、10、12 h时供试品峰面积,三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1、人参皂苷Rd的稳定性RSD值分别为1.5%、1.0%、0.7%、1.1%,说明供试品溶液中各成分稳定性良好。
2.1.8 加样回收率考察取已测定含量的微丸粉末(过80目筛)0.15 g,精密称定,各精密加入三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1、人参皂苷Rd对照品溶液,加适量甲醇,按供试品溶液的制备操作,测定含量。得到这4种成分的回收率为98.16%、98.66%、95.49%、97.26%,RSD分别为1.44%、2.95%、0.76%、1.38%,符合要求。
2.2 黏附微丸中丹酚酸B含量测定分析方法的建立 2.2.1 色谱条件流动相为乙腈-甲醇-甲酸-水(10:30:1:59);检测波长286 nm;体积流量1.0 mL/min;柱温25 ℃;进样量10 μL。
2.2.2 对照品溶液的制备精密称取5.43 mg丹酚酸B对照品,置于25 mL量瓶中,加甲醇配制成0.217 2 mg/mL对照品贮备液。
2.2.3 供试品溶液的制备微丸研细过80目筛,精密称取粉末0.15 g置于量瓶中,精密移取甲醇25 mL,称定质量,超声30 min,放冷,补足失重,取上清液过0.45 μm滤膜,注入高效液相色谱仪。
2.2.4 线性关系考察精密移取对照品贮备液适量于量瓶中,加甲醇配置成一系列浓度的丹酚酸B对照品溶液,以丹酚酸B的浓度为横坐标,以丹酚酸B峰面积为纵坐标,绘制标准曲线并进行回归,丹酚酸B回归方程为: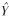
取丹酚酸B对照品溶液进样,测定丹酚酸B峰面积,连续测定6次,丹酚酸B的精密度RSD值为0.69%,说明仪器精密度良好。
2.2.6 稳定性考察取丹酚酸B供试品溶液进样,测定丹酚酸B峰面积,分别测定0、2、4、6、8、10、12 h时供试品峰面积,丹酚酸B的稳定性RSD值为0.79%,说明供试品溶液中丹酚酸B稳定性良好。RSD值为0.79%,说明丹酚酸B在甲醇中12 h稳定。
2.2.7 重复性考察称取微丸粉末(过80目筛)约0.15 g,精密称定,按“2.2.2供试品溶液制备”处理,平行操作6份,分别进样。RSD为0.79%,符合要求。
2.2.8 加样回收率考察取已测定含量的微丸粉末(过80目筛)0.075 g,精密称定,各精密加入丹酚酸B对照品溶液,按供试品溶液的制备操作,测定回收率分别为102.74%、103.98%、101.79%、99.99%、99.36%、99.37%,RSD1.91%,回收率符合要求。
2.3 黏附微丸中丹参酮ⅡA含量测定分析方法的建立 2.3.1 丹参酮ⅡA色谱条件流动相为甲醇-水(85:15);检测波长270 nm;体积流量1.0 mL/min;柱温25 ℃;进样量10 μL。
2.3.2 对照品溶液的制备精密称取9.35 mg丹参酮ⅡA对照品,置于25 mL量瓶中,加甲醇配制成0.374 mg/mL对照品贮备液。
2.3.3 供试品溶液的制备微丸研细过80目筛,精密称取粉末1 g置于量瓶中,精密移取甲醇25 mL,称定质量,静置30 min,超声30 min,放冷,补足失重,取上清液过0.45 μm滤膜,注入高效液相色谱仪。
2.3.4 线性关系考察精密移取对照品贮备液适量于量瓶中,加甲醇配置成一系列浓度的丹参酮ⅡA对照品溶液,以丹参酮ⅡA的浓度为横坐标,以丹参酮ⅡA峰面积为纵坐标,绘制标准曲线并进行回归,丹参酮ⅡA回归方程为: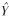
取丹参酮ⅡA对照品溶液进样,测定丹参酮ⅡA峰面积,连续测定6次,丹参酮ⅡA的精密度RSD值为0.05%,说明仪器精密度良好。
2.3.6 稳定性考察取丹参酮ⅡA供试品溶液进样,测定丹参酮ⅡA峰面积,分别测定0、2、4、6、8、10、12 h时供试品峰面积,丹参酮ⅡA的稳定性RSD值为0.80%,说明供试品溶液中丹参酮ⅡA稳定性良好。
2.3.7 重复性考察称取微丸粉末(过80目筛)约1 g,精密称定,按“2.3.3供试品溶液的制备”处理,平行操作6份,分别进样,丹参酮ⅡA重复性RSD 1.85%,符合要求。
2.3.8 加样回收率考察取已测定含量的微丸粉末(过80目筛)0.5 g,精密称定,各精密加入丹参酮ⅡA对照品溶液,加适量甲醇,按供试品溶液的制备操作,测得回收率分别为95.95%、96.17%、97.35%、96.50%、97.58%、98.58%,RSD 1.03%,回收率符合要求。
2.4 复方丹参片与复方丹参黏附微丸中各成分含量测定采用“2.1、2.2、2.3”项中建立的方法对复方丹参黏附微丸中六种成分的含量进行测定,复方丹参片中丹酚酸B、丹参酮ⅡA的含量采用2015年版《中国药典》中复方丹参片含量测定项下的方法测定;三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1、人参皂苷Rd的含量采用复方丹参黏附微丸中相应成分的含量测定方法测定。见表 2。
| 成分 | 复方丹参片(mg/g) | 复方丹参黏附微丸(mg/g) |
| 三七皂苷R1 | 2.19 | 4.02 |
| 人参皂苷Rg1 | 8.73 | 22.31 |
| 人参皂苷Rb1 | 7.69 | 14.33 |
| 人参皂苷Rd | 1.56 | 3.29 |
| 丹酚酸B | 21.70 | 17.41 |
| 丹参酮ⅡA | 1.17 | 0.34 |
采用2015年版《中国药典》四部[通则0931]溶出度与释放度测定法第一法测定[4],取复方丹参微丸0.8 g(相当于生药材1.2 g),溶出介质体积为500 mL,转速为100 r/min,温度37 ℃。分别在60、90、120、180、240、360、480、600、720 min取样1 mL,0.45 μm滤膜过滤,每次取样后补加同体积同温度的溶出介质,高效液相色谱(HPLC)测定各成分峰面积,计算累积溶出度,绘制溶出度曲线。
 |
式中:Qn为第n点的累积含量(mg);Cn为第n点测得的药物质量浓度(mg/mL);Ci为第i(i≤n-1)个取样点测得的接受液中药物质量浓度。
2.5.2 复方丹参片累计溶出度测定同法取复方丹参片2片,按2.5.1项下方法操作,在60、90、120、180、240、360、480、600、720 min取样1 mL,进样,计算各成分的累积溶出度。绘制曲线并与复方丹参黏附微丸比较。两种制剂累计溶出度曲线比较结果见图 1。
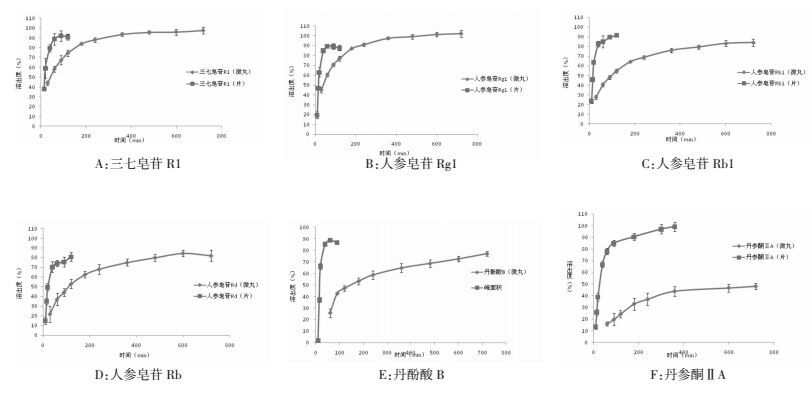
|
| 图 1 各种成分的溶出曲线 Fig. 1 Dissolution of each component |
对黏附微丸中6种成分的溶出曲线分别进行零级方程、一级方程、Higuchi方程、Hix-crowll方程、Peppas方程、Weibull方程、Neibergull方程等释药模型的拟合。6种成分的最佳拟合结果如表 3。
| 成分 | 最佳拟合方程 | 方程 | 相关系数R |
| 丹酚酸B | 一级动力学方程 | ln(100-Q)=-0.001 5t+4.214 7 | 0.973 0 |
| 丹参酮ⅡA | Peppas | lnQ=0.440 6lnt+1.100 7 | 0.972 2 |
| 三七皂苷R1 | 一级动力学方程 | ln(100-Q)=-0.004 3t+3.793 6 | 0.970 9 |
| 人参皂苷Rg1 | 一级动力学方程 | ln(100-Q)=-0.009t+4.243 | 0.999 0 |
| 人参皂苷Rb1 | Peppas | lnQ=0.339lnt+2.304 3 | 0.976 0 |
| 人参皂苷Rd | Peppas | lnQ=0.398 8lnt+1.942 1 | 0.964 7 |
复方丹参制剂中丹参为君药,活血化瘀之良药,具有活血调经、祛瘀止痛、凉血消痈、清心除烦等功效[5],主要成分为以丹酚酸B为代表的酚酸类成分和以丹参酮ⅡA为代表的二萜醌类化合物。两类成分在溶解、吸收方面存在一定的差异:小肠上端是丹酚酸B为主的酚酸类成分为主要吸收部位,但吸收差[6],丹参酮类属于脂溶性成分,存在溶出困难;三七为臣药,功效活血祛瘀,止血,消肿止痛[7],主要成分为皂苷类成分,具有酸不稳定性,致使其在胃中易降解。生物利用度低,长期服用伴随有轻度不良反应等问题阻碍了临床应用[8]。参阅文献,党云杰等[9]选择卡波姆和壳聚糖为黏附材料制备了斑蝥素缓释片比格犬经口服后生物利用度较普通制剂明显提高。葛根总黄酮与卡波姆和羟丙基甲基纤维素以一定比例制备成黏附制剂后研究发现生物利用度亦较普通片剂有明显提高[10]。本课题组在现有剂型的基础上筛选出3种黏附材料制备出复方丹参黏附微丸。微丸可增加药物在胃肠道表面的分布面积,黏附材料因其可在体内形成凝胶,因此可使得药物在胃肠道滞留时间延长,从而达到提高生物利用度的目的[11],对剂型改进后的药物进行评价可从体内和体外两个方面,体外溶出度实验时模拟固体制剂在胃肠道过程的理想方法,以复方丹参片为参比制剂对处方中丹参和三七中6种成分进行体外释放研究,绘制累积溶出曲线并进行方程拟合,具体数学方程式如下[12]:
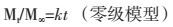 |
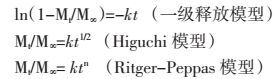 |
在上述模型中,Mt(mg)为t时间的累积释放量,M∞(mg)为最大药物累积释放量,Mt/M∞为t时累积释放率。k为药物释放的速率常数,n为释放参数,Peppas公式中,对于微丸这类圆球型制剂,当n≤0.43时,药物释放机制为Fickian扩散;0.43<n<0.89时,药物释放机制为non-Fickian扩散,即扩散与骨架溶蚀机制相结合;当n ≥ 0.89时,药物释放机制为骨架溶蚀。分析最佳拟合结果,丹酚酸B、三七皂苷R1、人参皂苷Rg1为一级动力学方程即这3种成分释药机制是以扩散为主,人参皂苷Rb1和人参皂苷Rd为Fickian扩散为主,脂溶性成分丹参酮ⅡA则为扩散与骨架溶蚀机制相结合,不同成分释药机制的差异可能与成分本身的溶解性及与黏附材料的相互作用大小有关,丹酚酸B属于水溶性的酚酸类成分,三七皂苷R1和人参皂苷Rg1属于原人参三醇型皂苷类,Rb1和Rd属于二醇型类[13]。两种类型皂苷类成分在溶解性上有所差异,但各成分的释药机制原因仍有待进一步研究。
制剂的评价分体内和体外两大方向,课题组选择模拟体内环境进行了体外溶出实验,从绘制出的6种成分分别在复方丹参片和复方丹参黏附微丸中累计溶出度曲线可以看出复方丹参黏附微丸可实现三七和丹参中6种成分缓释的效果,延长了药物在体内的滞留时间,可以减少服药次数并减小药物在体内突释而达到中毒剂量的危险,增加用药安全性。黏附微丸的黏附性能课题组前期已对其进行了系统的评价[14],方中3味药物相比于普通片剂生物利用度是否有所提高,冰片的刺激性是否有所减小等体内评价还待进一步实验数据的考察。因此,综合考察复方丹参黏附微丸与市售复方丹参片在体内药物动力学的差异可进一步开展实验进行研究,与6种成分体外溶出行为对应比较,对黏附微丸的缓释作用作完整评价,中药黏附制剂体内外相关性评价多局限于单成分的研究,这也是对课题组所研究的复方丹参黏附微丸后续研究提出的新要求,可以对多成分多指标体内外相关性进行系统研究,并以片剂为参比对黏附微丸作全面评价[15]。
| [1] | 郑晓辉, 赵欣, 房敏峰, 等. 复方丹参方中使药冰片对君药丹参药代动力学的影响[J]. 西安交通大学学报(医学版), 2007, 28 (2): 170–173. |
| [2] | 赵壮, 杜守颖, 陆洋, 等. 卡波姆等6种生物黏附材料体内外黏附性能评价[J]. 中国药学杂志, 2014, 49 (24): 2188–2192. |
| [3] | 王振, 杜守颖, 陆洋, 等. 复方丹参肠黏附微丸中龙脑含量测定方法的建立及不同剂型龙脑溶出度的研究[J]. 中国中药杂志, 2015, 40 (16): 3194–3199. |
| [4] | 中华人民共和国药典委员会. 中华人民共和国药典(四部)[S]. 北京: 中国医药科技出版社, 2015. |
| [5] | 马丙祥, 董崇凯. 丹参的药理作用研究新进展[J]. 中国药房, 2014, 25 (7): 663–665. DOI:10.6039/j.issn.1001-0408.2014.07.30 |
| [6] | 张英丰, 李玉洁, 杨庆, 等. 大鼠在体单向肠灌流法进行丹参素、丹酚酸B的肠吸收研究[J]. 中国实验方剂学杂志, 2010, 16 (11): 96–100. DOI:10.3969/j.issn.1005-9903.2010.11.030 |
| [7] | 周新惠, 龙丽莉, 李春梅, 等. 生三七与蒸制熟三七部分药理作用的比较[J]. 环球中医药, 2014, 7 (6): 420. |
| [8] | 古维新, 姚育法, 张丽娟. 复方丹参制剂的严重不良反应[J]. 2001, 15(5): 347-348. |
| [9] | 党云洁. 斑蝥素及斑蝥提取物的口服缓释制剂研究[D]. 北京: 中国协和医科大学, 2009. http://med.wanfangdata.com.cn/paper/detail?id=degreepaper_y1495510 |
| [10] | 向大雄. 葛根总黄酮及其生物粘附性缓释片的研制与体内外评价[D]. 长沙: 湖南中医学院, 2002. http://cdmd.cnki.com.cn/Article/CDMD-10541-2002122143.htm |
| [11] | Feng H, Chen W, Zhu C. Pharmacokinetics study of bio-adhesive tablet of Panax notoginseng saponins[J]. International archives of medicine, 2011, 4 (1): 18. DOI:10.1186/1755-7682-4-18 |
| [12] | 高国义, 刘志东, 赵诤. 黄芩苷缓释片的研制及其体外释放度研究[J]. 天津中医药, 2009, 26 (5): 426–428. |
| [13] | 王莹, 禇扬, 李伟, 等. 三七中皂苷成分及其药理作用的研究进展[J]. 中草药, 2015, 46 (9): 1381–1392. DOI:10.7501/j.issn.0253-2670.2015.09.023 |
| [14] | 王振, 陈笑南, 黎丹奇, 等. 不同处方复方丹参黏附微丸黏附性能的评价[J]. 北京中医药大学学报, 2016, 39 (11): 945–948. DOI:10.3969/j.issn.1006-2157.2016.11.011 |
| [15] | 罗裕. 喘平缓释微丸体内外释药物动力学研究[D]. 广州: 广东药学院, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10573-1015007573.htm |
 2017, Vol. 34
2017, Vol. 34