文章信息
- 曲怡, 李阳, 王建波, 张立德
- QU Yi, LI Yang, WANG Jian-bo, ZHANG Li-de
- 补阳还五汤对高血压前期大鼠T淋巴细胞亚群的影响
- Effect of Buyang Huanwu decoction on the T lymphocyte subsets of prehypertension rats
- 天津中医药, 2017, 34(9): 617-620
- Tianjin Journal of Traditional Chinese Medicine, 2017, 34(9): 617-620
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.09.14
-
文章历史
- 收稿日期: 2017-06-25
自从美国高血压预防治疗指南(JNC7)提出“高血压前期”概念后[1],高血压前期逐渐为人们所关注,De Marco等[2]研究发现高血压前期人群4 a后进展至高血压的比例为38%,孙佳艺等[3]对国内35~64岁人群10 a的跟踪调查发现高血压前期进展至高血压的比例为52.6%。基于近年来中国流行病学、临床实践以及对高血压病的研究,以高盐为代表的环境因素已成为高血压前期[血压120~139/80~89 mmHg(1 mmHg=0.133 kPa,下同)]的主要危险因素[4]。因此,在高血压前期进行干预,从调控环境因素入手,将血压防治重心前移,有望成为延缓高血压病发生和发展的一种新手段。
目前,中医还没有关于高血压前期的辨证分型标准和有效的治疗方法,但有调查表明,大部分高血压前期患者已有神疲乏力、四肢困倦、腹胀体胖、少气懒言、头晕目眩、舌淡胖、苔白腻等气虚的症状[5-6], 根据“盐者胜血”的中医理论[7-9],以及中医治未病的思想[10-11],笔者选用具有“补气活血,祛瘀通络”功效的补阳还五汤进行治疗。本实验采用公认的高盐所致高血压作为环境因素诱导的Dahl盐敏感大鼠复制高血压前期模型,研究大鼠血液中T淋巴细胞亚群CD4+和CD8+的比例与肿瘤坏死因子-α(TNF-α)、γ-干扰素(INF-γ)的含量。通过观察T淋巴细胞亚群CD4+与CD8+淋巴细胞比值、TNF-α、INF-γ的含量变化,探讨高血压前期与机体免疫功能相关性,并以期阐释补阳还五汤调节机体T细胞的免疫功能,改善血压高值状态的作用机制。
1 材料与方法 1.1 实验动物选用7周龄雄性盐敏感大鼠(DS)与盐抵抗大鼠(SS),各20只,共40只。许可证编号:SCXK(京)2012-0001,动物由北京维通利华实验动物技术有限公司提供。
1.2 药物与试剂补阳还五汤(黄芪30 g,赤芍4.5 g,川芎3 g,当归6 g,地龙3 g,桃仁3 g,红花3 g),购于辽宁省中医院中药局;大鼠外周血淋巴细胞分离液(天津市灏洋生物制品科技有限责任公司);CD3/CD8/CD4检测试剂盒(美国BD公司BD PharmingenTM);大鼠INF -γ酶联免疫吸附测定(ELISA)试剂盒(上海艾莱萨生物科技有限公司);大鼠TNF-α ELISA试剂盒(上海艾莱萨生物科技有限公司)。
1.3 仪器FACSAria Ⅲ流式细胞仪(美国BD医疗器械有限公司);智能无创血压计(BP-2010A日本);多功能酶标仪(SpectraMax I3奥地利Molecular Devices公司)。
2 方法 2.1 动物分组与造模选取7周龄DS大鼠与SS大鼠各20只,SS大鼠随机分为正常组和正常给药组,DS大鼠随机分为模型组和治疗组。各组大鼠在SPF级动物实验中心以室温18~23 ℃、相对湿度45%~55%、自由饮水、普通饲料(由辽宁本溪长生生物技术有限公司提供)进食的条件下适应性喂养1周后,改用8%氯化钠(NaCl)高盐饲料(由北京科奥协力饲料有限公司提供)喂养。在高盐喂食期间,每日采用大鼠智能无创血压计监测大鼠尾动脉收缩压,12 d后其血压值升高至120~139/80~89 mmHg时,确定为高血压前期大鼠模型。
2.2 干预方法补阳还五汤:黄芪30 g,赤芍4.5 g,川芎3 g,当归6 g,地龙3 g,桃仁3 g,红花3 g,以上为成人1日剂量,共52.5 g。按照每千克体质量大鼠的给药量为人的6.3倍换算,给药量为0.55 g。将补阳还五汤水提浓缩至0.55 g/mL后,装入药瓶中,置于4 ℃冰箱保存备用,用前加热至37 ℃。正常给药组和模型给药组大鼠每天灌胃1次,连续治疗5周。正常组和模型组灌服等量蒸馏水,方法同上。
2.3 标本取材SS和DS大鼠治疗结束后,每组大鼠禁食不禁水12 h后,腹腔注射20%氨基甲酸乙酯溶液,剂量按照0.4 mL/100 g给药,待其完全麻醉后,固定于实验台上,用0.5%碘伏消毒大鼠腹部皮肤,沿腹中线迅速打开腹腔,取腹主动脉新鲜血液2 mL,抽入含有肝素钠的抗凝采血管中,上下反复颠倒8~10次,使血液与肝素钠充分混匀,6 h内采用流式技术上机处理。
2.4 检测方法 2.4.1 流式细胞术检测大鼠全血中CD4+与CD8+的百分率1)血液中单细胞悬液的制备:取12支15 mL离心管,分别加入2 mL大鼠淋巴细胞分离液。将样本血液缓慢加在分离液的液面上,18~22 ℃,1 800 r/min离心15 min。离心后吸出上层分离液(包含淋巴细胞的细胞层),弃去剩余液体。缓慢吸取分离液层及淋巴细胞层置转移至新的5 mL离心管内。加入3 mL细胞洗涤液混匀。1 800 r/min离心15 min,弃上清,再加入3 mL细胞洗涤液重悬所得细胞,1 800 r/min离心15 min,弃上清,重复以上步骤后以0.05 mL磷酸液缓冲液(PBS)后续实验所需相应液体重悬所得细胞。2)样品制备:取12支流式上样管,制备好加完50 μL PBS的单细胞悬浮液并进行编号,分为4组,每组3管样品;依次加入单标记的CD4+、CD8+荧光抗体各20 μL,涡旋均匀。室温避光孵育20 min;每管分别加入2 mL PBS,混合均匀,300 g离心5 min,弃上清;每管再分别加入0.6 mL PBS涡旋混匀,4 ℃避光1 h内上机检测。3)流式细胞术检测T淋巴细胞中CD4+与CD8+的百分率:创建新实验的12个采集管命名;选中采集管,设置参数,仅保留与本实验相关的荧光参数,荧光参数选择对数,散射光参数选择线性,参数均选择A面积信号;调电压,切阈值,设门;调自动补偿;进行检测统计。
2.4.2 ELISA方法检测大鼠血清中TNF-α、INF-γ的含量设置标准品孔和样本孔,配置不同浓度的标准品并向不同标准品孔中加入标准品50 μL,样品孔加入40 μL样品稀释液与10 μL样品即血清,空白孔不加;用封板膜封住反应孔,37 ℃水浴30 min;弃去液体,用洗涤液反复洗涤3次;各孔加入酶标试剂50 μL,37 ℃避光30 min;再次洗涤3次;每孔加入A显色剂50 μL,B显色剂50 μL,37 ℃避光显色15 min;加入终止液50 μL,15 min内在450 nm波长测定各孔OD值;通过标准曲线方程计算样品浓度。
2.5 统计分析采用SPSS 19.0统计软件对实验数据进行分析,全部数据先进行正态性检验及方差齐性检验,再进行单因素方差分析。组间两两比较方差齐采用LSD法分析。结果以均数±标准差(x±s)表示,P<0.05认为有统计学差异。
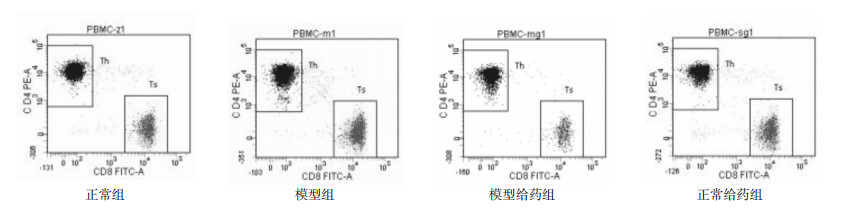
3 实验结果 3.1 各组大鼠全血中CD4+/CD8+的比值与正常组相比,模型组大鼠血中CD4+/CD8+的比值下降,具有差异性(P < 0.05);与模型组相比较,治疗组大鼠血中CD4+/CD8+的比值升高,具有统计学差异(P < 0.05)。见表 1、图 1。
| 组别 | 样品数 | CD4+(%) | CD8+(%) | CD4+/CD8+ |
| 正常组 | 3 | 45.50±1.48 | 19.03 ±0.45 | 2.50±0.04 |
| 模型组 | 3 | 47.85±2.96 | 22.06±0.71 | 2.12±0.12* |
| 治疗组 | 3 | 34.81±5.15 | 14.03±0.43 | 2.48±0.32# |
| 正常给药组 | 3 | 45.25±2.03 | 20.10±0.12 | 2.35±0.29# |
| 注:与正常组比较,*P < 0.05;与模型组比较,#P < 0.05。 | ||||
|
| 图 1 各组大鼠CD4++、CD8+流式散点图 Fig. 1 CD4+, CD8+ flow type scatter plotn of rats in each group |
与正常组相比,模型组大鼠血清中INF-γ、TNF-α的含量升高,具有差异性(P < 0.05);与模型组相比较,治疗组大鼠血清中INF-γ、TNF-α含量降低,具有统计学差异(P < 0.05)。见表 2。
| ng/L | |||
| 组别 | 动物数 | INF-y | TNF-a |
| 正常组 | 10 | 1 242.47±233.14 | 233.53±27.21 |
| 模型组 | 10 | 1 495.44±206.21* | 328.63±29.16* |
| 治疗组 | 10 | 1 299.96±166.03# | 259.15±38.19# |
| 正常给药组 | 10 | 1 247.96±125.23# | 231.98±42.60# |
| 注:与正常组比较,*P < 0.05;与模型组比较,#P < 0.05。 | |||
高血压前期是介于正常血压与高血压之间的阶段,没有明显的可查症状,既是属于“病虽未成,已有征兆”的未病状态,又是血压从正常高值到高值的关键过渡期。《黄帝内经》中提出了“盐者胜血”的理论,即高盐饮食或过食食盐可以伤及血脉,导致血液运行不畅,容易引起血脉的瘀滞[12],加之多数高血压前期患者在这一状态下又出现了气虚的症状,气虚与血瘀并见,与补阳还五汤方证相合。另有研究表明,在这一时期机体免疫细胞数量发生改变,尤其是血液中白细胞(WBC)计数升高[13],而补阳还五汤可以减少自身免疫性脑脊髓炎脾脏的CD4+ IFN-γ+T细胞,增加CD4+CD25+、CD4+IL-10+ T细胞数量,抑制TNF-α、IFN-γ等炎性因子的释放,具有促进炎性Th1细胞转化为抗炎的Th2型及调节性T细胞, 抑制炎性反应, 降低T细胞趋化因子的表达的作用[14]。
已经研究证实,免疫系统异常是引起血压升高的重要机制之一[15-16],T淋巴细胞作为主要的淋巴细胞,在机体细胞免疫的过程中发挥着重要作用。成熟的T细胞按CD表型不同分为CD4+T淋巴细胞和CD8+T淋巴细胞两大类[17]。活化的CD4+T淋巴细胞的主要功能是产生细胞因子产生免疫应答或调节免疫应答。如CD4+T淋巴细胞亚群中的Th1细胞可分泌INF-γ、TNF-α等细胞因子。INF-γ可以促进Th1细胞分化以及内皮细胞黏附因子的表达,抑制Th2细胞分化[18]。TNF-α通过促进血管平滑肌细胞迁移与增殖,改变血管通透性,同时介导多条与炎症有关的信号通路,发生炎症反应[19]。活化的CD8+T淋巴细胞最突出的作用是特异性杀伤靶细胞,因此又被称为细胞毒性T细胞。机体生理状态下CD4+/ CD8+两者保持一定比例,会处于相对平衡稳定的状态。当他们比例失调时,会引起机体一系列的病理生理改变[20]。
本实验研究结果表明,与正常组比较,模型组大鼠血液中CD4+T与CD8+T淋巴细胞百分比增加,CD4+/CD8+比值下降,说明高血压前期大鼠机体T淋巴细胞亚群比例失调,免疫功能紊乱。血清中INF-γ与TNF-α的含量上升,提示由于大鼠T淋巴细胞亚群比例的异常变化,引起Th1细胞分泌的INF-γ与TNF-α等炎症因子分泌增多,可能辅助CTL、NK细胞、巨噬细胞的活化和增殖,促进Th1细胞或相关内皮细胞表达黏附因子,亦或激活了由TNF-α介导的信号通路,加强了炎症反应程度。补阳还五汤干预后,治疗组大鼠CD4+T与CD8+T淋巴细胞百分比下降,CD4+/CD8+比值上升,INF-γ与TNF-α的含量下降,表明补阳还五汤可能是通过调节CD4+T与CD8+T淋巴细胞百分比CD4+/CD8+T淋巴细胞比例,改善机体免疫能力,抑制INF-γ与TNF-α炎性因子的分泌以及由他们导致的病理生理过程,延缓高血压前期的发展进程。
| [1] | Chobanian AV, Bakris GL, Black HR, et al. The Seventh Report of the JointNational Commitee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure:the JNC7 report[J]. JAMA, 2003, 289 (19): 2560–2572. DOI:10.1001/jama.289.19.2560 |
| [2] | De MM, de SG, Roman MJ, et al. Cardiovascular and metabolic predictors of progression of prehypertension in tohypertension:the Strong Heart Strong Heart Study[J]. Hypertension, 2009, 54 (5): 974–980. DOI:10.1161/HYPERTENSIONAHA.109.129031 |
| [3] | 孙佳艺, 赵冬, 王薇, 等. 北京地区2740人的血压水平10年(1992-2002) 变化情况[J]. 高血压杂志, 2005, 13 (2): 115–119. |
| [4] | 牟建军. 限盐管理控制高血压中国专家指导意见[J]. 中华高血压杂志, 2015, 23 (11): 1028–1034. |
| [5] | 苗嘉芮, 张立德, 曲怡. 高血压前期中医病因病机理论溯源[J]. 辽宁中医杂志, 2014, 41 (9): 1879–1881. |
| [6] | 付宁, 曲怡, 张立德. 热敏灸干预高血压前期的思路探讨[J]. 辽宁中医药大学学报, 2016 (2): 81–83. |
| [7] | 夏丽娜. 基于《黄帝内经》"盐胜血"理论探讨高盐饮食对血脉影响的机制[D]. 成都: 成都中医药大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10633-1015543397.htm |
| [8] | 李捷, 严士海, 王欣彤, 等. 基于高盐诱导的SHR大鼠肾损伤探讨中医理论"盐胜血"的机制研究[J]. 南京中医药大学学报, 2016, 32 (3): 287–290. |
| [9] | 崔笛, 陈刚, 王良. 基于《内经》"盐胜血"理论探讨低盐饮食合活血化瘀法预防高血压病的实验研究[J]. 成都中医药大学学报, 2011, 34 (2): 54–55. |
| [10] | 尚玉红, 马丽, 林雪. 未病学在高血压前期防治探微[J]. 中国中医基础医学杂志, 2011, 17 (8): 921–922. |
| [11] | 李洪波, 岳桂华. 试论中医治未病理论在高血压前期防治中的运用[J]. 辽宁中医药大学学报, 2012, 1 (1): 110–112. |
| [12] | 夏丽娜, 蒋义芳, 薛萌. 高盐致瘀中医机理探讨[J]. 时珍国医国药, 2016, 27 (8): 1945–1946. |
| [13] | 王坤伟, 杜培宜, 魏新萍, 等. 老年正常高值血压人群中白细胞计数与其血压水平的关系[J]. 实用老年医学, 2016, 30 (2): 150–153. |
| [14] | 杨春彦, 李艳花, 辛延乐, 等. 补阳还五汤对致脑炎性T细胞的免疫调节作用研究[J]. 山西中医学院学报, 2015, 16 (6): 4–7. |
| [15] | 王秋燕. 高血压中的免疫学机制研究[D]. 南昌: 南昌大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10403-1014116648.htm |
| [16] | 罗涛. 短期高盐摄入诱导的Th17/Treg细胞免疫失衡与靶器官炎症反应的关系[D]. 天津: 天津医科大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10062-1014356528.htm |
| [17] | 关洪全, 罗晶. 免疫学基础与病原生物学[M]. 北京: 人民卫生出版社, 2012: 53-54. |
| [18] | 刘畅, 李莉, 崔天祥, 等. γ-干扰素对自发性高血压大鼠左心室质量指数及糖基化终末产物的影响[J]. 中国老年学杂志, 2015, 35 (10): 2636–2838. DOI:10.3969/j.issn.1005-9202.2015.10.017 |
| [19] | 张海超, 潘立君, 张亮. T淋巴细胞及连接蛋白43在自发性高血压大鼠和正常大鼠肾脏的表达差异[J]. 中华高血压杂志, 2016, 24 (5): 451–456. |
| [20] | 陈偶英. 基于p38MAPK、TLR4信号通路介导的炎性细胞因子网络探讨平肝养阴、活血通络法治疗高血压左心室肥厚研究[D]. 长沙: 湖南中医药大学, 2014. |
 2017, Vol. 34
2017, Vol. 34