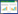文章信息
- 张岩, 赵振宇, 王苹, 张桂贤, 傅予, 刘庆焕, 陶遵威
- ZHANG Yan, ZHAO Zhen-yu, WANG Ping, ZHANG Gui-xian, FU Yu, LIU Qing-Huan, TAO Zun-wei
- 柱前衍生化HPLC法建立苦豆子多糖特征图谱的研究
- Study on establishing specific chromatogram of Sophora alopecuroides L. polysaccharides by pre-column derivation HPLC method
- 天津中医药, 2017, 34(9): 634-637
- Tianjin Journal of Traditional Chinese Medicine, 2017, 34(9): 634-637
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.09.18
-
文章历史
- 收稿日期: 2017-03-25
2. 天津市中医药研究院附属医院, 天津 300120;
3. 天士力控股集团, 天津 300410
苦豆子(Sophora alopecuroides L.)为豆科槐属植物,药用根、茎、全草及种子,广泛分布于中国新疆、西藏、甘肃、内蒙古等地区,具有清热燥湿、消炎止痛等较高的药用价值和生态功能,苦豆子资源的合理利用与开发利用越来越引起人们的重视[1-3]。多糖类成分是苦豆子的重要组成成分之一,课题组前期研究发现苦豆子多糖对小鼠移植瘤S180,H22和EAC具有一定的抑制作用[4]并具有一定的抗氧化活性[5-6]。
为了进一步对苦豆子多糖进行研究利用,对其单糖组成分析及含量控制是十分必要的。虽然已有文献[7-8]采用气相色谱和气质联用色谱对苦豆子多糖的单糖组成进行了分析,但此方法不仅要经过2步以上衍生化,步骤繁琐,而且都仅限于对多糖的定性或是对结构测定进行佐证分析,并没有对多糖中单糖组成进行定量分析并以此作为控制苦豆子多糖质量的方法。因此本文拟采用经典的柱前衍生高效液相色谱(HPLC)法[9],对苦豆子多糖中的单糖分析,并建立苦豆子多糖特定图谱,以期为苦豆子多糖的质量控制提供科学依据。
1 仪器与药品岛津LC-10AD高效液相色谱仪(日本Shimadz公司),SPD -M10A型二极管阵列检测器(日本Shimadzu公司),C18色谱柱(250 mm×4.6 mm,5μm,大连伊利特分析仪器有限公司)。LABCONCO型真空冷冻干燥仪(日本岛津);R-202型旋转蒸发器(上海申胜生物技术有限公司);AE-240电子天平(梅特勒-托利多仪器有限公司);LXJ-Ⅱ B型低速大容量多管离心机(北京医用离心机厂);HH-4智能数显恒温水浴锅(巩义市予华仪器有限责任公司);SHZ-D(Ⅲ)型循环水式真空泵(巩义市英峪予华仪器厂)。
苦豆子(于2010年3月购自内蒙古磴口县金豆商贸有限公司,由天津市医药科学研究所天然药化室吴寿金鉴定为豆科槐属植物苦豆子的种子);对照品:D-甘露糖(Man,批号140651-200602)、D-葡萄糖(Glu,批号110833-200503)、半乳糖(Gla,批号100226-201105)、鼠李糖(Rha,批号111683-200401)、D-木糖(Xyl,批号111508-200404)、D-阿拉伯糖(Ara,批号111506-200001),均购自中国食品药品检定研究院。衍生化试剂:1-苯基-3-甲基- 5-吡唑酮(PMP,分析纯,国药集团化学试剂有限公司),乙腈(色谱纯,sigma公司),水为重蒸水,磷酸氢二钾(分析纯,天津市大茂化学试剂厂),氢氧化钠(分析纯,天津市大茂化学试剂厂),冰醋酸(色谱纯,天津市科密欧化学试剂有限公司)。
2 方法与结果 2.1 色谱条件色谱柱:安捷伦Eclipse XDB-C18(4.6 mm×250 mm,5 μm);流动相:乙腈-0.05 mol/L磷酸盐缓冲液pH 6.8(16:84);流速:1.0 mL/min;检测器:二极管阵列检测器;检测波长:250 nm;柱温:30 ℃,进样体积:10 μL。
2.2 对照品溶液制备Man 10.47 mg、Glu 0.43 mg、Rha 0.65 mg、Gla 11.86 mg、Xyl 0.48 mg、Ara 3.67 mg,用重蒸水溶解至50 mL量瓶中,充分混匀。取该溶液400 μL,分别加入200 μL PMP甲醇溶液(0.5 mol/L),再加入200 μL NaOH溶液(0.2 mol/L),充分混匀,70 ℃水浴条件下反应40 min,取出反应物,冷却至室温,加入200 μL HCL溶液(0.2 mol/L)中和样品溶液,再加入400 μL氯仿萃取,震荡,离心,弃去下层,重复3次,即得对照品混合溶液。
2.3 供试品溶液制备取苦豆子原料200 g,粉碎,过60目筛,加入10倍量的95%乙醇浸泡30 min后,连续回流提取2次,每次2 h,滤过,取药渣依次加入10、8、6倍量的水提取3次,每次2 h,滤过,合并多糖总提取液,经过中空纤维膜分离纯化,往复循环多次收集截流液,旋转蒸发浓缩至密度为1.0,加入4倍体积的无水乙醇醇沉、离心、弃去上清液,冷冻干燥,得苦豆子多糖样品。精密称定苦豆子多糖20 mg,加入2 mol/L三氟乙酸溶液4 mL,放入恒温电磁搅拌器中,110 ℃油浴水解4 h,取出反应物,冷却至室温,加入甲醇,减压浓缩至干,反复数次直至没有酸味,加蒸馏水溶解定容至50 mL量瓶中,准确吸取溶液400 μL,分别加入200 μL PMP甲醇溶液(0.5 mol/L),再加入200 μL NaOH溶液(0.2 mol/L),充分混匀,70 ℃水浴条件下反应40 min,取出反应物,冷却至室温,加入200 μL HCL溶液(0.2 mol/L)中和样品溶液,再加入400 μL氯仿萃取,震荡,离心,弃去下层,重复萃取3次,经0.45 μm微孔滤膜滤过,即得苦豆子多糖供试品溶液。
2.4 方法学考察 2.4.1 精密度实验精密吸取同一批供试品溶液,连续进样6次,考察各共有峰的相对保留时间及相对峰面积比值的一致性。结果各共有峰相对保留时间的RSD小于2.0%,相对峰面积的RSD小于5.0%,表明仪器精密度好。
2.4.2 重复性实验取同一批号样品,分别精密称取6份,按照“2.1”项下色谱条件测定,考察各共有峰的相对保留时间及相对峰面积比值的一致性,结果各共有峰相对保留时间的RSD小于2.0%,相对峰面积的RSD小于5.0%,表明本方法重复性良好。
2.4.3 稳定性实验吸取同一批供试品溶液,按照“2.1”项下色谱条件,分别于0、2、4、8、12、24 h测定,计算各共有峰的相对保留时间和相对峰面积。结果各共有峰的相对保留时间的RSD小于2.0%,相对峰面积的RSD小于5.0%,表明供试品溶液常温下24 h内稳定性良好。
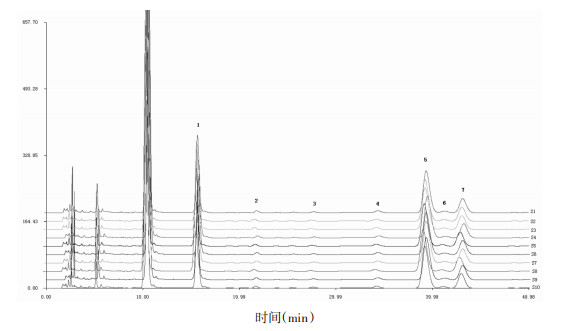
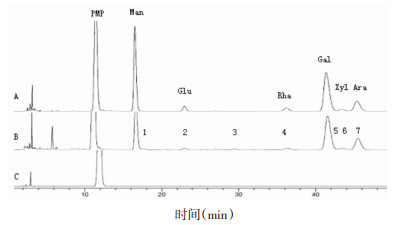
2.5 特征图谱的建立 2.5.1 特征图谱的建立及共有峰标定制备10批样品的供试品溶液,按照“2.1”项下色谱条件测定,记录其10批样品的特征图谱,并将色谱图原始信号导入“中药色谱指纹图谱相似度计算软件”用平均值法建立特征图谱,通过比较分析各样品的色谱峰[10-11],确定共有7个共有峰,见图 1。与混合标准品对比分析,确定1、2、4、5、6、7号色谱峰归属分别为:Man、Glu、Rha、Gla、Xyl、Ara,见图 2。由于甘露糖峰(1号)与相邻峰分离较好,响应值较大且稳定,故选作参照峰。
|
| 图 1 10批样品HPLC特征图谱 Fig. 1 HPLC specific chromatogram of 10 batches of samples |
|
| 图 2 各色谱峰归属图 Fig. 2 Ownership figure of the chromatographic peaks (A)混合对照品;(B)供试品;(C)PMP溶剂 |
通过“中药色谱指纹图谱相似度计算软件”系统比较10批样品特征图谱全谱相似度,并通过均值评价进行指纹图谱相似度计算[12],见表 1-3。10批供试品相似度达到0.90以上,表明10批供试品具有较好的相似度。
| 峰号 | 样品批次 | |||||||||
| S1 | S2 | S3 | S4 | S5 | S6 | S7 | S8 | S9 | S10 | |
| 1 | 1.000 | 1.000 | 1.000 | 1.000 | 1.000 | 1.000 | 1.000 | 1.000 | 1.000 | 1.000 |
| 2 | 1.384 | 1.312 | 1.382 | 1.361 | 1.340 | 1.372 | 1.348 | 1.350 | 1.396 | 1.385 |
| 3 | 1.620 | 1.553 | 1.623 | 1.609 | 1.620 | 1.583 | 1.630 | 1.598 | 1.640 | 1.637 |
| 4 | 2.176 | 2.138 | 2.175 | 2.162 | 2.176 | 2.142 | 2.190 | 2.200 | 2.197 | 2.200 |
| 5 | 2.492 | 2.439 | 2.531 | 2.479 | 2.492 | 2.464 | 2.508 | 2.510 | 2.557 | 2.522 |
| 6 | 2.613 | 2.541 | 2.689 | 2.588 | 2.613 | 2.561 | 2.630 | 2.614 | 2.716 | 2.633 |
| 7 | 2.735 | 2.655 | 2.734 | 2.717 | 2.735 | 2.615 | 2.753 | 2.732 | 2.762 | 2.764 |
| 峰号 | 样品批次 | |||||||||
| S1 | S2 | S3 | S4 | S5 | S6 | S7 | S8 | S9 | S10 | |
| 1 | 1.000 | 1.000 | 1.000 | 1.000 | 1.000 | 1.000 | 1.000 | 1.000 | 1.000 | 1.000 |
| 2 | 0.034 | 0.030 | 0.033 | 0.034 | 0.034 | 0.034 | 0.034 | 0.031 | 0.033 | 0.034 |
| 3 | 0.022 | 0.020 | 0.022 | 0.022 | 0.021 | 0.020 | 0.019 | 0.020 | 0.020 | 0.022 |
| 4 | 0.049 | 0.045 | 0.047 | 0.049 | 0.049 | 0.051 | 0.049 | 0.047 | 0.047 | 0.051 |
| 5 | 1.190 | 1.198 | 1.152 | 1.193 | 1.186 | 1.178 | 1.176 | 1.171 | 1.192 | 1.169 |
| 6 | 0.034 | 0.025 | 0.033 | 0.035 | 0.034 | 0.034 | 0.034 | 0.031 | 0.034 | 0.034 |
| 7 | 0.428 | 0.435 | 0.416 | 0.428 | 0.426 | 0.424 | 0.423 | 0.429 | 0.431 | 0.433 |
| 样品批号 | 对应图谱号 | 相似度 |
| 1 | SI | 0.914 |
| 1 | S2 | 0.962 |
| 3 | S3 | 0.988 |
| 4 | S4 | 0.914 |
| 5 | S5 | 0.925 |
| 6 | S6 | 0.992 |
| 7 | S7 | 0.924 |
| 8 | S8 | 0.913 |
| 9 | S9 | 0.926 |
| 10 | S10 | 0.992 |
由于PMP柱前衍生HPLC法,反应条件温和,衍生化产物稳定不易裂解,并且易于紫外检测和定性定量分析,操作简便应用广泛[13-14]。因此,本实验选择PMP柱前衍生HPLC法对苦豆子多糖建立特征指纹图谱。
在前期的预实验中,本文考察了色谱条件、水解条件和衍生化条件对PMP柱前衍生HPLC法测定苦豆子多糖效果的影响。结果发现色谱条件中流动相的选择与比例对多糖的分离效果影响较大,其中选用的磷酸盐缓冲液较醋酸盐类缓冲液分析时间较短,分离效果较好。磷酸盐与乙腈的配比为16:84是最佳配比,既能保证各峰的分离度大于1.5,又能有效节省分析时间,若将乙腈换成甲醇则样品中检测的单糖数量减少,峰面积大大减小,因此避免使用甲醇做流动相。通过对水解条件和衍生化条件考察[15-16],发现水解时间为4 h,衍生化时间为40 min时,反应较为完全,测得样品的重现性较好,是保证结果准确性的重要因素,其他因素无显著影响。
4 结论本实验建立了苦豆子多糖柱前衍生化HPLC特征图谱,该方法操作简单、准确可靠、灵敏度高、具有较好的重复性和稳定性,同时也侧面反映了苦豆子多糖的结构组成,初步确定苦豆子多糖是以半乳甘露聚糖为主的多糖类成分,这为苦豆子多糖的质量控制以及构效关系的研究提供了有效的数据支持和参考依据。
| [1] | 祁燕蓉, 何生虎, 史光亮. 苦豆子的研究进展[J]. 甘肃畜牧兽医, 2008, 39 (6): 36–38. |
| [2] | 廖春燕, 梁健, 杨燕, 等. 苦豆子的药理及应用概述[J]. 中国民族民间医药, 2009, 18 (3): 6–8. |
| [3] | 李珂璟, 王小龙. 苦豆子及其应用[J]. 甘肃农业科技, 2010, 48 (2): 46–47. |
| [4] | 冯文茹, 赵秀梅, 郑夺, 等. 苦豆子多糖的体内抗肿瘤作用的初步观察[A]. 2011医学科学前沿论坛暨第12届全国肿瘤药理与化疗学术会议论文集[C], 2011: 60. |
| [5] | 赵永安, 陈冠, 陶遵威. 苦豆子多糖及其衍生物的体外抗氧化活性研究[J]. 中国实验方剂学杂志, 2013, 19 (5): 213–216. |
| [6] | 申林卉, 刘丽侠, 陈冠, 等. 苦豆子多糖羧甲基化修饰及其抗氧化活性的研究[J]. 天津中医药大学学报, 2014, 33 (3): 157–160. DOI:10.11656/j.issn.1673-9043.2014.03.08 |
| [7] | 陈香荣, 曹楠楠, 吴艳, 等. 苦豆子多糖的分离纯化及初步结构[J]. 天然产物研究与开发, 2014, 26 (8): 1244–1247. |
| [8] | 王维通, 于海妮, 沙逸仙, 等. 苦豆子胶多糖化学结构的测定[J]. 分析化学, 1982, 10 (11): 666–672. |
| [9] | 邝婷婷, 王宇, 王张, 等. 柱前衍生HPLC分析黄连多糖的单糖组成[J]. 中国实验方剂学杂志, 2014, 20 (11): 74–78. |
| [10] | 周桂芬, 庞敏霞, 陈素红, 等. 铁皮石斛茎、叶多糖含量及多糖部位柱前衍生化-高效液相色谱指纹图谱比较研究[J]. 中国中药杂志, 2014, 39 (5): 795–802. |
| [11] | Peng L, Wang YZ, Zhu HB, et al. Fingerprint profile of active components for Artemisia selengensis Turcz by HPLC-PAD combined with chemometrics[J]. Food Chem, 2011, 125 (3): 1064–1071. DOI:10.1016/j.foodchem.2010.09.079 |
| [12] | 吴玉, 孙国祥, 李晓稳. 防风通圣丸高效液相色谱数字化定量指纹图谱研究[J]. 中南药学, 2012, 10 (11): 842–847. |
| [13] | 钱一帆, 张磊, 濮存海. 高效液相色谱法测定灵芝孢子粉片中多糖含量的研究[J]. 中药材, 2007, 30 (8): 1027–1029. |
| [14] | Xu XX, Li Y, Liu H, et al. Determination of the molecular weight (Mw) and weight distribution (Mw distribution) in Duohuahuangjing polysaccharide by HPLC[J]. Sichuan Journal of Physiological Sciences, 2008, 30 : 102–104. |
| [15] | 蒋梅, 谭丽蓉, 黄晓洁, 等. 枸杞子多糖柱前衍生HPLC指纹图谱分析[J]. 中国实验方剂学杂志, 2014, 20 (22): 53–56. |
| [16] | 郝蕾蕾, 张典瑞, 赵忠熙, 等. 柱前衍生化HPLC法测定黄河滩枣多糖的单糖组成[J]. 中国生化药物杂志, 2012, 33 (6): 740–743. |
2. Tianjin Academy of Traditional Chinese Medicine Affiliated Hospital, Tianjin 300120, China;
3. Tasly Holding Group, Tianjin 300410, China
 2017, Vol. 34
2017, Vol. 34