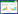文章信息
- 梅雪, 罗隽, 夏青, 冯娅茹, 索亚然, 李二文, 王昭懿, 马志强, 林瑞超
- MEI Xue, LUO Jun, XIA Qing, FENG Yaru, SUO Yaran, LI Erwen, WANG Zhaoyi, MA Zhiqiang, LIN Ruichao
- 基于斑马鱼幼鱼模型的甘遂毒性评价
- Toxicity evaluation of Radix Kansui on zebrafish larvae
- 天津中医药, 2018, 35(1): 51-55
- Tianjin Journal of Traditional Chinese Medicine, 2018, 35(1): 51-55
- http://dx.doi.org/10.11656/j.issn.1672-1519.2018.01.14
-
文章历史
- 收稿日期: 2017-08-26
甘遂为大戟科植物甘遂(Euphorbia kansui T. N. Liou ex T.R Wang)的干燥块根,可泻水逐饮,消肿散结。常用于肝硬化腹水、胸腔积液、水肿等病症[1],现代临床也用于治疗晚期食道癌、乳腺癌等肿瘤及慢性支气管炎等疾病[2]。药理研究表明,甘遂具有抗肿瘤、抗病毒、治疗胰腺炎、免疫抑制等多种药理活性[3-4],但其毒性作用却严重制约着它的临床应用。
斑马鱼具有繁殖速度快、子代数量多、胚胎透明等生物学特性,目前已在药理和毒理研究方面得到了广泛的应用[5]。利用斑马鱼模型可以高效、直观地评价药物的心血管、肝脏、肾脏和神经等靶器官毒性[6],研究数据表明该模型对药物的心血管、肝脏、胃肠道和神经毒性的评价结果与人体试验结果的一致性平均达到了80%以上[7-9]。斑马鱼模型系统既具有细胞等体外实验用药量少、费用低、周期短、高通量等特点,又具备整体动物实验可观察多个器官[10]、涵盖体内代谢与内环境变化对药物的毒性影响等优势。斑马鱼幼鱼模型克服了细胞和化学筛选模型的局限性,从整体水平直观地评估药物的毒性作用,很好填补了细胞模型和啮齿动物模型过渡的空白[11]。
目前关于甘遂的毒性评价比较混乱,有关实验证明其确实存在较强的毒性作用,但均存在对其毒性特征描述不确切,靶器官研究不充分,毒性可逆性研究缺失等问题[12-15]。故本实验拟用斑马鱼幼鱼为模型,评价甘遂不同极性溶剂提取物毒性差异,完善对甘遂的毒性评价,同时为该模型在中药毒性评价中的应用提供参考。
1 实验材料 1.1 药物和试剂去离子水、石油醚、二氯甲烷、乙酸乙酯、95%乙醇、氯化钠、氯化钾、磷酸二氢钾、磷酸氢二钠、碳酸氢钠等为分析纯,购自北京化工厂。氯化钙、三卡因、甲基纤维素等购自Sigma公司。干酵母片购自北京同仁堂。
1.2 动植物甘遂购自河北安国药材市场,经北京中医药大学杨瑶珺教授鉴定为大戟科植物甘遂的干燥块茎。
野生型AB系斑马鱼,购自国家斑马鱼资源中心。丰年虾,购于天津丰年水产养殖有限公司。草履虫,实验室养殖。
1.3 仪器斑马鱼循环水养殖系统(北京爱生科技公司),恒温培养箱LRH-250Z(广州瑞明仪器有限公司),蔡司体式荧光显微镜(Zeiss, Axio Zoom V16),数显恒温水浴锅(天津泰斯特有限公司),ZDHW电热套(北京中兴伟业仪器有限公司),OSB-2100型旋转蒸发仪(上海爱朗仪器有限公司),真空干燥箱(上海一恒科学仪器有限公司)。
2 方法 2.1 甘遂提取物及幼鱼暴露液的制备称取甘遂生品50 g,粉碎,过40目筛,置于索氏提取器中,依次按顺序以10倍质量的石油醚、二氯甲烷、乙酸乙酯、95%乙醇为溶剂,进行连续提取。每个溶剂提取6 h,更换提取溶剂时,挥干药材粉末中所含上一溶剂。所得提取液经浓缩干燥后,存于干燥器中备用。
以二甲基亚砜(DMSO)为溶剂,制备500 mg/mL的提取物母液。实验时用幼鱼养殖水将母液稀释至所需浓度。
2.2 斑马鱼幼鱼的繁育斑马鱼成鱼养殖于斑马鱼循环水养殖系统中,控制水温(28.0±0.5)℃,光照周期为明暗14:10 h交替,系统水pH为6.8~7.2,电导率为400~500 μs,每日喂食新孵化的丰年虾3次。产卵前1 d晚上按雌雄1:2比例配鱼,第2天待产卵完成后,收集受精卵,挑除死卵及杂质,用幼鱼养殖水清洗3次,置于28.5 ℃光照培养箱中培养,光照周期为明暗14:10 h。
2.3 甘遂不同提取物毒性比较显微镜下挑选发育正常的受精后3 d(dpf)幼鱼,置于12孔板中,每孔20条幼鱼,给予暴露液3 mL,连续给药72 h,每24 h更换暴露液。预实验以0.01、0.1、1、10、100、200、500 μg/mL提取物为给药浓度,根据实验结果,调整给药浓度,确定甘遂暴露给药72 h(hpe)的最大不致死浓度和最小全致死浓度,并在此区间选择设定成等差数列的6~8个药物浓度建立致死曲线。实验重复3次。实验以给药后72 hpe斑马鱼幼鱼死亡率与实验浓度梯度呈良好线性关系(r2≥85%),且半数致死浓度(LC50)的RSD≤0.1为有效值。
根据致死曲线计算各提取物半数致死浓度,根据LC50及所含原生药量比较不同溶剂连续提取物的毒性差异,并根据致死曲线计算最毒提取物的最小致死浓度(LC1)、和10%致死浓度(LC10)。
2.4 毒性指标及可逆性观察以幼鱼养殖水为空白对照组,以含助溶剂0.1% DMSO的幼鱼养殖水为溶剂对照组,选用1/10 LC1、1/3 LC1、LC1、LC10 4个浓度作为毒性指标及可逆性观察的给药浓度。实验设立6个重复组,其中3组给药72 h后,观察暴露液对各个脏器系统毒性指标产生的影响,另外3组给药72 h后,吸除暴露液并用养殖水清洗3次,置于12孔板中以养殖水培养恢复48 h,观察毒性可逆性。各给药组及恢复组于体式显微镜下观察并拍照,记录各毒性观察指标的变化。
2.5 苏木精-伊红(HE)染色观察给药和恢复结束后,存活幼鱼以磷酸缓冲盐溶液(PBS)清洗3次,置于离心管中,加4%多聚甲醛于4 ℃固定24 h,常规切4 μm切片。染色步骤如下:1)切片用二甲苯脱蜡,经各级乙醇至水洗:二甲苯(Ⅰ)6 min→二甲苯(Ⅱ)6 min→100%乙醇6 min→95%的乙醇6 min→80%乙醇6 min→75%乙醇6 min→蒸馏水洗6 min。2)苏木素染色5 min,自来水冲洗。3)盐酸乙醇分化10 s。4)自来水浸泡15 min。5)置伊红液2 min。6)常规脱水,透明,封片:95%乙醇(Ⅰ)1 min→95%乙醇(Ⅱ)1 min→100%乙醇(Ⅰ)1 min→100%乙醇(Ⅱ)1 min→二甲苯石碳酸(3:1)1 min→二甲苯(Ⅰ)1 min→二甲苯(Ⅱ)1 min→中性树脂封固。
2.6 统计学方法采用SPSS 20.0统计软件。所有数据以均数±标准差(x± s)表示,组间比较采用单因素方差分析,以P < 0.05为差异有统计学意义。
3 结果 3.1 甘遂提取率按照上述实验方法制备得到甘遂不同溶剂提取物,提取率依次分别为石油醚6.32%、二氯甲烷1.92%、乙酸乙酯1.85%、95%乙醇3.31%。
3.2 甘遂不同提取物毒性差异按上述2.2及2.3方法,根据预实验结果,确定了甘遂不同提取部位的实验浓度,重复给药3次,统计斑马鱼幼鱼死亡数,根据斑马鱼幼鱼死亡率建立致死曲线,见图 1,并计算LC50。实验结果显示甘遂不同提取部位毒性依次为石油醚>二氯甲烷>乙酸乙酯>乙醇提取物;LC50依次为(0.107±0.006)、(0.416±0.005)、(4.516±0.035)、(24.281±1.370)μg/mL。故在后续的实验中,将主要以石油醚提取物为研究对象,评价甘遂毒性。
|
| 图 1 甘遂不同溶剂提取物致死曲线 Fig. 1 Lethal curve of Radix Kansui extracted with different solvent 石油醚提取物(A);二氯甲烷提取物(B);乙酸乙酯提取物(C);乙醇提取物(D) |
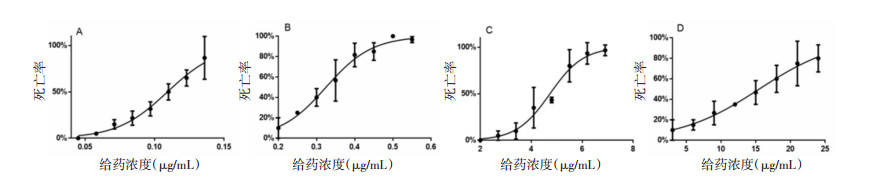
如图 2所示,给药组和恢复组斑马鱼幼鱼心脏未出现心包水肿、出血瘀血等异常现象,显微镜下观察心脏形态正常,心区血流正常、无心律不齐。根据统计,给药组和恢复组均与对照组心率差异无统计学意义,说明甘遂无心脏毒性。见表 1。
|
| 图 2 甘遂心脏区域、脑区和肠区形态变化(×80) Fig. 2 Morphological changes of heart, nervous system and gastrointestinal tract in Radix Kansui(×80) |
| 组别 | 动物数 | 给药浓度(μg/mL) | 相对心率(%) |
| 给药组 | 10 | 给药空白组 | 100.00± 7.85 |
| 0.005 | 104.21±11.32 | ||
| 0.017 | 101.58±11.11 | ||
| 0.050 | 101.58±10.83 | ||
| 0.070 | 106.84± 6.10 | ||
| 恢复组 | 10 | 恢复空白组 | 100.00± 8.22 |
| 0.005 | 98.25± 4.71 | ||
| 0.017 | 100.44± 9.12 | ||
| 0.050 | 102.19± 8.28 | ||
| 0.070 | 105.70± 7.00 |
如图 2所示,斑马鱼脑部未出现水肿、畸形等异常形态,脑区颜色正常,说明脑部未发生变性,说明甘遂无脑毒性。
3.3.3 胃肠道刺激性如图 2所示,结合镜下观察,斑马鱼胃肠道区域颜色略有变化,变得灰暗,显示可能出现轻微肠变性,镜下肠褶皱无明显变化。0.050和0.070 μg/mL组肠腔略有变小,可能为毒性变化所致。肠道尼罗红排泄实验显示排泄率呈剂量依赖性增高(荧光强度越低说明排泄率越高),说明甘遂具有胃肠道刺激性。见表 2。
| 给药浓度(μg/mL) | 动物数 | 相对荧光强度(%) |
| 给药空白组 | 10 | 100.00±7.16 |
| 0.005 | 10 | 77.92±6.79** |
| 0.017 | 10 | 69.50±6.86** |
| 0.050 | 10 | 54.04±4.62** |
| 0.070 | 10 | 52.82±4.84** |
| 注:与给药空白组比较,**P<0.01。 | ||
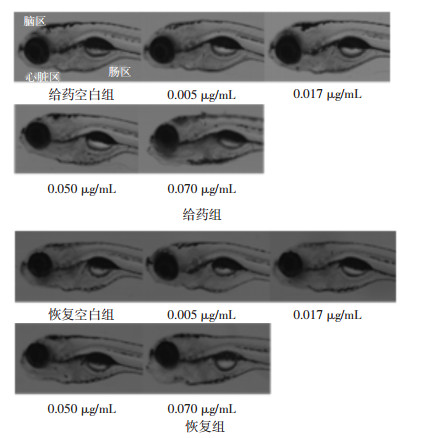
如图 3所示,正常的斑马鱼肝脏界限清晰,纹理清晰均匀,给药后肝脏界限变模糊且肝区颜色变为灰暗色,纹理混乱。统计数据见表 3和表 4,给药组肝脏面积在0.070 μg/mL给药组中显著增大,停药后恢复48 h,相对肝面积进一步增大,说明甘遂高浓度使幼鱼肝脏肿大,且停药后肝肿大未出现可逆性;给药组肝脏面积在0.050 μg/mL给药组中未显著增大,但停药后恢复48 h,相对肝面积进一步增大,说明此浓度会造成持续性肝损伤;给药后肝区光强度在0.005、0.050、0.070 μg/mL给药组中显著降低,停药后恢复48 h光强度出现可逆性。综上所述,说明甘遂具有肝毒性,可使肝肿大和肝变性,肝肿大不可逆,而肝变性具有可逆性。

|
| 图 3 甘遂肝脏形态变化(×80) Fig. 3 Morphological changes of liver in Radix Kansui(×80) |
| 组别 | 动物数 | 给药浓度(μg/mL) | 相对肝面积(%) |
| 给药组 | 10 | 给药空白组 | 100.00± 3.01 |
| 0.005 | 102.69±11.21 | ||
| 0.017 | 100.77± 6.32 | ||
| 0.050 | 101.57± 5.88 | ||
| 0.070 | 110.01± 6.65* | ||
| 恢复组 | 10 | 恢复空白组 | 100.00± 8.51 |
| 0.005 | 98.45± 3.01 | ||
| 0.017 | 102.26± 4.20 | ||
| 0.050 | 109.19± 3.98# | ||
| 0.070 | 108.82± 5.20# | ||
| 注:与给药空白组比较,*P<0.05;与恢复空白组比较,#P < 0.05。 | |||
| 组别 | 动物数 | 给药浓度(μg/mL) | 相对心率(%) |
| 给药组 | 10 | 给药空白组 | 100.00±4.83 |
| 0.005 | 94.02±5.66* | ||
| 0.017 | 96.70±5.09 | ||
| 0.05 | 92.88±5.46* | ||
| 0.07 | 92.32±6.68** | ||
| 恢复组 | 10 | 恢复空白组 | 100.00±4.45 |
| 0.005 | 97.90±3.08 | ||
| 0.017 | 96.94±5.65 | ||
| 0.05 | 96.99±2.54 | ||
| 0.07 | 95.22±5.48# | ||
| 注:与给药空白组比较,*P<0.05,**P<0.01;与恢复空白组比较,#P < 0.05。 | |||
如图 4所示,斑马鱼躯体形态正常,未出现肾性水肿等异常现象,说明甘遂无肾脏毒性。
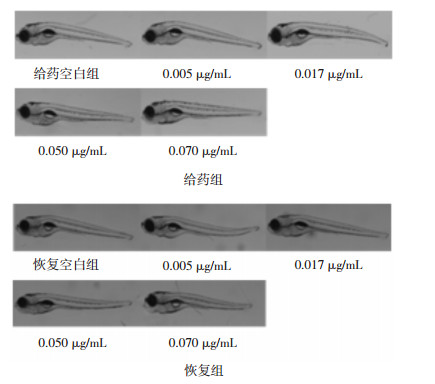
|
| 图 4 甘遂肾性水肿观察结果及其他毒性指标形态变化(×30) Fig. 4 Nephrogenic edema and morphological changes of other toxic index in Radix Kansui(×30) |
如图 4所示,与对照组相比,给药后斑马鱼眼、下颌、身体着色、鱼鳔、肌肉和鱼鳍等均无异常,全身无出血、淤血等现象。
3.3.7 HE染色结果如图 5所示,甘遂给药后对肝脏组织损害较大。空白组和溶剂对照组中,肝脏、肠道等区域细胞完整,细胞核明显,细胞质均匀。在甘遂LC10浓度给药组中,肝脏细胞排列松散,肝实质细胞减少,空泡现象增多,细胞界限不明晰。在恢复组中,虽略有所好转,但肝细胞毒性损害仍比较明显。
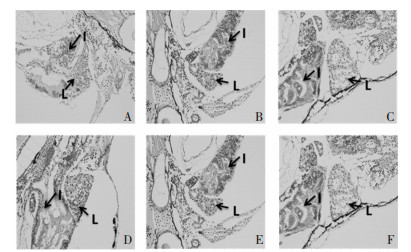
|
| 图 5 甘遂对斑马鱼幼鱼的毒性影响(HE染色,×400) Fig. 5 Toxic effects of Radix Kansui on zebrafish larvae (HE stain, ×400) A:给药空白组;B:恢复空白组;C:溶剂给药组;D:溶剂恢复组;E:0.070 μg/mL甘遂给药组;F:0.070 μg/mL甘遂恢复组。L:肝脏;I:肠道 |
本实验首次以斑马鱼幼鱼为模型,单次给药,同时评价了甘遂毒性对机体心脏、肝脏、肾脏、神经系统、胃肠道等脏器系统的毒性作用及可逆性,并证实了甘遂可对肝脏和胃肠道造成实质性损伤,为斑马鱼模型在中药毒性评价中的应用提供了参考。
| [1] | 李燕. 有毒中药甘遂炮制前后化学成分及减毒作用的研究[D]. 济南: 济南大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10427-1011159410.htm |
| [2] | 王立岩. 甘遂的化学成分及其生物活性的研究[D]. 本溪: 沈阳药科大学, 2003. http://cdmd.cnki.com.cn/Article/CDMD-10163-2004081323.htm |
| [3] | 修彦凤, 曹艳花, 张永太. 甘遂的药理作用研究进展[J]. 上海中医药杂志, 2008, 42 (4): 79–81. |
| [4] | 束晓云, 丁安伟. 甘遂的炮制及其化学成分, 药理作用研究进展[J]. 中国药房, 2007, 18 (24): 1904–1906. DOI:10.3969/j.issn.1001-0408.2007.24.029 |
| [5] | Delvecchio C, Tiefenbach J, Krause HM. The zebrafish:a powerful platform for in vivo, HTS drug discovery[J]. Assay Drug Dev Technol, 2011, 9 (4): 54. |
| [6] | Jyotshna K, Elvic C, Ali SF, et al. Zebrafish model in drug safety assessment[J]. Curr Pharm Design, 2014, 20 (34): 5416–5429. DOI:10.2174/1381612820666140205145658 |
| [7] | He JH, Guo SY, Zhu F, et al. A zebrafish phenotypic assay for assessing drug-induced hepatotoxicity[J]. J Pharmacological Toxicol, 2013, 67 (1): 25–32. DOI:10.1016/j.vascn.2012.10.003 |
| [8] | Zhu JJ, Xu YQ, He JH, et al. Human cardiotoxic drugs delivered by soaking and microinjection induce cardiovascular toxicity in zebrafish[J]. J Appl Toxicol, 2014, 34 (2): 139–148. DOI:10.1002/jat.v34.2 |
| [9] | Ou H, Simon JA, Rubel EW, et al. Screening for chemicals that affect hair cell death and survival in the zebrafish lateral line[J]. Hearing Res, 2012, 288 (1-2): 58–66. DOI:10.1016/j.heares.2012.01.009 |
| [10] | 陈汝家, 朱俊靖, 周盛梅. 斑马鱼模型在药物毒性与安全性评价中的应用[J]. 毒理学杂志, 2012, 26 (3): 224. |
| [11] | 田丽莉, 朱国福. 斑马鱼在中药研究中的应用[J]. 中国中药杂志, 2015, 40 (5): 822–827. |
| [12] | Zhang L, Gao L, Li Z, et al. Bio-guided isolation of the cytotoxic terpenoids from the roots of Euphorbia kansui against human normal cell lines L-O2 and GES-1[J]. Int J Mol Sci, 2012, 13 (9): 11247. |
| [13] | 曹雨诞, 李征军, 陈海鹰, 等. 甘遂不同炮制品及提取物对斑马鱼的急性毒性研究[J]. 中国现代应用药学, 2013, 30 (2): 140–143. |
| [14] | 姜玮, 王新敏, 唐于平, 等. 甘遂不同提取物对斑马鱼急性毒性的初步观察[J]. 南京中医药大学学报, 2012, 28 (1): 53–56. |
| [15] | 曹亮亮, 王文晓, 张丽, 等. 基于"有故无殒"思想的醋甘遂毒性研究[J]. 中国中药杂志, 2015, 40 (16): 3249–3255. |
 2018, Vol. 35
2018, Vol. 35