文章信息
- 石鑫慧, 吕明, 朱彦
- SHI Xinhui, LYU Ming, ZHU Yan
- 基于“异病同治”理论的银杏叶提取物及其活性成分防治心脑血管疾病共同靶标分析
- Common target analysis of Ginkgo biloba extract and its active ingredients for co-treatment of cardiovascular and cerebrovascular diseases based on "same treatment for different diseases" theory
- 天津中医药, 2018, 35(1): 72-76
- Tianjin Journal of Traditional Chinese Medicine, 2018, 35(1): 72-76
- http://dx.doi.org/10.11656/j.issn.1672-1519.2018.01.19
-
文章历史
- 收稿日期: 2017-08-26
2. 天津国际生物医药联合研究院中药新药研发中心, 天津 300457
心脑血管疾病的发病率和病死率已经呈现显著增高的趋势,全世界每年死于动脉粥样硬化、脑栓死、心肌梗死等心脑血管疾病人数高达数千万。心血管疾病是一类涉及心脏或血管的疾病,包括冠状动脉疾病、心律失常、外周动脉疾病和静脉血栓形成等[1-2]。脑血管疾病是脑循环的血管疾病,因向大脑供氧的动脉受到影响从而导致多种脑部疾病。脑血管疾病包括脑血栓、脑栓死等疾病,其中最常见的是中风或微中风,有时可能是出血性中风[3]。由于现代临床影像学和综合诊断技术的快速发展,目前心脑血管疾病相关性研究已经成为国际上高度关注的领域之一[4-5]。
“辨证论治”是中医学的基本特点和指导临床诊治疾病的基本原则[6]。中医学的证,是机体在疾病发展过程中某一阶段的病理概括及病理变化的本质。西医学的病含义是单一的,其病因、病机往往是实验研究结果。因此,在临床上常出现这样的现象:同一疾病因发病时间、地域不同,或机体的反应性不同,或疾病处于不同的发展阶段而表现出不同的证,因可采用不同的治疗方法;而不同的疾病,有时在其发展过程中出现性质相同的证,则可采用相同的治疗方法。笔者将前者称为同病异治,后者称为异病同治,两者均是以“辨证论治”理论为基础。
心脑血管疾病发病机制十分复杂,如脂质代谢紊乱、自由基产生等均会导致疾病的发生与发展,因此可通过针对不同的致病因素采取不同的治疗方法,如改善血液流变学、调节脂质代谢等。这体现了辨证论治中同病异治的治疗原则。动脉粥样硬化(AS)是心脑血管疾病的发病病因也是其病理变化的共同基础,而AS血栓形成是导致心脑血管疾病的根本。AS是高胆固醇水平与大脑动脉中的炎症相结合,导致胆固醇在血管中积累成为厚的蜡样斑块,该斑块可限制或完全阻塞流向脑的血流,引起中风或短暂性脑缺血发作[7]。因此,对AS的治疗是防治心脑血管疾病的根本和基础,体现了中医学辨证论治中异病同治的治疗原则。笔者在总结国内外文献的基础上,从异病同治的角度分析银杏叶提取物(EGb)在防治心脑血管疾病方面的药理作用和疾病共同靶标之间的关系。
银杏叶为银杏科植物银杏的干燥叶,具有活血化瘀、通络止痛、化浊降脂等功能,临床主要应用于冠状动脉性心脏病、高脂血症等疾病。银杏叶提取物主要的活性成分为黄酮类和萜内酯类。
1 银杏叶提取物主要化学成分及其药理应用目前,国际上公认标准EGb制剂的指标:含24%的黄酮苷类化合物(主要是山奈酚、槲皮素和异鼠李素),含6%的萜内酯(2.8%~3.4%的银杏内酯A、B、C和2.6%~3.2%的白果内酯)[8]。
1.1 黄酮类化合物分子、脑功能、认知功能和细胞存活等过程,调节或直接作用于不同的信号通路,如Akt/PKB、PI3K、MAPK等,发挥其抗氧化剂清除自由基的功效。并能够改善神经细胞存活、发挥神经保护作用[9]。
1.2 银杏内酯AEGb中的萜内酯类均为血小板活化因子(PAF)拮抗剂。炎症损伤可刺激机体释放大量的PAF,并与细胞膜表面PAF受体结合后从多个途径参与并影响炎症过程。银杏内酯A可减少血管内皮中由高葡萄糖刺激引起的STAT-3介导的炎症反应,表明内酯可减少STAT磷酸化从而减少细胞凋亡[10-11]。
1.3 银杏内酯B银杏内酯B是EGb中对PAF产生的拮抗作用效果最强的成分,被称为天然的PAF拮抗剂。银杏内酯B在临床上常用来治疗偏头痛和缺血再灌注后损伤等[12-14]。银杏内酯B在中枢神经系统对抗PAF谷氨酸传输的调节有援助作用,在用银杏内酯B预防偏头痛的研究中发现,连续3个月内平均每月疼痛频率显著下降[15-16]。
1.4 银杏内酯C银杏内酯C是EGb中研究较少的成分,其拮抗PFA的能力较银杏内酯B相比低了25倍左右。即便如此,在胶原刺激人血小板活化时银杏内酯C显示通过增加基质金属蛋白酶-9(MMP-9)强烈抑制血栓素A2产生和Ca2+动员,同时增加胞内cAMP和cGMP水平抑制血小板聚集[17]。在3T3-L1脂肪细胞中,银杏内酯C促进Sirt1/AMPK活性以增加脂肪细胞的脂解,从而改善代谢综合征和胰岛素抵抗(IR)的作用[18]。
1.5 白果内酯白果内酯是从银杏叶中提取分离出的倍半萜内酯[19],其在结构上类似于银杏内酯,但它并不是一个直接的PAF拮抗剂。研究表明,白果内酯具有减少I/R损伤后的神经炎症、缺氧引起的炎症和炎性疼痛等抗炎特性[20-22]。
2 银杏叶提取物对心血管疾病的疗效在慢性心血管疾病的临床研究中,EGb为其常规疗法提供了另一种机制。EGb降低IR诱导的心肌细胞损伤和抑制心肌细胞凋亡,其保护机制与其下调Caspase-3和细胞色素C的表达有关[23]。此外,EGb能够防止缺血性心律失常的发生,其抗心律失常机制是通过抑制IKr和ICa-L实现的[24]。
急性心肌梗死(AMI)系指冠状动脉突然完全性闭塞,心肌发生缺血、损伤和坏死的一种急性缺血性心脏病。在AMI后导致心肌纤维化和细胞外基质(ECM)重塑等。EGb通过调节基质金属蛋白酶-2(MMP-2)和MMP-9的表达并抑制ECM沉积[25],表明EGb能有效的预防和逆转AMI导致的心肌重构,对降低AMI病死率具有重要意义。
3 银杏叶提取物对脑血管疾病的疗效凋亡和神经再生是缺血性中风的两个重要方面,而细胞凋亡是脑缺血再灌注损伤后的重要机制。在大鼠I/R海马模型中发现经EGb治疗后可显著减少脑梗死面积和海马体及同侧皮质中的凋亡,提高海马神经再生,结果表明EGb可抑制神经元凋亡,增强神经再生[26]。
临床试验中给与急性脑梗死患者EGb治疗后,患者恢复期PAC1、CD62P表达率均较急性期时下降,说明EGb可抑制血小板活化,减少血小板聚集,从而达到改善微血管循环,减少脑梗死再发的目的[27]。另有研究表明,EGb对脑梗死患者血液流变学及血清指标均有不同程度的改善[28],180例AMI患者,随机分为2组,对照组进行常规疗法,试验组在对照组基础上加用EGb,检测2组临床疗效及血清低氧诱导因子-1α(HIF-1α)、肿瘤坏死因子-α(TNF-α)、Caspase-3水平,结果表明试验组总有效率78.9%,明显优于对照组,血清HIF-1α、Caspase-3、TNF-α水平低于对照组。
4 银杏叶提取物对心脑血管疾病的异病同治本文通过Pubmed等数据库检索获得原始论文及综述,以“Ginkgo biloba extract”、“Heart”、“Brain”、“Stroke”等关键词进行组合查询。以“Ginkgo biloba extract”为关键词搜索,相关文章共1 482篇;以“Ginkgo biloba extract”和“Brain”为关键词搜索,相关文章共357篇;以“Ginkgo biloba extract”和“Heart”为关键词搜索,相关文章共88篇;以“Ginkgo biloba extract”和“ischemic stroke”为关键词搜索,相关文章共32篇;以“Ginkgo biloba extract”和“ischemic heart disease”为关键词搜索,相关文章共44篇,而以“Ginkgo biloba extract”和“Heart”和“Brain”关键词搜索,相关文章仅有3篇。从查阅文献结果可知,对银杏叶提取物的研究侧重于脑保护和脑血管相关疾病,对于心血管疾病的研究较少,而对于同时防治心脑血管疾病的研究更是少之又少。
结合查阅文献中所涉及的心脑血管疾病相关靶点,通过IPA(ingenuity pathway analysis)对相关靶点进行分析,发现有14个靶点为心脑血管疾病的共同靶点;再将EGb与共同靶点进行分析后发现两者之间存在一定关联性。其中银杏内酯B、槲皮素等16个成分可同时作用于共同靶点。EGb与共同靶点的网络分析见图 1。由图可知,EGb可针对不同的靶点治疗同一种疾病,同时,也可针对相同的靶点治疗不同的疾病。在心脑共同靶点中,与动脉粥样硬化相关的共有6个靶点:1)血管紧张素转化酶(ACE):血管壁局部肾素血管紧张素系统(RAS)的过度激活是导致AS发生的重要因素,ACE是RAS中的关键元素,ACE活性增强提示RAS过度激活,临床可通过检测ACE活性来预测体内动脉粥样硬化的严重程度[29]。2)内皮素-1(EDN1):是一种内源性血管收缩调节因子,可促进血管平滑肌细胞异常增殖,导致了AS的发生与发展[30]。3)脂蛋白脂肪酶(LPL):是脂质代谢中的关键酶,负责催化脂解脂蛋白中甘油三酯,也直接或间接参与AS的发病机制[31]。4)内皮型一氧化氮合酶3(NOS3):一氧化氮是在NOS3作用下有血管内皮产生的信号分子,是抗AS和血栓形成的保护性因子,而eNOS/NO信号途径紊乱是早期AS的指征[32]。5)前列腺素内过氧化物酶(PTGS2):又称环氧合酶2(COX-2),是促炎性前列腺素合成的关键酶,通过广泛的炎症刺激诱导其在动脉粥样硬化病变中高度表达[33]。6)RhoA:RhoA是Rho家族成员之一,其最主要的效应分子为ROCK,在AS炎性反应多个阶段均有RhoA /ROCK通路的参与[34]。EGb中已经鉴定的16个化合物与这6个靶点的相互作用,呈现为“一靶多药”或“一药多靶”的不同形式,这可能是EGb“异病同治”的主要分子机制。
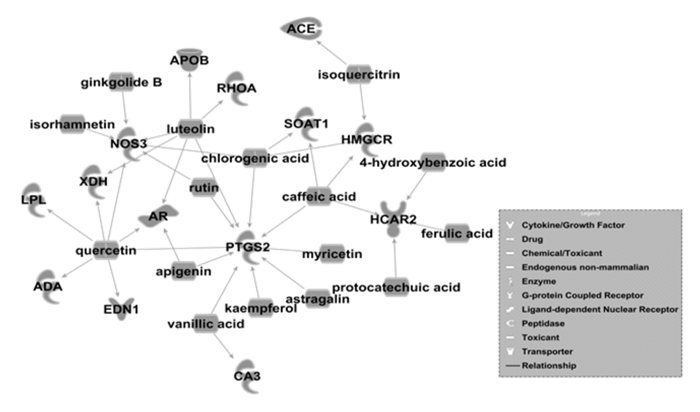
|
| 图 1 银杏叶提取物与心脑血管疾病共同靶点之间的关系 Fig. 1 Relationship between common target of Ginkgo biloba extract and cardiovascular and cerebrovascular diseases |
AS的特征性病理过程涉及血管内皮细胞受损、炎症、氧化应激损伤、脂质浸润和血栓形成等[35]。研究发现,硬化血管特别是在AS的高发部位一氧化氮合酶(eNOS)表达下调,提示血管内皮细胞产生NO减少导致的血管功能不良是AS形成原因之一。用EGb处理人脐静脉内皮细胞后可增加细胞中eNOS的表达,促进NO的产生,从而保护血管内皮细胞功能[36]。
AS斑块形成与破裂所致的急性心脑血管事件严重危害人类生命健康,预防和延缓AS斑块进展显得尤为重要。研究表明[37-38],缝隙连接蛋白(Cx)[37]重构参与了动脉粥样硬化形成各过程,RhoA的激活会影响体内和体外Cx43的表达量,Cx43过表达可促进血管内膜损伤,增加白细胞向内膜迁移和聚集,并能增加平滑肌细胞的迁移和增殖及斑块的不稳定性。在对高脂肪饮食诱导兔主动脉粥样硬化的研究中发现,EGb显著抑制RhoA活性进而减少斑块中Cx43的表达,从而抑制AS的病变发展[39]。EGb通过不同的治疗途径来防治AS是防治心脑血管疾病的根本和基础,体现了中医学“辨证论治”中异病同治的治疗原则。
5 展望本文通过对银杏叶提取物相关文献进行检索发现,银杏叶提取物对预防和治疗心脑血管疾病方面有着十分显著的疗效。从已发表文章数量上分析,银杏叶提取物防治脑血管疾病的相关研究要远多于防治心血管疾病的相关研究。在成分上,黄酮类化合物的数量也远多于内酯类化合物。从网络药理学对两种疾病靶标的分析中发现,两种疾病之间存在着一定的关联性且具有共同靶点,进一步发现银杏叶提取物可针对这些共同靶点发挥防治心脑血管疾病的疗效,体现了中医学“异病同治”治疗原则。在分析结果得到的16个银杏叶提取物活性成分中,黄酮类化合物数量最多。由此推测,银杏叶提取物在防治心脑血管疾病中主要的活性成分是黄酮类化合物。这为后续研究黄酮类化合物单体成分或银杏叶提取物与其他类中药协同配伍防治心脑血管疾病作用机制提供了新的切入点。
| [1] | Unal B, Critchley JA. Explaining the decline in coronary heart disease mortality in England and Wales between 1981 and 2000[J]. Circulation, 2004, 109 (9): 1101–1107. DOI:10.1161/01.CIR.0000118498.35499.B2 |
| [2] | Naghavi M, Wang H, Lozano R, et al. Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990-2013:a systematic 2013[J]. Lancet, 2015, 385 (9963): 117–171. DOI:10.1016/S0140-6736(14)61682-2 |
| [3] | Jauch EC, Saver JL, Adams HP, et al. Guidelines for the early management of patients with acute ischemic stroke:a guideline for healthcare professionals from the American Heart Association/American Stroke Association[J]. Stoeke, 2013, 44 (3): 870–947. |
| [4] | Chen J, Cui C, Yang X, et al. MiR-126 Affects brain-heart interaction after cerebral ischemic stroke[J]. Transl Stroke Res, 2017, 8 (4): 1–12. |
| [5] | Finsterer J, Wahbi K. Cardiac disease in brain-heart disorders[J]. Acta Cardiologic, 2016, 71 (4): 389–394. DOI:10.1080/AC.71.4.3159700 |
| [6] | 朱敬, 朱翰学. 论中医"证"及"辨证论治"[J]. 中华中医药杂志, 2017, 32 (1): 21–24. |
| [7] | Sacco RL, Kasner SE, Broderick JP, et al. An updated definition of stroke for the 21st century:a statement for healthcare professionals from the American Heart Association[J]. Storke, 2013, 44 (7): 2064. |
| [8] | Nash KM, Shah ZA. Current Perspectives on the beneficial role of ginkgo biloba in neurological and cerebrovascular disorders[J]. Libertas Academica, 2015, 10 (10): 1–9. |
| [9] | Wu Y, Sun J, George J, et al. Study of neuroprotective function of Ginkgo biloba extract (EGb761)derived-flavonoid monomers using a three-dimensional stem cell-derived neural model[J]. Biotechnol Prog, 2016, 32 (3): 735–744. DOI:10.1002/btpr.2255 |
| [10] | Zhao Q, Gao C, Cui Z. Ginkgolide A reduces inflammatory response in highglucose-stimulated human umbilical vein endothelial cells through STAT3-mediated pathway[J]. Int Immunopharmacol, 2015, 25 (2): 242–248. DOI:10.1016/j.intimp.2015.02.001 |
| [11] | Song Y, Zeng Z, Jin C, et al. Protective effect of ginkgolide B against acute spinal cord injury in rats and its correlation with the Jak/STAT signaling pathway[J]. Neurochem Res, 2013, 38 (3): 610–619. DOI:10.1007/s11064-012-0959-y |
| [12] | Allais G, D'Andrea G, Maggio M, et al. The efficacy of ginkgolide B in the acute treatment of migraine aura:an open preliminary trial[J]. Neurol Sci, 2013, 34 (1): 161–163. |
| [13] | 杨鹏飞, 陈卫东. 银杏内酯B药理作用研究进展[J]. 安徽中医学院报, 2012, 3 (5): 86–89. |
| [14] | Wittwer T, Grote M, Oppelt P, et al. Impact of PAF antagonist BN 52021(ginkolide B) on post-ischemic graft function in clinical lung transplantation[J]. J Heart Lung Transplant, 2001, 20 (3): 358–363. DOI:10.1016/S1053-2498(00)00226-6 |
| [15] | Esposito M, Carotenuto M. Ginkgolide B complex efficacy for brief prophylaxis of migraine in school-aged children:an open-label study[J]. Neurol Sci, 2011, 32 (1): 79–81. DOI:10.1007/s10072-010-0411-5 |
| [16] | Susanna U, Licia G. Gingkolide B as migraine preventive treatment in young age:results at 1-year follow-up[J]. Neurol Sci, 2011, 32 (1): 197–199. |
| [17] | Cho HJ, Shon YH. Ginkgolide C Inhibits Platelet Aggregation in cAMP-and cGMP-Dependent Manner by Activating MMP-9[J]. Biol Pharm Bull, 2007, 32 (12): 2340–2344. |
| [18] | Category AML, Ginkgolide C. Suppresses Adipogenesis in 3T3-L1 adipocytes via the AMPK signaling pathway[J]. eCAM, 2015 (2015): 298635. |
| [19] | van Beek TA, Montoro P. Chemical analysis and quality control of Ginkgo biloba leaves, extracts, and phytopharmaceuticals[J]. J Chromatogr A, 2009, 1216 (11): 2002–2032. DOI:10.1016/j.chroma.2009.01.013 |
| [20] | Jiang M, Li J, Peng Q, et al. Neuroprotective effects of bilobalide on cerebral ischemia and reperfusion injury are associated with inhibition of pro-inflammatory mediator production and down-regulation of JNK1/2 and p38 MAPK activation[J]. J Neuroinflammation, 2014, 11 (1): 167. DOI:10.1186/s12974-014-0167-6 |
| [21] | Priyanka A, Nisha VM, Anusree SS, et al. Bilobalide attenuates hypoxia induced oxidative stress, inflammation, and mitochondrial dysfunctions in 3T3-L1 adipocytes via Its antioxidant potential[J]. Free Radic Res, 2014, 48 (10): 1206–1217. DOI:10.3109/10715762.2014.945442 |
| [22] | Goldie M, Dolan S. Bilobalide, a unique constituent of Ginkgo biloba, inhibitsinflammatory pain inrats[J]. Behav Pharmacol, 2013, 24 (4): 298–306. DOI:10.1097/FBP.0b013e32836360ab |
| [23] | Qiao ZY, Huang JH, Ma JW, et al. Ginkgo biloba extract reducing myocardium cells apoptosis by regulating apoptotic related proteins expression in myocardium tissues[J]. Mol Biol Rep, 2014, 41 (1): 347–353. DOI:10.1007/s11033-013-2868-9 |
| [24] | Zhao X, Yao H, Yin HL, et al. Ginkgo biloba Extract and Ginkgolide Antiarrhythmic Potential by Targeting hERG and ICa-L Channel[J]. J Pharmacol Sci, 2013, 123 (4): 318–327. DOI:10.1254/jphs.13118FP |
| [25] | Li W, Luo Z, Liu X, et al. Effect of Ginkgo biloba extract on experi mental cardiac remodeling[J]. BMC Complement Altern Med, 2015, 15 (1): 227–236. DOI:10.1186/s12906-015-0739-8 |
| [26] | Sun L, Zhuang W. The effect of injection of EGb 761 into the lateral ventricle on hippocampal cell apoptosisand stem cell stimulation in situ of the ischemic/-reperfusion rat model[J]. Neurosci Lett, 2013 (355): 2123–2128. |
| [27] | 柯俊龙, 许志恩, 何来鹏. 舒血宁注射液对脑梗塞患者血小板活化状态的影响[J]. 现代生物医学进展, 2012, 10 (2): 324–326. |
| [28] | 李季泓. 银杏黄酮联合奥扎格雷钠对急性脑梗死患者血清HIF-1α、TNF-α及Caspase-3的影响[J]. 长春中医药大学学报, 2016, 32 (1): 91–93. |
| [29] | 魏斌, 魏钧伯. 人外周血氧化低密度脂蛋白浓度与血管紧张素转化酶活性相关性分析[J]. 世界临床药物, 2016, 37 (7): 484–487. |
| [30] | Barton M, Traupe T, Haudenschild CC. Endothelin, hyper cholester-olemiaand atherosclerosis[J]. Coron Artery Dis, 2003, 14 (7): 477–490. DOI:10.1097/00019501-200311000-00002 |
| [31] | Li Y, He PP, Zhang DW, et al. Lipoprotein lipase:from gene to atherosclerosis[J]. Atherosclerosis, 2014, 237 (2): 597–608. DOI:10.1016/j.atherosclerosis.2014.10.016 |
| [32] | 徐启华, 曹济民. 内皮型一氧化氮合酶在动脉粥样硬化中的作用[J]. 医学研究杂志, 2010, 39 (8): 95–97. |
| [33] | Baldan A, Ferronato S, Olivato S, et al. Cyclooxygenase 2, toll-like receptor 4 and interleukin 1βmRNA expression in atherosclerotic plaques of type 2 diabetic Patients[J]. Inflamm Res, 2014, 63 (10): 851–858. DOI:10.1007/s00011-014-0759-8 |
| [34] | 李南南, 军平, 仲爱芹, 等. RhoA/ROCK信号通路在动脉粥样硬化发生中的作用[J]. 基础医学与临床, 2014, 34 (10): 1421–1425. |
| [35] | Wu Y, LI S, Cui W, et al. Ginkgo biloba extract improves coronary blood flow inpatientswith coronaryarterydisease:role of endothelium-dependent Vasodilation[J]. Planta Med, 2007, 73 (7): 624–628. DOI:10.1055/s-2007-981536 |
| [36] | Taniguchi T, Agemori M, Kameshita I, et al. Activation of Krüppel-Like Factor 2 with Ginkgo Biloba extract induces eNOS expression and increases NO production in cultured human umbilical endothelial cells[J]. Acta Cardiol Sin, 2014, 30 (3): 215–222. |
| [37] | 陈敏, 蒋丽萍, 洪涛. 缝隙连接蛋白在动脉粥样硬化形成和防治中的作用[J]. 中国药理学通报, 2010, 26 (10): 1271–1274. |
| [38] | Wang L, Liu S, Zhang H, et al. Rho Aactivity increased in myocardium of arrhythmogenic cardiomyopathy patientsand affected connexin 43 protein expression in HL-1cells[J]. Int J Clin Exp Med, 2015, 8 (8): 12906–12913. |
| [39] | Wei JM, Wang X, Gong H, et al. Ginkgo suppresses atherosclerosis through downregulating the expression of connexin 43 in rabbits[J]. Arch Med Sci, 2013, 9 (2): 340–346. |
2. Tianjin International Joint Academy of Biomedicine, Tianjin 300457, China
 2018, Vol. 35
2018, Vol. 35