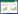文章信息
- 朱涛, 张吉桂
- ZHU Tao, ZHANG Jigui
- 萝卜硫素对人结肠癌HT-9细胞增殖、凋亡及PI3K/Akt信号通路的影响
- Impacts of sulforaphane on proliferation, apoptosis and PI3K/Akt pathway of human colon cancer HT-9 cells
- 天津中医药, 2018, 35(10): 774-777
- Tianjin Journal of Traditional Chinese Medicine, 2018, 35(10): 774-777
- http://dx.doi.org/10.11656/j.issn.1672-1519.2018.10.15
-
文章历史
- 收稿日期: 2018-05-15
2. 恩施土家族苗族自治州中心医院内镜中心, 恩施 445000
萝卜硫素(SFN)主要提取于十字花科蔬菜中的一种异硫氰酸酯类活性物质,包括西兰花、花椰菜及甘蓝菜等[1]。近年来较多的报道阐述了萝卜硫素可以预防、延缓及逆转肿瘤发生之前的病理改变,并且对抑制多种肿瘤细胞增殖表现出较好的药理作用[2-5],也许会成为临床上常用的抗肿瘤药物。结肠癌是发生发展在结肠部位的一种常见消化道恶性肿瘤,其发生率在消化道恶性肿瘤中占据第3位[6]。流行病学调查发现,结肠癌在中国的发病率和病死率每年呈上升趋势,达到或超过了西方发达国家的水平[7]。研究发现,磷脂酰肌醇激酶/蛋白激酶B(PI3K/Akt)信号通路对肿瘤细胞的增殖、分化及和化疗敏感性起着重要的作用,并且结肠癌细胞中PI3K/Akt的异常激活参与了结肠癌的启动[8-9]。然而,有报道阐述萝卜硫素可以通过抑制PI3K/Akt信号通路活化而改善细胞氧化应激损伤[10],因此,笔者探讨PI3K/Akt信号通路在萝卜硫素诱导结肠癌细胞(HT-9)凋亡中的作用。
1 材料及方法 1.1 材料人结肠癌细胞株HT-9(美国ATCC公司);萝卜硫素(上海宝曼生物科技有限公司,批号:4478-93-7,纯度≥99%);DMEM培养基及0.25%胰酶(上海谷歌生物有限公司);胎牛血清(美国Gibco公司,批号:110524);CCK8增殖和毒性检测试剂盒(江苏碧云天生物科技研究所,批号:WH1175);PI细胞凋亡检测试剂盒(江苏凯基生物有限公司,批号:KGA106);BCA蛋白测定试剂盒(上海威奥生物科技有限公司,批号:WB0123);SDS-PAGE试剂盒(武汉谷歌生物有限公司,批号:P1320);兔抗人PI3K、Akt、p-Akt、Bax、Bcl-2及β-actin等多克隆一抗(英国Abcam公司),HRP标记山羊抗兔IgG(武汉谷歌生物科技有限公司)。
1.2 细胞培养与药物处理HT-9细胞用DMEM完全培养基进行培养,包含10%胎牛血清和1%青霉素-链霉素,然后置于37 ℃、5% CO2的恒湿培养箱中进行培养。待细胞生长至培养瓶底的90%左右时便可进行消化传代培养。然后取对数生长期的细胞接种于96孔板或6孔板,待细胞贴壁后加入不同浓度的萝卜硫素(10、20、40 mg/L)处理细胞,再继续后续实验。
1.3 CCK8实验检测细胞增殖抑制率取对数生长期的HT-9细胞制备成悬液,然后以1×104/孔细胞数接种于96孔板中,培养过夜后,吸尽旧培养基,然后加入含不同浓度萝卜硫素(10、20、40 mg/L)的新鲜培养基继续孵育处理24、48、72 h后,除去板内培养基,然后每孔加入含10 μL CCK8试剂的无血清培养再继续孵育1 h,酶标仪于540 nm波长处检测每孔的吸光度值。
1.4 IP染色观察细胞凋亡情况取对数生长期的HT-9细胞制备成悬液,然后以1×105/孔细胞数接种于6孔板中,培养过夜后,吸尽旧培养基,然后加入含不同浓度萝卜硫素(10、20、40 mg/L)的新鲜培养基继续孵育处理24 h后,除去板内培养基,用磷酸盐缓冲液(PBS)清洗细胞3次,加入不含EDTA的胰酶进行消化收集细胞,再用PBS清洗细胞3次,5 000 r/min离心6 min,收集细胞。然后将细胞重悬后加入5 μL PI混匀,利用流式细胞仪检测细胞凋亡率。
1.5 Western Blot检测蛋白表达取对数生长期的HT-9细胞制备成悬液,然后以1×105/孔细胞数接种于6孔板中,培养过夜后,吸尽旧培养基,然后加入含不同浓度萝卜硫素(10、20、40 mg/L)的新鲜培养基继续孵育处理24 h后,收集细胞裂解,检测蛋白浓度,然后每孔以50 μg蛋白量上样进行凝胶电泳分离,电压设置为70 V;待分离完成后进行转膜,电流设定为275 mA、时间为70 min。接着将膜放入5%脱脂奶粉中封闭1 h,孵育一抗过夜,用TBST洗膜3次后室温条件孵育对应二抗1 h,再次洗膜3次,便可进行蛋白表达分析。
1.6 统计学分析采用SPSS 20.0软件进行统计分析,实验数据用均数±标准差(x±s)表示,组间比较采用单因素方差分析检验,组间两两比较若方差齐采用LSD法,若方差不齐采用Dunnett's T3法,P<0.05表示差异具有统计学意义。
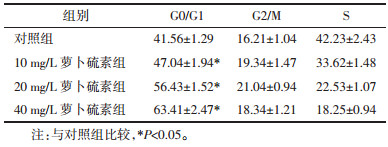
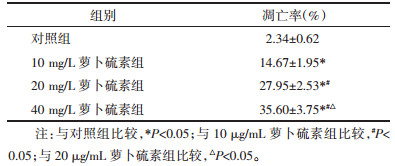
2 结果 2.1 萝卜硫素抑制HT-9细胞增殖不同剂量的萝卜硫素作用HT-9细胞24、48、72 h后,用CCK8试剂对HT-9细胞的增殖情况进行评估。无论药物作用细胞的时间有多久,HT-9细胞增殖抑制率相对于对照组均显著升高(P<0.05);而且随着药物剂量的升高,细胞增殖受到的抑制效果更为显著,表现出一定的剂量依赖性。除此之外,还评价了萝卜硫素作用不同时间后对细胞增殖的影响,结果表明随着作用时间的延长,细胞的增殖抑制率明显升高,组间两两比较均有统计学差异(P<0.05)。见表 1。
|
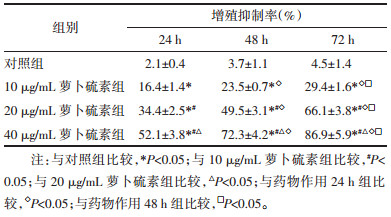
不同剂量的萝卜硫素作用HT-9细胞24 h后,采用流式细胞仪对细胞的凋亡情况进行评估。随着药物剂量的升高,细胞凋亡率也随之显著上升,呈现出一定的剂量依赖性。药物组中细胞的凋亡率均显著高于对照组,差异均有统计学意义(P<0.05);不同剂量药物组间两两比较发现,它们之间的细胞凋亡率均表现出统计学差异(P<0.05)。萝卜硫对HT-9细胞周期的影响,提示萝卜硫素可以让HT-9细胞停留在G0/G1期,诱导其凋亡。见图 1,表 2,表 3。
|
| 图 1 萝卜硫素对HT-9细胞凋亡的影响 Fig. 1 Effect of sulforaphane on the apoptosis of HT-9 cells |
|
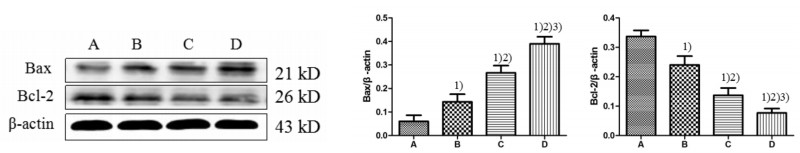
不同剂量的萝卜硫素作用HT-9细胞24 h后,提取细胞蛋白进行免疫印迹分析。结果提示细胞中促凋亡蛋白Bax表达水平随着药物剂量增加而显著升高,与对照组比较差异均有统计意义(P<0.05);而抗凋亡蛋白Bcl-2表达量则随药物剂量升高显著降低,与对照组比较差异均有统计学意义(P<0.05);上述两种蛋白的表达水平均呈现出药物剂量依赖性。见图 2。
|
| 图 2 萝卜硫素对Bax、Bcl-2蛋白表达水平的影响 Fig. 2 Effect of sulforaphane on the expression of Bax, Bcl-2 protein A:对照组;B:10 μg/mL萝卜硫素组;C:20 μg/mL萝卜硫素;D:40 μg/mL萝卜硫素。1)与对照组比较,P<0.05;2)与10 μg/mL萝卜硫素组比较,P<0.05;3)与20 μg/mL萝卜硫素组比较,P<0.05 |
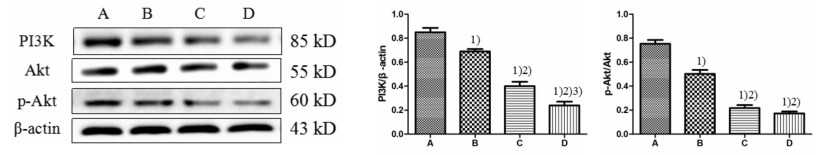
不同剂量的萝卜硫素作用HT-9细胞24 h后,提取细胞蛋白进行PI3K/Akt信号通路活化程度分析。Western Blot结果显示PI3K表达水平及Akt的磷酸化水平均随萝卜硫素浓度升高而显著降低,与对照组比较差异均有统计学意义(P<0.05)。提示,萝卜硫素可以通过抑制PI3K/Akt信号通路的活化,从而诱导HT-9细胞的凋亡。见图 3。
|
| 图 3 萝卜硫素对PI3K/Akt信号通路的影响 Fig. 3 Effect of sulforaphane on the PI3K/Akt signaling pathway A:对照组;B:10 μg/mL萝卜硫素组;C:20 μg/mL萝卜硫素;D:40 μg/mL萝卜硫素。1)与对照组比较,P<0.05;2)与10 μg/mL萝卜硫素组比较,P<0.05;3)与20 μg/mL萝卜硫素组比较,P<0.05 |
早期报道萝卜硫素能够通过PI3K/Akt信号通路诱导神经母细胞凋亡和S期阻滞,可能成为一种新的抗肿瘤药物[11],其中还发现萝卜硫素还可以通过诱导Nrf2蛋白表达,抑制Keap-1蛋白表达。本研究发现萝卜硫素能够阻滞人结肠癌HT-9细胞生长并诱导细胞增殖率降低,其作用效果表现出明显的时间、剂量依赖性。流式细胞术对HT-9细胞凋亡检测发现,萝卜硫素能够显著诱导细胞凋亡的发生,并随着药物浓度升高而显著增强,主要将细胞停留在G0/G1期。
在肿瘤细胞生长、增殖及凋亡的重要病理环节过程中,PI3K/Akt信号通路的异常激活在肿瘤信号传导过程中扮演着重要的角色。研究发现抑制PI3K蛋白的激活能让耐药肿瘤细胞对化疗药物敏感[12-13],Akt在PI3K信号传导中起着枢纽作用,其中Akt的磷酸化可以活化或者阻滞多条信号传导,如Bcl-2/Bax、mTOR及Caspase-9等。其中Bcl-2/Bax通路蛋白是在细胞凋亡发生过程中起着关键性的作用,也是Akt信号传导的重要下游靶标[14]。Bcl-2家族包括抗凋亡相关蛋白(如Bcl-2)和促凋亡相关蛋白(如Bax)等,在细胞凋亡中起着关键作用,其中Bcl-2/Bax蛋白含量的平衡在细胞是否发生凋亡中起着决定性作用。p-Akt可以分布在线粒体、内质网及细胞核的细胞器内,能够和它的特异性底物发生相互作用,能够调控Bcl-2/Bax蛋白的平衡,以达到控制细胞周期及细胞增殖。目前,PI3K/Akt信号通路在较多的肿瘤细胞中均表现出异常激活,其中PI3K及p-Akt均高度表达。本实验结果也发现萝卜硫素可以明显降低PI3K及p-Akt水平,还抑制了抗凋亡蛋白Bcl-2的表达,并诱导了促凋亡蛋白Bax的表达。于是,萝卜硫素可以阻滞Akt的信号传导,使Bcl-2/Bax蛋白表达量出现失衡,活化凋亡信号,诱导结肠癌细胞的凋亡。
综上所述,萝卜硫素能够抑制结肠癌细胞的增殖,诱导其凋亡,其作用机制可能与抑制PI3K/Akt信号通路的活化相关。
| [1] | Zhang Y, Talalay P, Cho CG, et al. A major inducer of anticarcinogenic protective enzymes from broccoli:Isolation and elucidation of structure[J]. Proc Natl Acad Sci USA, 1992, 89 (6): 2399–2403. DOI:10.1073/pnas.89.6.2399 |
| [2] | Wang L, Tian Z, Yang Q, et al. Sulforaphane inhibits thyroid cancer cell growth and invasiveness through the reactive oxygen species-dependent pathway[J]. Oncotarget, 2015, 6 (28): 25917–25931. |
| [3] | Alumkal JJ, Slottke R, Schwartzman J, et al. A phase Ⅱ study of sulforaphane-rich broccoli sprout extracts in men with recurrent prostate cancer[J]. Invest New Drugs, 2015, 33 (2): 480–489. DOI:10.1007/s10637-014-0189-z |
| [4] | Appari M, Babu KR, Kaczorowski A, et al. Sulforaphane, quercetin and catechins complement each other in elimination of advanced pancreatic cancer by miR-let-7 induction and K-ras inhibition[J]. Int J Oncol, 2014, 45 (4): 1391–1400. DOI:10.3892/ijo.2014.2539 |
| [5] | Jo GH, Kim GY, Kim WJ, et al. Sulforaphane induces apoptosis in T24 human urinary bladder cancer cells through a reactive oxygen species-mediated mitochondrial pathway:the involvement of endoplasmic reticulum stress and the Nrf2 signaling pathway[J]. Int J Oncol, 2014, 45 (4): 1497–1506. DOI:10.3892/ijo.2014.2536 |
| [6] | 孙敬国, 蒋晓忠. Twist蛋白表达与结肠癌发生发展的关系研究[J]. 中国全科医学, 2011, 4 (14): 1311–1314. |
| [7] | 郑灵巧, 马彦明. 大肠癌发病率不断攀升[J]. 老年健康, 2011, 1 (5): 4–9. |
| [8] | Chen J, Shao R, Li F, et al. PI3K/Akt/mTOR pathway dual inhibitor BEZ235 suppresses the stemness of colon cancer stem cells[J]. Clin Exp Pharmacol Physiol, 2015, 42 (12): 1317–1326. DOI:10.1111/1440-1681.12493 |
| [9] | Lee YJ, Jeong HY, Kim YB, et al. Reactive oxygen species and PI3K/Akt signaling play key roles in the induction of Nrf2-driven heme oxygenase-1 expression in sulforaphane-treated human mesothelioma MSTO-211H cells[J]. Food Chem Toxicol, 2012, 50 (2): 116–123. DOI:10.1016/j.fct.2011.10.035 |
| [10] | 任杰, 蒋何菲, 赵娟, 等. 萝卜硫素及其衍生物BSFN通过激活PI3K/Akt途径诱导SH-SY5Y细胞凋亡[J]. 中国药学杂志, 2014, 49 (20): 1813–1819. |
| [11] | Porta C, Paglino C, Mosca A. Targeting PI3K/Akt/mTOR signaling in cancer[J]. Front Oncol, 2014, 4 (12): 64–72. |
| [12] | Fischer B, Frei C, Moura U, et al. Inhibition of phosphoinositide-3 kinase pathway down regulates ABCG2 function and sensitizes malignant pleural mesothelioma to chemotherapy[J]. Lung Cancer, 2012, 78 (1): 23–29. DOI:10.1016/j.lungcan.2012.07.005 |
| [13] | Rahmani M, Aust MM, Attkisson E, et al. Dual inhibition of Bcl-2 and Bcl-xL strikingly enhances PI3K inhibition induced apoptosis in human myeloid leukemia cells through a GSK3-and Bim-dependent mechanism[J]. Cancer Res, 2013, 73 (4): 1340–1351. DOI:10.1158/0008-5472.CAN-12-1365 |
| [14] | Vachhani P, Bose P, Rahmani M, et al. Rational combination of dual PI3K/mTOR blockade and Bcl-2/-xL inhibition in AML[J]. Physiol Genomics, 2014, 46 (13): 448–456. DOI:10.1152/physiolgenomics.00173.2013 |
2. Endoscopy Center, Central Hospital of Enshi Autonomous Prefecture, Ensh 445000, China
 2018, Vol. 35
2018, Vol. 35