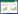文章信息
- 李泽争, 王利, 曹爱丽, 彭文
- LI Zezheng, WANG Li, CAO Aili, PENG Wen
- 白藜芦醇对高糖诱导足细胞损伤的改善作用及机制探讨
- Protective effect and mechanisms of resveratrol on hyperglycemia-induced podocyte apoptosis
- 天津中医药, 2018, 35(10): 778-782
- Tianjin Journal of Traditional Chinese Medicine, 2018, 35(10): 778-782
- http://dx.doi.org/10.11656/j.issn.1672-1519.2018.10.16
-
文章历史
- 收稿日期: 2018-06-08
糖尿病肾病(DN)是糖尿病最常见的微血管并发症,亦是导致终末期肾脏衰竭(ESRD)的重要原因[1-2]。足细胞是一种高度分化的细胞类型,在维持肾小球结构、构成肾小球滤过屏障方面发挥着重要作用。有研究证实,足细胞损伤在DN发展过程中意义重大[3-4]。越来越多的研究证明足细胞数量及形态的变化可预测DN的发生发展,抑制足细胞的损伤可能会阻止或减缓DN的疾病进程,但目前为止足细胞损伤的机制仍不明确,亦缺乏有效防治足细胞损伤的干预手段。
白藜芦醇(RSV)是一种植物抗毒素,有研究发现RSV可显著降低蛋白尿,具有明确的肾脏保护功能,此外其在保护足细胞方面也表现出巨大潜力[5],然而活化过程尚未完全明确。本研究采用体外高糖诱导足细胞损伤模型,观察RSV对足细胞损伤的保护作用及涉及的可能分子机制,以期为临床上防治DN提供理论依据。
1 材料与方法 1.1 实验主要材料FBS、胰酶、RPMI1640培养基(美国Gibco公司);RSV(上海同田生物技术股份有限公司);二甲基亚砜(DMSO)(美国Sigma公司);Annexin V-FITC/PI凋亡检测试剂盒(美国BD公司);dihydroethidium(美国Sigma公司);JC-1、MitoSOX Red (美国Thermos Fisher Scientific公司);β-actin、含半胱氨酸的天冬氨酸蛋白水解酶(caspase)3、caspase 9(美国Cell Signaling Technology公司)。RSV溶于DMSO(终浓度≤0.1%)中,配置成储存液,避光,4℃保存。
1.2 方法 1.2.1 足细胞培养永生化小鼠足细胞株是从H-2Kb-tsA58转基因小鼠肾脏分离后建立的细胞系,由美国Mount Sinai医学院Mundel教授授权,上海交通大学附属第六人民医院汪年松教授转赠,传代数≤15代。
1.2.2 细胞分组及干预方法1) 对照组:5 mmol/L低糖培养液(LG);2)模型组:30 mmol/L高糖培养液(HG);3) RSV干预组:①HG+5 μmol/L RSV;②HG+10 μmol/L RSV,RSV提前干预2 h后高糖孵育48 h。
1.2.3 细胞凋亡检测足细胞接种于6孔板,细胞干预结束后,消化收集细胞,磷酸盐缓冲溶液(PBS)洗2次,加入200 μL 1×Binding Buffer混匀,避光加入5 μL Annexin V,室温放置15 min,加入PI 5 μL,重悬细胞上流式细胞仪进行检测。
1.2.4 ROS检测DHE稀释至无血清培养基,终浓度为10 μmol/L。细胞干预结束后,吸弃培养基,PBS洗涤2次,加入稀释的DHE,37 ℃孵育20 min,PBS洗2次,4%多聚甲醛固定10 min,即刻置荧光显微镜下观察。
1.2.5 JC-1染色足细胞接种于内置无菌细胞爬片的6孔板,干预后吸弃培养基,PBS洗涤2次,加入2 μmol/L JC-1,37 ℃孵育30 min,PBS洗2次,4%多聚甲醛固定10 min,封片,置荧光显微镜下观察。
1.2.6 MitoSOX染色足细胞接种于内置无菌细胞爬片的6孔板,干预后吸弃培养基,PBS洗涤2次,加入稀释的5 μmol/L MitoSOX,37 ℃孵育10 min,PBS洗2次,4%多聚甲醛固定10 min,封片,置荧光显微镜下观察。
1.2.7 Western blot检测细胞干预结束后加入蛋白裂解液(含蛋白酶抑制剂)充分裂解,高速低温离心留取上清,提取蛋白并检测含量,取等量蛋白样品进行SDS-PAGE凝胶电泳,转膜,室温摇床封闭1 h,依次加入一抗(β-actin、caspase 3、caspase 9),4 ℃过夜,加入辣根过氧化物酶标记的二抗室温摇床1 h,在Image QuantLAS 500成像系统中进行显影。以β-actin的蛋白表达为内参照,结果以靶蛋白/内参的灰度比值表示,实验重复3次,取平均值。
1.3 统计学分析采用SPSS 20.0统计分析软件,计量资料以均数±标准差(x±s)形式表示,采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
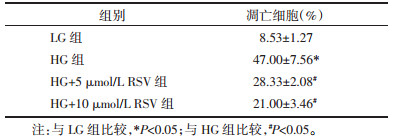
2 结果 2.1 RSV对高糖诱导足细胞的保护作用流式细胞仪检测结果显示,高糖孵育可显著提高足细胞的早期凋亡与晚期凋亡。与HG组相比,RSV干预后,细胞凋亡出现不同程度的抑制,且随着药物浓度升高,抑制作用逐渐增强,差异均具有统计学意义(P<0.05)。见图 1,表 1。
|
| 图 1 RSV对足细胞凋亡的影响 Fig. 1 Effect of RSV on podocyte apoptosis 与LG组比较,#P<0.05;与HG组比较,*P<0.05 |
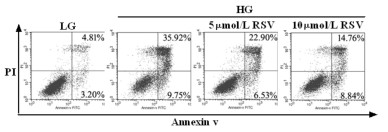
ROS在足细胞损伤中发挥重要作用,本研究采用荧光探针DHE观察足细胞内ROS生成情况。结果显示,与LG组相比,高糖孵育可明显提高细胞内ROS生成,且RSV可剂量依赖性的抑制高糖诱导的ROS表达水平。见图 2。
|
| 图 2 RSV对细胞内ROS生成的影响(倒置荧光显微镜×200) Fig. 2 Effect of RSV on the intracellular ROS generation(inverted fluorescence microscope ×200) |
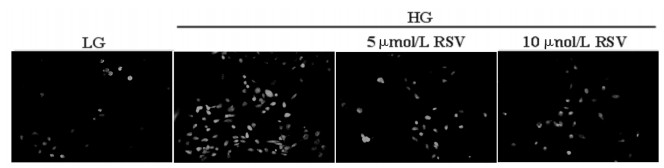
线粒体膜电位下降发生在线粒体功能障碍的早期,本研究以JC-1荧光探针检测线粒体膜电位。当线粒体膜电位较高时,JC-1聚集在线粒体基质中,以聚合体形式呈现,产生红色荧光;当线粒体膜电位较低时,JC-1不能聚集在线粒体基质中,以单体形式呈现,产生绿色荧光。激光共聚焦结果显示,RSV干预后,绿色荧光向红色荧光转变增多,提示RSV可有效抑制高糖诱导的线粒体膜电位下降。见图 3。
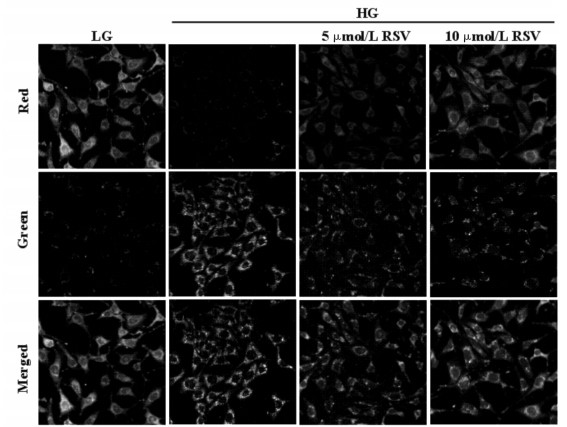
|
| 图 3 RSV对线粒体膜电位的影响(激光共聚焦×400) Fig. 3 Effect of RSV onmitochondrial membrane potential(laser confocal ×400) |
采用线粒体超氧阴离子染料MitoSOX检测线粒体ROS。结果提示高糖可显著提高足细胞线粒体ROS的产生,RSV可剂量依赖性的降低线粒体ROS的表达水平。见图 4。

|
| 图 4 RSV对线粒体ROS的影响(激光共聚焦×400) Fig. 4 Effect of RSV onROS generation inmitochondrial(laser confocal ×400) |
与LG组相比,HG组cleaved caspase 3、cleaved caspase 9表达水平显著上调;随RSV干预浓度的提高,与HG组相比,cleaved caspase 3、cleaved caspase 9表达水平逐渐降低,差异具有统计学意义(P<0.05)。见图 5。
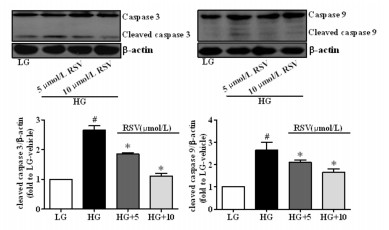
|
| 图 5 RSV对线粒体凋亡途径相关蛋白的影响 Fig. 5 Effect of RSV on protein related to mitochondrial apoptosis pathway 与LG组比较,#P<0.05;与HG组比较,*P<0.05 |
DN是一种糖尿病的长期并发症,以蛋白尿和肾小球硬化为病理特征,临床中约40%的Ⅰ型及30%的Ⅱ型糖尿病患者最终会发展为DN。足细胞又称为脏层肾小球上皮细胞,与内皮细胞、肾小球基底膜共同构成肾小球滤过屏障。研究表明,DN早期便伴有足细胞损伤,表现为足细胞密度的降低和数量的减少。由于足细胞增生分化能力有限,凋亡是足细胞丢失的主要原因。至目前为止,引起足细胞凋亡的因素很多,但机制复杂,是当前肾病学科的研究热点。因此,探讨足细胞凋亡机制及有效干预手段对寻求治疗DN具有重大意义。近年来,RSV用于治疗肾脏疾病越来越受到学者们的关注。有研究证实在STZ诱导的Ⅰ型DN中,RSV可显著降低蛋白尿水平,改善肾脏病理损伤[6]。RSV可通过激活SIRT1/PGC-1α途径,改善线粒体功能障碍,从而减轻醛固酮诱导的蛋白尿及足细胞损伤[7]。探讨RSV对足细胞凋亡的保护作用及潜在分子学机制,为DN的防治研究提供了新方向。
本研究采用体外高糖孵育模拟糖尿病体内环境,结果表明RSV可显著抑制高糖诱导的足细胞凋亡,并呈量效关系,这可能是其可降低蛋白尿的机制之一。同时,实验结果显示RSV可显著降低细胞内及线粒体ROS的合成、提高线粒体膜电位、下调cleaved caspase 3及cleaved caspase 9的表达水平,提示RSV对足细胞的保护作用可能是通过抑制氧化应激,改善线粒体功能障碍实现的。
足细胞作为一种终末分化细胞,对ROS异常敏感,高糖刺激时氧化和抗氧化系统的失衡及ROS产生过多是导致足细胞损伤的主要机制之一[8-9]。ROS不仅可以直接损伤足细胞,还可激活NADPH氧化酶产生更多的ROS,从而形成恶性循环[10]。有学者更是提出在糖尿病早期,高糖即可通过ROS启动足细胞凋亡,诱导其从基底膜脱落,降低肾小球内足细胞数量,出现蛋白尿[11]。以上研究均提示氧化应激可能是DN中足细胞损伤的重要机制之一。本研究中,RSV干预可显著降低细胞内ROS生成,改善高糖诱导的细胞凋亡,表现了显著的抗氧化作用。近年来,RSV的抗氧化作用日益成为肾脏病领域的研究热点,研究显示RSV可显著降低糖尿病大鼠肾组织中ROS及MDA水平,减少细胞凋亡[12]。在高糖刺激的系膜细胞中,RSV可激活SIRT1,减少高糖诱导的氧化应激对线粒体的损伤[13]。可见,RSV作为一种具有抗氧化作用的中药单体,在转化为公认抗氧化剂发面具有巨大潜力。
线粒体是真核细胞能量供应的最重要细胞器,通过氧化磷酸化途径产生机体内大部分ATP,同时它也是ROS生成的主要来源,亦是ROS的作用靶点[14-15]。ROS可损伤线粒体的酶类、脂类和核酸,进一步导致ROS合成增加。同时,ROS还可对线粒体DNA产生氧化损伤,导致线粒体ATP合成减少、线粒体膜电位破坏等结构和功能的改变,因此ROS增多也是线粒体功能障碍的表现之一。综上,氧化应激与线粒体功能密切相关,亦有研究显示高糖诱导的氧化应激是由线粒体依赖的通路介导的。本研究发现RSV干预可显著降低足细胞线粒体内ROS的生成,提高线粒体膜电位,改善线粒体功能障碍。线粒体功能障碍可引发内源性的线粒体凋亡途径,首先表现为线粒体膜通透性转换孔道的开放,进一步引起线粒体膜去极化,凋亡前因子如细胞色素c释放入胞浆,进而激活caspase 3、caspase 9等细胞凋亡蛋白。本实验中,RSV可显著降低cleaved caspase 3及cleaved caspase 9的表达水平,改善足细胞凋亡,提示RSV可通过改善线粒体功能障碍抑制内源性的线粒体凋亡途径。综上所述,RSV可通过抑制氧化应激,改善线粒体功能障碍抑制高糖诱导的足细胞凋亡。然而,RSV如何靶向降低ROS的生成、提高线粒体膜定位、抑制线粒体依赖性的凋亡途径,值得更加深入的探索与研究。
研究结果表明RSV呈浓度依赖性的抑制高糖诱导的足细胞凋亡,其保护作用可能与抑制氧化应激,改善线粒体功能障碍相关。以此推测RSV可用于预防足细胞损伤,在DN的防治方面具有广大空间。当然,这一推论还有待于动物实验及临床研究进一步证实。
| [1] | Jia Z, Sun Y, Yang G, et al. New insights into the PPAR gamma agonists for the treatment of diabetic nephropathy[J]. PPAR Res, 2014 (2014): 818530. |
| [2] | Xue R, Gui D, Zheng L, et al. Mechanistic insight and management of diabetic nephropathy:recent progress and future perspective[J]. J Diabetes Res, 2017 (2017): 1839809. |
| [3] | Brosius FC, Coward RJ. Podocytes, signaling pathways, and vascular factors in diabetic kidney disease[J]. Adv Chronic Kidney Dis, 2014, 21 (3): 304–310. DOI:10.1053/j.ackd.2014.03.011 |
| [4] | Gnudi L, Coward R, Long DA. Diabetic Nephropathy:Perspective on Novel Molecular Mechanisms[J]. Trends Endocrinol Metab, 2016, 27 (11): 820–830. DOI:10.1016/j.tem.2016.07.002 |
| [5] | Wen D, Huang X, Zhang M, et al. Resveratrol Attenuates Diabetic Nephropathy via Modulating Angiogenesis[J]. PLoS ONE, 2013, 8 (12): e82336. DOI:10.1371/journal.pone.0082336 |
| [6] | Ma L, Fu R, Duan Z, et al. Sirt1 is essential for resveratrol enhancement of hypoxia-induced autophagy in the type 2 diabetic nephropathy rat[J]. Pathology-Research and Practice, 2016, 212 (4): 310–318. DOI:10.1016/j.prp.2016.02.001 |
| [7] | Yuan Y, Huang S, Wang W, et al. Activation of peroxisome proliferator-activated receptor-γ coactivator 1α ameliorates mitochondrial dysfunction and protects podocytes from aldosterone-induced injury[J]. Kidney International, 2012, 82 (7): 771–789. DOI:10.1038/ki.2012.188 |
| [8] | Guo Y, Song Z, Zhou M, et al. Infiltrating macrophages in diabetic nephropathy promote podocytes apoptosis via TNF-alpha-ROS-p38MAPK pathway[J]. Oncotarget, 2017, 8 (32): 53276–53287. |
| [9] | Lu H, Li Y, Zhang T, et al. Salidroside reduces high-glucose-induced podocyte apoptosis and oxidative stress via upregulating heme oxygenase-1(HO-1) expression[J]. Med Sci Monit, 2017, 23 (8): 4067–4076. |
| [10] | Sun L, Liu X, Chen X, et al. Curcumin attenuates high glucose-induced podocyte apoptosis by regulating functional connections between caveolin-1 phosphorylation and ROS[J]. Acta Pharmacol Sin, 2016, 37 (5): 645–655. DOI:10.1038/aps.2015.159 |
| [11] | An X, Zhang L, Yuan Y, et al. Hyperoside pre-treatment prevents glomerular basement membrane damage in diabetic nephropathy by inhibiting podocyte heparanase expression[J]. Sci Rep, 2017, 7 (1): 6413. DOI:10.1038/s41598-017-06844-2 |
| [12] | Wu L, Zhang Y, Ma X, et al. The effect of resveratrol on FoxO1 expression in kidneys of diabetic nephropathy rats[J]. Mol Biol Rep, 2012, 39 (9): 9085–9093. DOI:10.1007/s11033-012-1780-z |
| [13] | Xu Y, Nie L, Yin Y G, et al. Resveratrol protects against hyperglycemia-induced oxidative damage to mitochondria by activating SIRT1 in rat mesangial cells[J]. Toxicol Appl Pharmacol, 2012, 259 (3): 395–401. DOI:10.1016/j.taap.2011.09.028 |
| [14] | Ni Z, Tao L, Xiaohui X, et al. Polydatin impairs mitochondria fitness and ameliorates podocyte injury by suppressing Drp1 expression[J]. J Cell Physiol, 2017, 232 (10): 2776–2787. DOI:10.1002/jcp.v232.10 |
| [15] | Yu L, Liu Y, Wu Y, et al. Smad3/Nox4-mediated mitochondrial dysfunction plays a crucial role in puromycin aminonucleoside-induced podocyte damage[J]. Cell Signal, 2014, 26 (12): 2979–2991. DOI:10.1016/j.cellsig.2014.08.030 |
 2018, Vol. 35
2018, Vol. 35