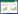文章信息
- 陈贵兵
- CHEN Guibing
- 蟾五草组分散组方筛选及体外药效作用
- Screening of composition of Chanwucao Fraction powder and its pharmacodynamic effects in vitro
- 天津中医药, 2018, 35(10): 789-793
- Tianjin Journal of Traditional Chinese Medicine, 2018, 35(10): 789-793
- http://dx.doi.org/10.11656/j.issn.1672-1519.2018.10.18
-
文章历史
- 收稿日期: 2018-06-22
蟾皮华蟾毒配基组分是一种有效的抗癌药物,但具有肝毒性及免疫抑制[1-4]。因其可导致肝细胞坏死和抑制淋巴细胞活性的毒副作用,严重限制了蟾皮华蟾毒配基组分在抗肿瘤方面的应用。为实现对蟾皮华蟾毒配基组分的减毒增效,从中医经方中发现蟾酥常与甘草、黄芪、五味子配伍以期望达到祛邪不伤正的功效[5-6]。本实验尝试根据组分中药理论及前期实验结果采用中药组分间配伍以优化蟾皮华蟾毒配基组分抗癌作用[1]。
1 材料和方法 1.1 仪器与试剂酶标分析仪(北京普朗);细胞增殖与毒性检测(CCK-8)试剂盒(南京凯基生物)、RPMI-1640、DMEM培养基(美国Sigma公司);蟾皮华蟾毒配基组分、五味子组分、黄芪组分和甘草酸均由中国科学院大连化物所提供。
1.2 细胞株人结直肠腺癌SW620细胞株和人正常肝细胞L02细胞株系解放军总医院普外研究所冻存。人细胞因子诱导性杀伤T细胞(CIK细胞)参照本实验室已有方法分离培养获得[7]。
1.3 药液配制将蟾皮华蟾毒配基组分、五味子组分、黄芪组分和甘草酸以二甲基亚砜(DMSO)充分溶解,加入无血清培养液配制贮存液并用0.22 μm过滤器除菌,-20 ℃避光保存,控制DMSO终浓度小于0.05%。
1.4 细胞培养人SW620和L02细胞株使用高糖DMEM(含10%FBS)完全培养基培养(恒温培养箱条件37 ℃、5% CO2),取对数生长期细胞进行实验或冻存。人CIK细胞的培养参照本实验室已有方法[7],实验前经台盼蓝染色镜下计数确定活细胞数>90%。
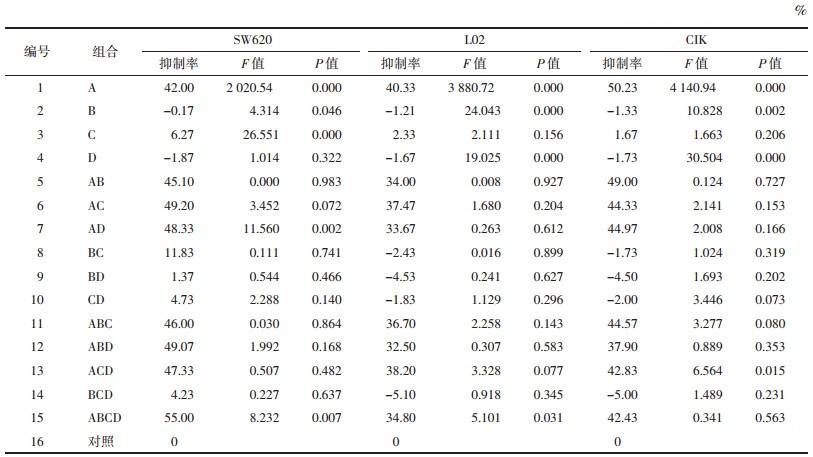
1.5 利用析因设计分析4种药物组分间的交互作用选取蟾皮华蟾毒配基组分(A)、五味子组分(B)、黄芪组分(C)和甘草酸(D)作为研究因素,每个因素取两个水平0和1(0代表无药,1代表有药)。4个因素的水平1分别给定药物终浓度为蟾皮华蟾毒配基组分(A) 1 μg/mL、五味子组分(B) 10 μg/mL、黄芪组分(C) 10 μg/mL和甘草酸(D) 20 μg/mL。将A、B、C、D分别交叉组合(24),共有16个实验方案,分别简写为A、B、C、D、AB、AC、AD、BC、BD、CD、ABC、ABD、ACD、BCD、ABCD和对照组即A0B0C0D0, 见表 2。各组药物剂量为各因素各水平的累加值,然后分别干预SW620、L02和CIK细胞的增殖。按已有实验方法接种、培养细胞[1]。16个实验组均设3个复孔,按时完成加药后培养72 h,取出96孔板光镜下观察细胞生长状态,再每孔加入10 μL CCK-8试剂检测溶液,置于37 ℃孵育4 h,选定酶标分析仪波长450 ηm处测定各孔吸光度A450值。实验重复3次。按下例公式计算细胞增殖抑制率:
|
抑制率=(1-药物组A值/对照组A值)×100%
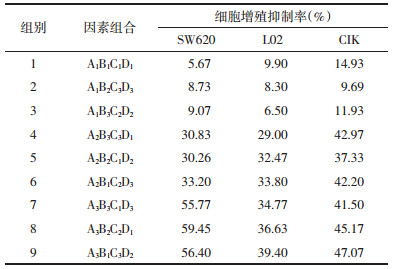
1.6 利用正交设计优化组分间配伍剂量经析因实验表明4种组分间存在交互效应,确定了药味组成,但未能明确药味间的配伍剂量。于是进一步用正交实验优选4种药味组分(因素)间配伍剂量。根据析因实验及前期预实验结果,每个因素设3个水平值(见表 1),选择L9(34)正交表。以SW620、L02、CIK 3种细胞的增殖抑制率为评价指标,其检测方法及计算方法均同上文。为方便后文叙述完成筛选后将方剂命名:蟾五草组分散。
为进一步验证蟾五草组分散的增效减毒作用,选择对数生长期SW620、L02、CIK 3种细胞,按上述方法进行接种至96孔板,培养24 h更换新鲜培养基后分3组(蟾五草组分散组、蟾皮华蟾毒配基组分组、无药对照组)并设空白对照组,每组设3个复孔。分别于加药后第1、3、5天取相应96孔板进行CCK-8检测,具体方法同上。按照以下公式计算细胞存活率:
细胞存活率=(药物组A值-空白对照组A值)/(无药对照组A值-空白对照组A值)×100%
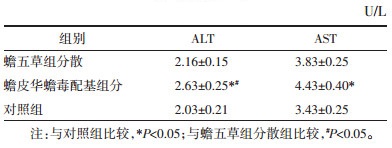
1.8 蟾五草组分散对L02细胞释放丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)的影响消化对数生长期L02细胞,台盼蓝计数后调整细胞浓度至1×106/mL,以每孔100 μL细胞悬液接种至96孔培养板,轻轻摇匀并标记,置于细胞培养箱内。培养24 h后仔细吸弃孔内培养基,更换新鲜DMEM培养基每孔100 μL,分3组(蟾五草组分散组、蟾皮华蟾毒配基组分组、对照组)并分别加入相应药物(其中蟾皮华蟾毒配基组分剂量为2 μg/mL)。然后补充培养基至总体积每孔200 μL,每组3个复孔。继续培养3 d,收集每组3个复孔的上清液于同一1.5 mL EP管离心(1 500 r/min,10min),移液器吸取上清液至另一1.5 mL EP管标记并送检。标本于检验科全自动生化分析仪上检测ALT和AST的含量。实验重复3次。
1.9 统计分析采用SPSS 21.0统计软件进行数据分析。计量资料以均数±标准差(x±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析。析因设计采用析因设计方差分析、正交设计采用直观分析法。P<0.05为差异有统计学意义。
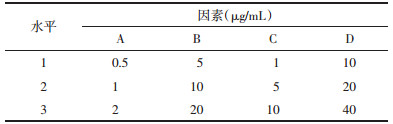
2 结果 2.1 4种药物组分间的交互作用通过对析因设计结果分析,见表 2。首先主体效应检验明确了抑制SW620细胞增殖的主因素是A和C(P<0.01);保护L02和CIK细胞增殖的主因素是B和D(P<0.01);而因素A对3种细胞增殖均有明显抑制作用(P<0.01)。其次主体间交互效应明确了AD和ABCD对SW620细胞增殖有交互作用(P<0.01);ACD和ABCD分别对L02和CIK细胞增殖有交互作用(P<0.05)。综合以上结果鉴于4种组分配伍(ABCD)经交互影响能增强抗肿瘤作用同时降低其毒性,所以药味选择时4种组分均被选用,即选取ABCD组方方案。
2.2 优化组分间配伍剂量析因设计已分析4种组分间的三阶交互作用,此处正交设计仅比较各组合优劣,所以选用较为简便的直观分析法进行优选配伍剂量。具体实验结果见表 3、表 4。首先比较各单因素不同水平对抑制SW620细胞的影响,可以从表 4看出因素A,取A3比取A1和A2的抑制率都高;同理分析因素B、C和D对SW620抑制率最高水平值分别为B2、C2和D3。综合结果后组合得出抑制SW620最佳配伍剂量:A3B2C2D3。再比较4个因素的极差值R时,极差越大提示该因素对该细胞株的影响越大。
|
其次比较各单因素不同水平对抑制L02和CIK细胞的影响。因本实验目的之一是为了降低L02和CIK细胞的抑制率,所以应选择低抑制率的剂量。同理用上述分析方法分析表 4后得出保护L02和CIK细胞的最优配伍剂量分别为:A1B3C3D1和A1B2C1D3。但是本研究以抗肿瘤为主要目的,所以A因素须选择A3水平才能达到较好抑制肿瘤细胞生长(对SW620抑制率>50%)。因素B在保护L02和CIK方面,B2和B3水平作用相近,但B2对SW620增效更明显,所以B因素选择B2。因素C在保护L02和CIK方面,C3和C1水平影响均微弱,但C2对SW620抑制较明显,所以C因素选择C2。因素D在保护L02和CIK方面,D1和D3水平均较好,但两者对L02和CIK作用均不十分明显,但两者剂量差距巨大,且在方剂配伍中D为“使”,所以D因素选择低剂量的D1。综合以上结果并组合最优配伍剂量,即A3B2C2D1(蟾皮华蟾毒配基组分2 μg/mL,五味子组分10 μg/mL,黄芪组分5 μg/mL和甘草酸10 μg/mL,并命名:蟾五草组分散)。
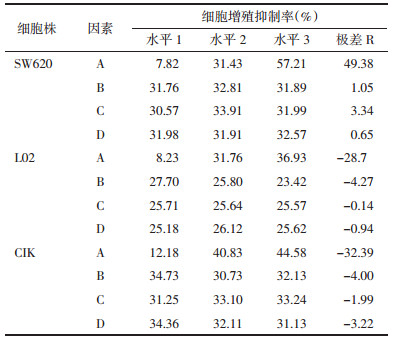
2.3 蟾五草组分散对体外细胞存活的影响与蟾皮华蟾毒配基组分相比,高效低毒的蟾五草组分散对蟾皮华蟾毒配基组分抑制SW620的增效作用集中在第5天(P<0.01);而蟾五草组分散降低蟾皮华蟾毒配基组分对L02、CIK的毒性集中体现在第3天(P<0.05),随着时间延长保护作用减弱,见表 5。
蟾皮华蟾毒配基组分与对照组比较有明显升高ALT、AST的作用(P<0.05),见表 6。蟾五草组分散的L02细胞释放ALT相对蟾皮华蟾毒配基组分有明显下降(P<0.05),但AST只有下降趋势(P > 0.05)。说明蟾五草组分散对其蟾皮华蟾毒配基组分造成的L02细胞损伤有一定保护作用。
|
中药配伍理论是中药方剂最宝贵的方药理论,通过配伍来改变原药物药效而实现增效减毒[8-9]。通过前期实验已明确蟾皮华蟾毒配基组分具有较强抗肿瘤作用,所以是本实验的君药[1]。选用五味子、黄芪、甘草的有效组分与之配伍以期降低其毒副作用,从而达到祛邪不伤正的目的。
利用析因实验分析了药物之间的主体效应和交互效应,明确药味在组方中的必要性。主体效应提示蟾皮华蟾毒配基组分(A)、五味子组分(B)和甘草酸(D)的作用最为突出,但交互效应提示蟾皮华蟾毒配基组分(A)与五味子组分(B)、黄芪组分(C)和甘草酸(D)有交互影响,而且4种药物(ABCD)共同配伍时交互影响有显著意义。文献也报道黄芪和甘草合用能提高机体抗应激能力[10],而五味子和甘草合用能提高肝药酶的代谢[11],说明它们之间同本实验一样存在交互作用。药物组方时4种组分均被选用以增效减毒,并为下一步实验确定了药味组成。
通过正交实验设计来优选4种药味不同剂量水平下的配伍剂量。为合理控制实验规模,各药味(因素)设3个水平。结果提示抑制SW620最优配伍剂量:A3B2C2D3,而保护L02和CIK细胞的最优配伍剂量分别为:A1B3C3D1和A1B2C1D3。陈云华等[12]发现甘草酸对肝细胞的体外最大保护效能33%,不成量效关系。孙华丽等[13]发现五味子成分在25 μg/mL时可以显著降低肝细胞转氨酶。各因素对不同细胞的作用剂量呈不同效应,符合文献提示的不成量效关系。本实验以抗肿瘤为主要目的,所以A为君药并选择A3水平。另外,相似疗效下以低剂量水平更符合用药原则,所以B因素选择B2水平,C因素选择C2水平,D因素选择D1水平。综合各结果最终确定优化配伍剂量为:A3B2C2D1,并命名:蟾五草组分散。然而正交实验是部分水平的组合,且水平数有限又为体外实验,不能全面分析所有组合,可能还有更优配伍需后续深入挖掘。
蟾五草组分散对L02和CIK细胞存活率仅在一定时间范围内可以起到保护作用。在第3天时效果最明显,随后保护作用下降,这可能与细胞代谢障碍有关。在体外实验条件下,药物之间的多重作用下可能细胞功能难以得到连动并长期维持。也可能与细胞长期处于蟾皮华蟾毒配基组分毒性环境下细胞代谢减弱,而其他药物保护作用逐渐失去效应有关。从L02细胞释放ALT、AST浓度变化中,发现蟾五草组分散有保护L02细胞的作用。有文献报道甘草酸降低转氨酶在小鼠体内显著[14-15],而五味子在16.7 μg/mL浓度下可以降低肝细胞转氨酶[13]。由于复方的药代动力学相对单药代谢更为复杂,也许在小鼠体内更能体现出降低转氨酶作用。
通过本实验确定了蟾五草组分散的组成和配伍剂量,初步得到了高效低毒的复方组分群,为进一步观察在小鼠体内药效实验奠定了基础。
| [1] | 陈贵兵, 李荣, 夏绍友. 蟾皮华蟾毒配基组分体外对肿瘤及正常细胞株的抑制作用[J]. 天津中医药大学学报, 2017, 36 (2): 128–131. |
| [2] | Li X, Liu Y, Shen A, et al. Efficient purification of active bufadienolides by a class separation method based on hydrophilic solid-phase extraction and reversed-phase high performance liquid chromatography[J]. J Pharm Biomed Anal, 2014, 97 : 54–64. DOI:10.1016/j.jpba.2014.04.015 |
| [3] | 邹振玉.蟾皮抗肿瘤活性组分筛选及荷人结肠癌裸鼠淋巴道化疗的实验研究[D].北京: 中国人民解放军医学院, 2013. |
| [4] | 陈贵兵.复方蟾皮组分注射液的制备及治疗结肠癌的实验研究[D].天津: 南开大学, 2015. |
| [5] | 张觉人. 蟾酥丸[J]. 上海中医药杂志, 1956, 2 (5): 30–32. |
| [6] | 王宇鹏, 马欣, 赵进, 等. 魁英胶囊对放化疗小鼠减毒作用的研究[J]. 西北药学杂志, 2008, 23 (4): 224–226. DOI:10.3969/j.issn.1004-2407.2008.04.019 |
| [7] | 陈贵兵, 徐迎新, 梁凯, 等. 雷公藤生物碱系列组分对人CIK、HCT116及HepG2细胞的增殖抑制作用[J]. 现代中医药, 2014, 34 (3): 76–78. |
| [8] | 李彦文, 李志勇, 刘会永, 等. 中药配伍减毒研究的新思路[J]. 中国实验方剂学杂志, 2012, 18 (20): 321–324. |
| [9] | 位亚丽, 王志国. 中药配伍理论研究[J]. 世界中医药, 2013, 8 (5): 509–511. |
| [10] | 武新华, 白杰, 代红燕. 黄芪、甘草及黄芪甘草合剂对小鼠实验性溃疡作用的比较[J]. 新疆中医药, 1998, 16 (1): 42–43. |
| [11] | 唐静成, 张锦楠, 李亚伟. 五味子和甘草对大鼠肝药酶的诱导作用导致利多卡因药动学的改变[J]. 首都医科大学学报, 2005, 26 (1): 43. DOI:10.3969/j.issn.1006-7795.2005.01.013 |
| [12] | 陈云华, 万新, 孙建宁, 等. 甘草酸、甘草苷、异甘草素对醋氨酚人肝细胞损伤模型的保护作用比较[J]. 中国实验方剂学杂志, 2012, 18 (4): 245–248. DOI:10.3969/j.issn.1005-9903.2012.04.067 |
| [13] | 孔华丽, 闫亮, 段惠娟. 五味子醇提取物保肝作用成分分析[J]. 解放军药学学报, 2010, 26 (1): 27–29. |
| [14] | 张泽生, 崔翠翠, 孙宇. 甘草酸对小鼠酒精性肝损伤的保护作用[J]. 食品科技, 2009, 34 (5): 225–257. |
| [15] | 谢议凤, 刘建国, 刘庆, 等. 异甘草酸镁对小鼠急性酒精性肝损伤的保护作用[J]. 实用医学杂志, 2010, 26 (3): 381–383. DOI:10.3969/j.issn.1006-5725.2010.03.017 |
 2018, Vol. 35
2018, Vol. 35