文章信息
- 刘璐, 曹世杰, 程丽娜, 邱峰, 康宁
- LIU Lu, CAO Shijie, CHENG Lina, QIU Feng, KANG Ning
- 肿瘤坏死因子-α诱导脂肪细胞胰岛素抵抗模型的建立及评价指标
- Establishment and evaluation of tumor necrosis factor-α induced insulin resistance in 3T3-L1 adipocytes
- 天津中医药, 2018, 35(11): 848-853
- Tianjin Journal of Traditional Chinese Medicine, 2018, 35(11): 848-853
- http://dx.doi.org/10.11656/j.issn.1672-1519.2018.11.14
-
文章历史
- 收稿日期: 2018-07-02
2. 天津市现代中药重点实验室, 天津 300193;
3. 天津中医药大学中药学院中药化学教研室, 天津 300193
肥胖和2型糖尿病均与胰岛素抵抗关系密切[1]。在糖尿病的发展中,脂肪组织发挥着重要的调节作用,炎症因子与脂肪组织内分泌、免疫系统相互作用,引起胰岛素抵抗,最终导致2型糖尿病发生[2]。研究表明,促炎细胞因子肿瘤坏死因子-α(TNF-α)可导致脂肪组织或系统性炎症的产生,最终可能引起胰岛素抵抗[3-4],可用于建立体外胰岛素抵抗模型。然而,纵观已发表的有关TNF-α诱导的胰岛素抵抗造模文献[5-8],有关TNF-α剂量及作用时间对造模结果的影响以及模型建成的评价指标尚不完全清楚。
据报道,在胰岛素刺激下,脂肪细胞中的葡萄糖转运体4(GLUT4)会从细胞内转位至细胞膜上,而在2型糖尿病中这种转位功能会减弱[9],因此,本研究采用TNF-α体外诱导法建立3T3-L1脂肪细胞胰岛素抵抗模型,考察TNF-α造模用药剂量及作用时间,并以GLUT4蛋白表达结合膜转位的变化作为胰岛素抵抗模型是否建立的指标。
1 材料 1.1 细胞小鼠前脂肪细胞3T3-L1购于北京医学科学院基础医学研究所。
1.2 试剂DMEM培养基(Gibco);胰蛋白酶(BIOSHARP);胎牛血清(TBD);胰岛素(丹麦诺和诺德公司);地塞米松(Sigma);1-甲基-3-异丁基-黄嘌呤(Sigma);罗格列酮(Sigma);TNF-α(Pepro Tech);葡萄糖检测试剂盒(北京普利莱公司);BCA试剂盒(Solarbio);抗体:GLUT4(SAB),辣根过氧化酶标记的二抗(中杉金桥公司)。
1.3 仪器二氧化碳培养箱(上海力申有限公司);酶联免疫分析仪(美国BioTek);倒置显微镜(Nikon);Operetta高内涵筛选系统(Perkin Elmer)。
2 方法 2.1 3T3-L1前脂肪细胞的培养和诱导分化当3T3-L1前脂肪细胞贴壁生长至铺满培养瓶瓶底时,使细胞接触抑制48 h,然后进行诱导分化,将细胞培养液换成含有0.5 mmol/L的3-异丁基-1-甲基黄嘌呤、1 μmol/L的地塞米松、10 μg/mL的胰岛素、3 μmol/L的罗格列酮和10 %胎牛血清的DMEM高糖培养基。孵育48 h后将培养液换成含有10 μg/mL的Insulin、3 μmol/L的罗格列酮和10%胎牛血清的DMEM高糖培养基再孵育48 h后换液,换成含有10%胎牛血清的DMEM高糖培养基,每48 h换液1次,直至80%以上的细胞分化成熟。
2.2 油红O染色法鉴定脂肪细胞将诱导分化成熟的脂肪细胞用磷酸缓冲盐溶液(PBS)洗3次,然后用10%的甲醛溶液室温固定1 h,移去固定液后用PBS洗3次,晾干细胞。加入3 mg/mL用异丙醇溶解的油红O染液,室温染色10 min,然后用水洗至少3次,每次5 mL,洗去残渣和细胞缝隙中的染料,在倒置显微镜下观察并拍照。
2.3 TNF-α诱导脂肪细胞胰岛素抵抗取诱导分化成熟的3T3-L1脂肪细胞接种于96孔培养板中,设立4个组,分别是:空白对照组、空白对照加胰岛素组、模型组和模型加胰岛素组。细胞贴壁后,将培养液换为含有0.5%牛血清白蛋白的无血清DMEM高糖培养基,于5% CO2培养箱37 ℃孵育8 h,然后将空白对照组的培养液换为含有10%胎牛血清的DMEM高糖培养基,模型组换为加入5、10、15、20、25 ng/mL TNF-α并含有10%胎牛血清的DMEM高糖培养基,分别作用48、72、96 h,期间空白对照组和模型组的培养基每24 h更换1次。最后,弃去原有培养基,用PBS洗1次,将空白对照组和模型组换为无血清低糖DMEM培养基,空白对照加胰岛素组和模型加胰岛素组换为加入含有100 nmol/L胰岛素的无血清低糖DMEM培养基,30 min后吸取上清液,用葡萄糖氧化酶法试剂盒检测上清液中葡萄糖含量。
2.4 TNF-α对3T3-L1脂肪细胞的毒性取已建立好胰岛素抵抗模型的3T3-L1脂肪细胞,吸弃上清液后,PBS清洗1次,然后每孔加入100 μL 5 mg/mL的MTT溶液,在5% CO2培养箱37 ℃孵育2.5 h后,加入150 μL二甲基亚砜溶解,震荡10 min,于490 nm处测定吸光值。
2.5 蛋白免疫印迹法(Western blot)检测GLUT4蛋白在膜上的表达情况细胞造模结束后,空白对照加胰岛素组和模型加胰岛素组分别加100 nmol/L的胰岛素刺激30 min,去除培养液,收取细胞于1.5 mL的离心管中,按照膜蛋白提取试剂盒提取膜蛋白,用BCA试剂盒测定蛋白浓度。依据蛋白浓度取10 μg总蛋白质,以10%的SDS-PAGE胶分离蛋白,然后湿转法(100 V,3 h)将蛋白质转移至PVDF膜上,再用含5%脱脂奶粉的TBST(含0.1%Tween20)室温下封闭2 h后加入GLUT4的一抗,4 ℃过夜,洗膜后加辣根过氧化物酶标记的二抗,室温2 h,充分洗涤后用ECL显影曝光,洗片后用激光扫描仪扫描,使用Image J软件进行灰度分析,目的蛋白的相对含量为样品组灰度/对照组灰度的值。
2.6 高内涵技术检测GLUT4的膜转位取诱导分化好的3T3-L1脂肪细胞,以1×104细胞/孔接种于96孔细胞培养黑板中,TNF-α按照10 ng/mL作用96 h,同时设置空白对照。4%多聚甲醛室温固定30 min,PBS洗3次,5%胎牛血清封闭2 h,加入一抗孵育过夜。PBS洗3次,加入Dylight 550标记的二抗工作液,37 ℃孵育1 h,含0.05% Tween20的PBS洗3次,再用PBS洗3次,加入Hoechst 33342孵育15 min,PBS洗涤细胞3次后,用Operetta高内涵筛选系统进行检测,再通过Perkin Elmer公司提供的Columbus对视野中细胞荧光强度分布结构等信息进行量化统计。
2.7 统计学分析所有实验独立重复操作至少3次,实验结果表示为均数±标准差(x±s)。实验结果采用SPSS 21.0统计学软件进行单因素方差分析。P < 0.05认为差异具有统计学意义。
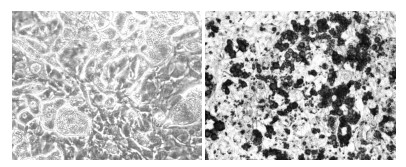
3 结果 3.1 脂肪细胞形态学变化油红O作为脂肪特异性染色剂,能与中性脂肪结合使成熟脂肪细胞中的脂滴着色,从而观察脂肪细胞中脂肪的含量。从油红O染色的结果可看出80%以上的细胞出现较大脂滴,呈现脂肪细胞表型,证明本研究采用的诱导分化方法切实可行。见图 1。
|
| 图 1 3T3-L1脂肪细胞油红O染色图(×200) Fig. 1 Oil red O stained 3T3-L1 adipocytes (×200) |
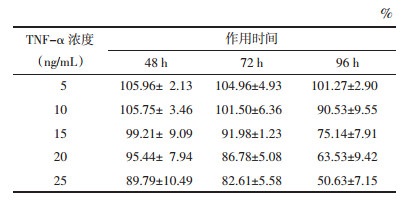
5、10、15、20、25 ng/mL的TNF-α分别作用于3T3-L1脂肪细胞48、72、96 h后,采用噻唑蓝(MTT)法测定细胞的存活率。5、10、15、20和25 ng/mL的TNF-α作用48、72 h及5、10 ng/mL作用96 h时细胞存活率均大于80%。进一步,选择存活率大于80%的剂量和时间,再用100 nmol/L的胰岛素刺激细胞30 min,采用葡萄糖氧化酶法试剂盒检测其对细胞葡萄糖消耗量,见表 1。与未加胰岛素的正常对照组相比,胰岛素刺激能够显著增加细胞对葡萄糖的消耗。然而与加胰岛素的正常对照组相比,胰岛素刺激TNF-α作用96 h组细胞葡萄糖消耗显著降低,并且呈剂量依赖。加胰岛素与未加胰岛素的TNF-α模型组间葡萄糖消耗没有显著差异,以上结果表明,10 ng/mL TNF-α诱导3T3-L1细胞96 h产生明显的胰岛素抵抗。见表 2。
|
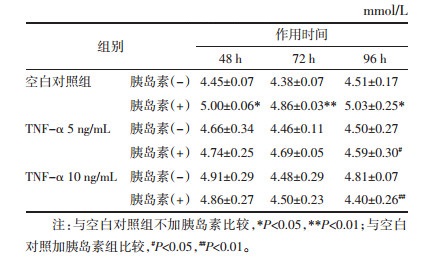
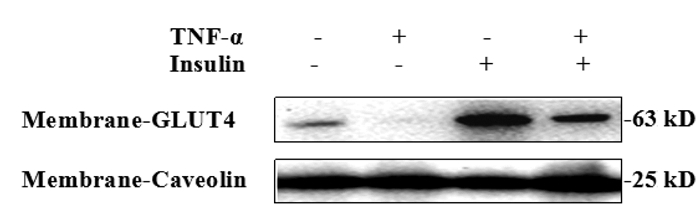
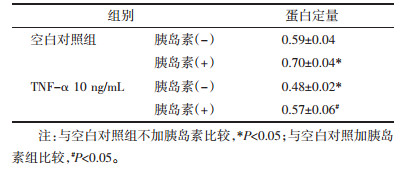
研究表明,GLUT4参与脂肪细胞对葡萄糖摄取,其可能是胰岛素抵抗的重要分子机制[9]。利用Western blot考察TNF-α诱导的3T3-L1脂肪细胞胰岛素抵抗模型中细胞膜GLUT4的表达。由图 2可以看出,以Caveolin为内参,无胰岛素刺激时,与未造模组相比,加TNF-α组细胞膜上GLUT4显著降低;在胰岛素的刺激下,TNF-α组与只加胰岛素组细胞膜GLUT4的表达有显著减少,只加胰岛素组与空白对照组相比细胞膜GLUT4有明显的增加,蛋白定量结果与Western blot结果一致,见表 3。可见,GLUT4膜蛋白表达下调与胰岛素抵抗模型建立相关。
|
| 图 2 TNF-α对3T3-L1脂肪细胞膜上GLUT4表达的影响 Fig. 2 Effects of TNF-α on GLUT4 expression in 3T3-L1 adipocyte membrane 注:*P < 0.05,与空白对照组比较;#P < 0.05,与只加胰岛素组比较。 |
|
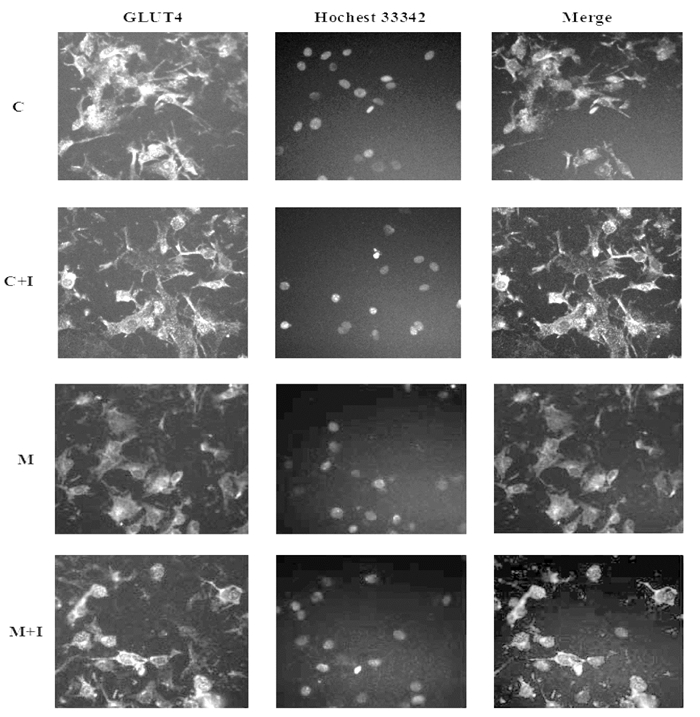
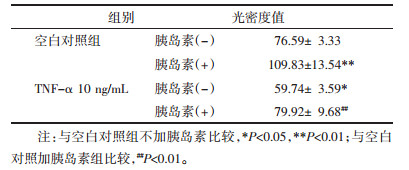
为了进一步检测TNF-α引起的胰岛素抵抗是否导致GLUT4从胞浆转位至细胞膜,利用高内涵成像系统考察了GLUT4在细胞中的分布情况,并进行定量分析。结果如图 3所示,空白对照组C中,GLUT4蛋白均匀分布在胞浆(黄色荧光),给予胰岛素(100 nmol/L)作用15 min后,GLUT4一部分转移到膜上(C+I)。模型组(M)细胞膜上GLUT4的表达较空白对照组(C)显著减少,模型加胰岛素组(M+I)与空白对照加胰岛素组(C+I)相比,模型加胰岛素组(M+I)的GLUT4在膜上的表达量相对较少,与定量分析结果一致,见表 4,由此可以看出TNF-α诱导的胰岛素抵抗可以减少GLUT4的膜转位。
|
| 图 3 TNF-α诱导的胰岛素抵抗对GLUT4的膜转位的影响(×200) Fig. 3 Effect of TNF-α-induced insulin resistance on translocation of GLUT4 to the plasma membrane (× 200) 注:*P < 0.05,**P < 0.01,与空白对照组比较;##P < 0.01,与只加胰岛素组比较。 |
|
糖尿病是一种进行性发展的慢性、终身性疾病。近年来,随着人民生活水平的提高,糖尿病的患病率逐年上升。据国际糖尿病联盟发布的数据,2015年全球糖尿病的患病率为8.8%,患病人数达4.15亿,死亡人数达到500万,糖尿病已成为严重影响人类健康的主要慢性非传染性疾病之一[10]。现代医学认为其发病主要与遗传、环境因素等相关,胰岛素抵抗在2型糖尿病发病、发展过程中起到至关重要的作用。
胰岛素抵抗既是2型糖尿病的特征又是导致2型糖尿病的主要原因[11]。遗传因素、胰岛素信号通路障碍、血清游离脂肪酸浓度增高或细胞内脂肪含量增多、炎症和氧化应激等诸多因素均可引起胰岛素抵抗[12]。
王春等[13]考察了111例2型糖尿病住院患者空腹血清TNF-α的水平后认为糖尿病患者体内的TNF-α与胰岛素抵抗轻重程度呈正相关,进一步说明TNF-α在胰岛素抵抗的发生、发展中具有重要的作用,并且肥胖是影响炎症因子水平与胰岛素抵抗的重要因素。其中,TNF-α主要由脂肪组织分泌产生,与慢性胰岛素抵抗的发生关系密切。TNF-α可通过多途径影响胰岛素信号传导通路来参与胰岛素抵抗的发生[14]。在早期的研究中发现,对TNF-α基因进行剔除后,能够增加体内胰岛素敏感性,从而改善糖脂代谢,间接说明TNF-α可能引起胰岛素抵抗[15]。
据此,本研究采用TNF-α作用于3T3-L1脂肪细胞,从慢性低度的炎症角度出发建立胰岛素抵抗模型。Li等[16]与Palaci-Osortega等[17]采用了10 ng/mL的TNF-α分别持续刺激分化成熟的3T3-L1脂肪细胞24 h和48 h建立胰岛素抵抗模型;还有一些研究人员[18]采用2 ng/mL的TNF-α孵育96 h建立3T3-L1脂肪细胞胰岛素抵抗模型。相反,有研究[19]表明,在TNF-α作用时间相对较短(24 h)时,脂肪细胞的胰岛素依赖性信号转导不受影响,胰岛素刺激的葡萄糖转运无显著变化,据此,本研究中造模作用时间分别是48、72、96 h,发现不同的作用时间下高剂量的TNF-α均会使细胞存活率显著降低;而TNF-α使用剂量过低均不能引起胰岛素依赖性葡萄糖摄取的变化,也因此不能引起胰岛素抵抗。同时,TNF-α作用超过96 h后也不会引起胰岛素敏感性葡萄糖摄取下降。研究结果表明TNF-α诱发3T3-L1细胞胰岛素抵抗模型的最佳方案为10 ng/mL的TNF-α作用细胞96 h。鉴于上述文献只是用葡萄糖摄取的方法检测模型是否成立,并没有考察TNF-α对细胞存活率的影响,胰岛素抵抗模型在考察了造模药TNF-α的作用时间及使用剂量的同时,考察TNF-α对细胞存活率的影响,以保证TNF-α的剂量不影响细胞活力,从而造成重现性好的胰岛素抵抗模型。
有文献报导,TNF-α与其他细胞因子在脂肪组织中直接或间接地影响着体内葡萄糖代谢,TNF-α可直接抑制脂肪细胞中主要葡萄糖转运蛋白GLUT4,使其表达下降而降低胰岛素刺激的葡萄糖转运,诱发胰岛素抵抗[20]。而且,胰岛素抵抗的肥胖病人脂肪细胞中GLUT4表达水平明显下降。此外,TNF-α刺激下,GLUT4在2型糖尿病大鼠脂肪和肌肉细胞中的表达明显降低[21]。另一方面研究发现,Ishibashi等[22]通过elaidate诱导的3T3-L1脂肪细胞胰岛素抵抗模型中,细胞内转移到细胞膜上的GLUT4明显下降,从而引起葡萄糖的消耗减少。这与以往Prasad等[23]的研究结果一致。Zierath等[24]研究发现,骨骼肌细胞长期暴露于高浓度胰岛素诱导的胰岛素抵抗模型中GLUT4活性降低或转位障碍,且对生理浓度的胰岛素刺激无反应。近年研究发现,胰岛素抵抗细胞模型中细胞膜上GLUT4蛋白表达量均会显著减少[23-28],GLUT4介导的葡萄糖转运是外周组织葡萄糖利用的限速步骤[29]。因此,推测GLUT4膜蛋白表达及膜转位可以作为判定TNF-α胰岛素模型是否建立的标准。本研究中对3个批次细胞样品进行分析,TNF-α刺激的3T3-L1脂肪细胞胰岛素抵抗模型中有或无胰岛素刺激时,GLUT4在细胞膜上的表达均明显下降,说明GLUT4的下调作用可能与胰岛素抵抗相关。与此同时实验中采用了高内涵筛选的方法定性定量地进行GLUT4膜转位检测。
高内涵筛选分析作为系统生物学时代的一项领先技术,能够快速高效获得细胞所产生的实时和多维立体的生物效应信息[30]。在保持细胞结构和功能完整性的前提下,高内涵筛选设备具有的高分辨率荧光数码成像系统可以通过多维立体的方式进行实时监控某待测样品对细胞产生的效应信号,可以在实验中同步检测被筛样品对于细胞生理状态(如细胞形态、生长分化状态、信号通路以及细胞代谢途径的各个环节)的改变[31],并且可以从多角度观察被筛样品对细胞内蛋白表达及转移的影响[32]。穆蕊等[33]应用HCS平台对TNF-α刺激前后的核因子-κB(NF-κB)的荧光信号进行量化, 通过计算细胞核/细胞浆荧光强度的比值来表示NF-κB的细胞定位。本实验通过高内涵筛选探究了胰岛素抵抗模型细胞中GLUT4分布,结果显示TNF-α诱导的胰岛素抵抗可以明显减少GLUT4的膜转位,在证明胰岛素抵抗模型成立的同时,也可以更加形象直观地观察到GLUT4蛋白的分布变化情况。既然脂肪细胞中GLUT4与胰岛素抵抗直接相关,那么通过高内涵定量分析的方法考察GLUT4的膜转位就有可能为验证脂肪细胞胰岛素抵抗提供借鉴。几次造模结果均显示TNF-α诱导的胰岛素抵抗模型中GLUT4膜蛋白表达显著减少,与葡萄糖摄取结果保持一致。鉴于胰岛素抵抗模型成立的鉴定方法多采用检测葡萄糖消耗量这一种形式[16-18],因而本实验建立起来的GLUT4膜蛋白表达及膜转位测定可以作为鉴定模型是否成功及是否稳定的指标。
综上所述,本研究运用TNF-α孵育3T3-L1细胞建立胰岛素抵抗模型,并且建立起模型鉴定的新指标,可进一步用于研究炎症引起的胰岛素抵抗机制及筛选具有抗糖尿病活性的药物。
| [1] | Reaven GM. Role of insulin resistance in human disease (syndrome X):an expanded definition[J]. Annu Rev Med, 1993, 44 (3): 121–131. |
| [2] | Nquyen MT, Satoh H, Favelyukis S, et al. JNK and tumor necrosis factor-alpha mediate free fatty acid-induced insulin resistance in 3T3-L1 adipocytes[J]. J Biol Chem, 2005, 280 (42): 35361–33571. DOI:10.1074/jbc.M504611200 |
| [3] | 袁荣华, 黄起壬, 柯临慧. 胰岛素抵抗机制的研究现状和进展[J]. 九江学院学报(自然科学版), 2010, 25 (4): 109–111. DOI:10.3969/j.issn.1674-9545.2010.04.042 |
| [4] | 杨永青, 杨明庆. 肥胖诱发胰岛素抵抗的炎性机制[J]. 中国生物化学与分子生物学报, 2012, 28 (8): 692–629. |
| [5] | Parker BL, Thaysen-Andersen M, Fazakerley DJ, et al. Terminal Galactosylation and sialylation switching on membrane glycoproteins upon TNF-Alpha-Induced insulin resistance in Adipocytes[J]. Mol Cell Proteomics, 2016, 15 (1): 141–153. DOI:10.1074/mcp.M115.054221 |
| [6] | Ruan H, Hacohen N, Golub TR, et al. Tumor necrosis factor-alpha suppresses adipocyte-specific genes and activates expression of preadipocyte genes in 3T3-L1 adipocytes:nuclear factor-kappaB activation by TNF-alpha is obligatory[J]. Diabetes, 2002, 51 (5): 1319–1336. DOI:10.2337/diabetes.51.5.1319 |
| [7] | Kong P, Chi R, Zhang L, et al. Effects of paeoniflorin on tumor necrosis factor-α-induced insulin resistance and changes of adipokines in 3T3-L1 adipocytes[J]. Fitoterapia, 2013, 91 : 44–50. DOI:10.1016/j.fitote.2013.08.010 |
| [8] | Anusree SS, Nisha VM, Priyanka A, et al. Insulin resistance by TNF-αis associated with mitochondrial dysfunction in 3T3-L1 adipocytes and is ameliorated by punicic acid, a PPARγ agonist[J]. Mol Cell Endocrinol, 2015, 413 : 120–128. DOI:10.1016/j.mce.2015.06.018 |
| [9] | 屠亦文.胰岛素抵抗3T3-L1脂肪细胞模型研究现状[A].第十一次中国中西医结合实验医学学术研讨会论文汇编[C].北京: 2013. |
| [10] | International Diabetes Federation. IDF Diabetes Atlas. 7th ed[R]. Brussels: IDF, 2015. http://www.diabetesatlas.org. |
| [11] | Grundy SM, Brewer HB Jr, Cleeman JI, et al. Definition of metabolic syndrome:report of the national heart, lung, and blood institute/American Heart Association conference on scientific issues related to definition[J]. Circulation, 2004, 109 (3): 433–438. DOI:10.1161/01.CIR.0000111245.75752.C6 |
| [12] | 颜薇, 陈秋. 2型糖尿病/胰岛素抵抗炎症机制的浅析[J]. 时珍国医国药, 2012, 23 (9): 2299–2300. DOI:10.3969/j.issn.1008-0805.2012.09.084 |
| [13] | 王春, 吕高友, 张沈洁, 等. 2型糖尿病患者TNF-α、IL-6及CRP与胰岛素抵抗相关性研究[J]. 医学理论与实践, 2015, 28 (19): 2582–2583. |
| [14] | 曹莹, 赵建鑫, 刘金玲. 清热祛湿方对2型糖尿病胰岛素抵抗患者肿瘤坏死因子α的影响[J]. 中医杂志, 2011, 52 (4): 338–340. |
| [15] | 尤巧英, 李成江. 部分炎症因子与胰岛素抵抗[J]. 国际内分泌代谢杂志, 2004, 24 (3): 183–185. DOI:10.3760/cma.j.issn.1673-4157.2004.03.015 |
| [16] | Li Y, Yang P, Chang Q, et al. Inhibitory effect of piceatannol on TNF-α-mediated inflammation and insulin resistance in 3T3-L1 adipocytes[J]. J Aqric Food Chem, 2017, 65 (23): 4634–4641. DOI:10.1021/acs.jafc.7b01567 |
| [17] | Palacios-Ortega S, Varela-Guruceaga M, Alqarabel M, et al. Effect of TNF-Alpha on Caveolin-1 expression and insulin signaling during adipocyte differentiation and in mature adipocytes[J]. Cell Physiol Biochem, 2015, 36 (4): 1499–1516. DOI:10.1159/000430314 |
| [18] | Parker BL, Thaysen-Andersen M, Fazakerley DJ, et al. Terminal galactosylation and sialylation switching on membrane glycoproteins upon TNF-Alpha-Induced insulin resistance in adipocytes[J]. Mol Cell Proteomics, 2016, 15 (1): 141–153. DOI:10.1074/mcp.M115.054221 |
| [19] | Stephens JM, Lee J, Pilch PF. Tumor necrosis factor-alpha-induced insulin resistance in 3T3-L1 adipocytes is accompanied by a loss of insulin receptor substrate-1 and GLUT4 expression without a loss of insulin receptor-mediated signal transduction[J]. J Biol Chem, 1997, 272 (2): 971–976. DOI:10.1074/jbc.272.2.971 |
| [20] | Mueckler M, Thorens B. The SLC2(GLUT) family of membrane transporters[J]. Mol Aspects Med, 2013, 34 (2-3): 121–138. DOI:10.1016/j.mam.2012.07.001 |
| [21] | 姜淼, 王世东, 黄允瑜, 等. 黄连人参对药治疗2型糖尿病胰岛素抵抗机制的实验研究[J]. 新中医, 2006, 38 (5): 89–91. DOI:10.3969/j.issn.0256-7415.2006.05.056 |
| [22] | Ishibashi K, Nehashi K, Oshima T, et al. Differentiation with elaidate tends to impair insulin-dependent glucose uptake and GLUT4 translocation in 3T3-L1 adipocytes[J]. Int J Food Sci Nutr, 2016, 67 (2): 99–110. DOI:10.3109/09637486.2016.1144721 |
| [23] | Prasad CN, Anjana T, Banerji A, et al. Gallic acid induces GLUT4 translocation and glucose uptake activity in 3T3-L1 cells[J]. FFBS Lett, 2010, 584 (3): 531–536. DOI:10.1016/j.febslet.2009.11.092 |
| [24] | Zierath JR, Krook A, Wallberg-Henriksson H. Insulin action in skeletal muscle from patients with NIDDM[J]. Mol Cell Biochem, 1998, 182 (1-2): 153–160. |
| [25] | Lequisamo NM, Lehnen AM, Machado UF, et al. GLUT4 content decreases along with insulin resistance and high levels of inflammatory markers in rats with metabolic syndrome[J]. Cardiovasc Diabetol, 2012, 11 : 100. DOI:10.1186/1475-2840-11-100 |
| [26] | Ganesan S, Ito MK. Coenzyme Q10 ameliorates the reduction in GLUT4 transporter expression induced by simvastatin in 3T3-L1 adipocytes[J]. Metab Syndr Relat Disord, 2013, 11 (4): 251–255. DOI:10.1089/met.2012.0177 |
| [27] | Ando Y, Shinozawa Y, Iijima Y, et al. Tumor necrosis factor (TNF)-α-induced repression of GKAP42 protein levels through cGMP-dependent kinase (cGK)-Iαcauses insulin resistance in 3T3-L1 adipocytes[J]. J Biol Chem, 2015, 290 (9): 5881–5892. DOI:10.1074/jbc.M114.624759 |
| [28] | She M, Hou H, Wang Z, et al. Melatonin rescues 3T3-L1 adipocytes from FFA-induced insulin resistance by inhibiting phosphorylation of IRS-1 on Ser307[J]. Biochimie, 2014, 103 : 126–130. DOI:10.1016/j.biochi.2014.05.001 |
| [29] | 高璐, 于德民. GLUT4与胰岛素抵抗[J]. 国际内分泌代谢杂志, 2002, 22 (5): 308–310. DOI:10.3760/cma.j.issn.1673-4157.2002.05.018 |
| [30] | 王书敬. 生物新技术在天然药物研究中的应用[J]. 北京联合大学学报(自然科学版), 2010, 24 (3): 29–32. DOI:10.3969/j.issn.1005-0310.2010.03.007 |
| [31] | Zock JM. Applications of high content screening in life science research[J]. Comb Chem High Throughput Screen, 2009, 12 (9): 870–876. DOI:10.2174/138620709789383277 |
| [32] | 孙婉, 李敏. 药物筛选技术的最新进展——高内涵筛选[J]. 中国新药杂志, 2006, 15 (1): 12–16. DOI:10.3321/j.issn:1003-3734.2006.01.003 |
| [33] | 穆蕊, 李腾, 高彦飞, 等. 高内涵筛选NF-κB信号通路的技术体系建立[J]. 科学技术与工程, 2011, 11 (14): 3162–3164. DOI:10.3969/j.issn.1671-1815.2011.14.010 |
2. Tianjin Key Laboratory of Modern Traditional Chinese Medicine, Tianjin 300193, China;
3. Department of Chinese Medicinal Chemistry, College of Traditional Chinese Materia Medica, Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China
 2018, Vol. 35
2018, Vol. 35