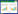文章信息
- 艾望, 周珍, 张曼玲, 王秀萍, 张莹雯
- AI Wang, ZHOU Zhen, ZHANG Manling, WANG Xiuping, ZHANG Yingwen
- 当归补血汤对糖尿病大鼠肝脏、骨骼肌中PKC-ζ表达的影响
- Effect of Danggui Buxue decoction on the expression of PKC-ζ in the liver and skeletal muscle of diabetic rats
- 天津中医药, 2018, 35(11): 854-857
- Tianjin Journal of Traditional Chinese Medicine, 2018, 35(11): 854-857
- http://dx.doi.org/10.11656/j.issn.1672-1519.2018.11.15
-
文章历史
- 收稿日期: 2018-06-29
2型糖尿病(T2DM)是由胰岛素分泌和(或)功能缺陷所导致的以高血糖为特征的代谢性疾病,T2DM患者占中国糖尿病人口的90%以上[1]。胰岛素抵抗在T2DM发病中起重要作用,并贯穿于T2DM全过程。蛋白激酶C-ζ(PKC-ζ)是蛋白激酶C(PKC)的一种亚型,属于多功能丝氨酸和苏氨酸激酶,其结构和功能与经典PKC相比具有明显的区别[2]。PKC-ζ属于磷脂酰肌醇3激酶(PI3K)下游信号分子,参与完成胰岛素刺激的脂肪细胞和肌细胞摄取葡萄糖的最后生物学事件[3-5]。
课题组前期研究表明当归补血汤对糖尿病大鼠有降低血糖、血脂以及心血管、肾脏、神经等多种并发症的保护作用,对核因子-κB(NF-κB)、转化生长因子等多个靶点有抑制作用[6-9]。设想当归补血汤可以通过调控PKC-ζ表达,从而达到改善胰岛素抵抗,调节血糖的作用。
本文旨在通过动物实验从补气生血的古典经方当归补血汤中探讨其增加胰岛素敏感性,改善糖尿病大鼠胰岛素抵抗的科学内涵。
1 材料 1.1 实验动物SPF级纯系正常SD雄性大鼠50只,10周龄,200~220 g,购于武汉大学中南医院动物实验中心[许可证号:SCXK2008-0004]。
1.2 实验药材当归补血汤(黄芪:当归=2:1)由武汉大学中南医院中药房提供,黄芪、当归生药浸水30 min,煎2次,混匀煎煮液,冷却后放于4 ℃冰箱备用。吡格列酮片(卡司平)购自武汉大学中南医院西药房。
1.3 实验试剂链脲佐菌素(STZ),购于美国Sigma公司,溶于1%柠檬酸钠缓冲液,pH 4.3;大鼠胰岛素酶联免疫吸附(ELISA)测定试剂盒(货号E-EL-R0023c);PKC-ζ兔抗大鼠一抗购于Abcam公司(批号ab59364);HRP标记山羊抗兔购于ASPEN(批号AS-1107);DAB显色试剂盒购于北京中杉金桥生物技术有限公司;牛血清白蛋白(BSA)购于Roche公司。
1.4 实验仪器稳豪倍优型强生血糖仪及血糖试纸,美国强生公司;倒置荧光显微镜IX51,OLYMPUS;普通光学显微镜CX-21,OLYMPUS;成像系统MicroPublisher,Q-IMAGING;切片机RM2016,上海徕卡仪器有限公司。
2 方法 2.1 饲养条件所有大鼠均在武汉大学中南医院动物实验中心饲养。室温(22±2)℃、相对湿度(55±5)%、光照周期12~12 h。实验期间保证所有大鼠饮水、标准饮食充足,定时更换垫料。
2.2 模型制备与分组给药50只大鼠适应饲养1周后,随机选取20只大鼠分为空白对照组(n=10)和当归补血汤组(n=10),给予普通饲料饲养。余30只给予高脂高糖饲料饲养,4周后,禁食12 h,注射小剂量STZ(35 mg/kg),空白对照组和当归补血汤组给予等量柠檬酸钠缓冲液,72 h后尾静脉取血测血糖,大鼠血糖≥16.7 mmol/L即为造模成功,可纳入实验[10]。测得30只大鼠全部造模成功,随机分为T2DM模型组(n=10)、T2DM+当归补血汤组(n=10)、T2DM+吡格列酮组(n=10)。对空白对照组和T2DM模型组给予生理盐水5 mL/(kg·d)灌胃,当归补血汤组和T2DM+当归补血汤组给予当归补血汤3.57 g/(kg·d)灌胃,T2DM+吡格列酮组给予吡格列酮10 mg/(kg·d)灌胃。所有大鼠连续给药和观察5周后取材。
2.3 一般情况观察大鼠饮水量、进食量、尿量、精神、毛色、反应力等并作记录。
2.4 体质量、血糖、血清胰岛素测定所有组每周末测大鼠体质量,采用眼内眦静脉取血测空腹血糖及空腹胰岛素含量。血糖仪及配套试纸测定各组大鼠空腹血糖(FPG),ELISA法测大鼠血清空腹胰岛素(FINS)。
2.5 免疫组化检测无菌条件下取肝脏和骨骼肌,用4%多聚甲醛固定,将组织石蜡包埋切片。再将切片经过脱蜡至水、磷酸缓冲盐溶液(PBS)洗3次、新鲜配置的乙二胺四乙酸(EDTA)修复液修复、冷却、PBS洗3次、3% H2O2溶液避光孵育10 min、5% BSA封闭、加一抗、复温、洗去一抗、HRP标记山羊抗兔二抗、洗去二抗、DAB显色、Mayer苏木素复染、脱水透明封片。将封固好的切片晾干后,置于倒置显微镜用200倍视野选取视野,每个组织片选取3个200倍视野来进行统计分析。Image Pro-Plus 6.0软件分析免疫组化图片方法:每组内每张切片分别随机挑选3个200倍视野进行拍照。让组织充满整个视野再进行拍照。对每张照片应用Image-Pro Plus 6.0软件进行分析得出每张照片阳性的累积光密度值(IOD值)。IOD值越大,表示阳性表达越强。
2.6 统计学处理实验数据用SPSS 22.0软件进行统计分析,计量资料以均数±标准差(x±s)表示。多组间比较采用单因素方差分析,组间两两比较采用LSD法,P < 0.05为差异有统计学意义。
3 结果 3.1 一般情况实验过程中未出现大鼠死亡情况。造模成功后糖尿病大鼠进水量、摄食量、尿量明显增加,活动减少,反应迟钝,皮毛凌乱,色泽暗淡。这些情况在T2DM+当归补血汤组和T2DM+吡格列酮组得到明显改善。
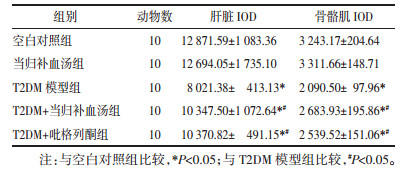
3.2 体质量变化、FPG和FINS灌胃后空白对照组与当归补血汤组体质量无统计学差异;T2DM模型组、T2DM+当归补血汤组、T2DM+吡格列酮组糖尿病大鼠体质量低于空白对照组(P < 0.05);T2DM+当归补血汤组、T2DM+吡格列酮组体质量高于T2DM模型组(P < 0.05)。
灌胃后空白对照组与当归补血汤组FPG、FINS浓度无统计学差异;T2DM模型组、T2DM+当归补血汤组、T2DM+吡格列酮组大鼠FPG、FINS高于空白对照组(P < 0.05);T2DM+当归补血汤组、T2DM+吡格列酮组FPG、FINS浓度较T2DM模型组下降(P < 0.05),且T2DM+当归补血汤组和T2DM+吡格列酮组组间无统计学差异,见表 1。
|
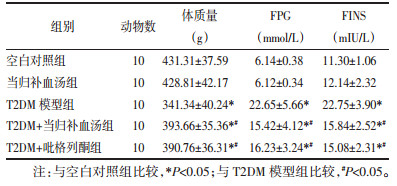
图像分析系统检测肝脏组织和骨骼肌组织中PKC-ζ表达情况:肝脏和骨骼肌组织各组之间PKC-ζ表达趋势相同。空白对照组与当归补血汤组肝细胞和骨骼肌细胞上PKC-ζ广泛分布,呈棕黄色,强阳性,且空白对照组与当归补血汤组无明显区别;T2DM模型组、T2DM+当归补血汤组、T2DM+吡格列酮组表达量低于空白对照组(P < 0.05);T2DM+当归补血汤组、T2DM+吡格列酮组较T2DM模型组表达量升高(P < 0.05),且T2DM+当归补血汤组与T2DM+吡格列酮组无统计学差异,见表 2、图 1、图 2。
|
| 图 1 各组大鼠肝脏中PKC-ζ的表达 Fig. 1 Expression of PKC-ζ in the liver of rats in each group |
|
| 图 2 各组大鼠骨骼肌中PKC-ζ的表达 Fig. 2 Expression of PKC-ζ in skeletal muscle of rats in each group |
糖尿病属于中医学“消渴”范畴,《外台秘要》记载:“渴而饮水多,小便数……甜者,皆是消渴病也。”消渴的基本病机是阴虚燥热:初期为阴津亏损,渐至阴伤及气,出现气阴两虚,气虚则运血、生血无力,以致血虚燥热,阴虚为本,燥热为标,互为因果,病发消渴。因此,消渴的治疗重在补气养阴生血。
当归补血汤作为补气生血的代表方,始载于李东垣的《内外伤辨惑论》,全方由黄芪、当归以5:1的比例组成,主治“血虚发热”证候。在临床工作中,研究者将当归补血汤应用于糖尿病及并发症治疗近30年,发现根据糖尿病所处不同阶段,调整原方中黄芪、当归比例,可取得更好的临床疗效。故本研究加味当归补血汤是以李东垣所创制的当归补血汤为基方,加大当归的用量,调整黄芪、当归用量之比为2:1。黄芪健脾益气,当归养血活血,则阳生阴长,气旺血生,虚热自退。
PKC-ζ在机体内分布广泛,具有诱导细胞分化、调控基因表达、影响免疫功能、参与代谢调节、抑制肿瘤细胞增殖等多种作用。在静息状态下,PKC以无活性的形式存在于细胞浆中,当存在外界刺激时(如高糖状态),受其特异性底物吸引由胞液向胞膜转移,通过多种膜蛋白的磷酸化作用使其构象改变,致使PKC信号通路激活,但PKC-ζ转位机制目前仍未十分明确[11]。近年来,关于PKC-ζ在糖尿病中的作用研究逐步深入,许多报道证实其与胰岛素抵抗的形成关系密切。T2DM的胰岛素抵抗属获得性胰岛素抵抗,主要由胰岛素受体后因素导致,包括胰岛素受体底物1(IRS-1)磷酸化障碍、PI3K活化障碍、葡萄糖转运子4(GLUT4)合成与转位异常、细胞内葡萄糖磷酸化障碍等[12-13]。PKC-ζ改善胰岛素抵抗可能是通过促进葡萄糖转运关键蛋白GLUT-4的表达及膜转位实现的:当胰岛素与受体结合后,激活IRS-1/2,进一步激活经典PI3K-PIP3-PDK1通路,从而激活PKC-ζ,PKC-ζ通过诱导GLUT4转位,参与胰岛素刺激的葡萄糖转运,介导胰岛素将血糖转运至肌肉、脂肪组织及肝脏中。有研究发现活化的PKC-ζ刺激GLUT4转位,而失活的PKC-ζ则部分抑制GLUT4转位,PKC-ζ抑制剂还可阻断冈田软海绵酸刺激的GLUT4转位和葡萄糖转位[14]。
本实验研究发现,造模成功后,T2DM大鼠出现多饮多食多尿、体质量减轻、血糖升高、胰岛素浓度升高等异常,而经当归补血汤治疗后的大鼠“三多一少”症状明显好转,FPS、FINS浓度显著降低,且与西药吡格列酮疗效无明显差异,提示当归补血汤可改善胰岛素抵抗,降低血糖。免疫组化T2DM大鼠肝脏、骨骼肌组织中PKC-ζ的表达明显减少,而经当归补血汤治疗后,PKC-ζ表达量增加,提示当归补血汤调节血糖的作用可能与其促进肝脏、骨骼肌组织中PKC-ζ的表达有关,但其具体作用机制还有待进一步研究。
| [1] | 中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2013年版)[J]. 中国糖尿病杂志, 2014, 22 (8): 2–42. |
| [2] | 李亚宁, 刘华锋. 非经典型蛋白激酶C的研究进展[J]. 临床医学工程, 2012, 19 (9): 1614–1616. DOI:10.3969/j.issn.1674-4659.2012.09.1614 |
| [3] | Bandyopadhyay G, Sajan MP, Kanoh Y, et al. PKC-zeta mediates insulin effects on glucose transport in cultured preadipocyte-derived human adipocytes[J]. J Clin Endocrinol Metab, 2002, 87 (2): 716–723. |
| [4] | Kanzaki M, Mora S, Hwang JB, et al. Atypical protein kinase C (PKCzeta/lambda) is a convergent downstream target of the insulin-stimulated phosphatidylinositol 3-kinase and TC10 signaling pathways[J]. Journal Of Cell Biology, 2004, 164 (2): 279–290. DOI:10.1083/jcb.200306152 |
| [5] | Liu LZ, Zhao HL, Zuo J, et al. Protein kinase Czeta mediates insulin-induced glucose transport through actin remodeling in L6 muscle cells[J]. Molecular Biology Of The Cell, 2006, 17 (5): 2322–2330. DOI:10.1091/mbc.e05-10-0969 |
| [6] | 李亚容, 张莹雯, 张曼玲, 等. 当归补血汤对糖尿病大鼠肾脏Nrf2及HO-1的影响[J]. 中华中医药杂志, 2017, 32 (9): 3981–3984. |
| [7] | 张曼玲, 王秀萍, 李亚容, 等. 当归补血汤对糖尿病肾病大鼠GRP78的影响[J]. 中国中西医结合肾病杂志, 2016, 17 (10): 858–861. DOI:10.3969/j.issn.1009-587X.2016.10.005 |
| [8] | 王秀萍, 任小旦, 张莹雯. 当归补血汤对糖尿病大鼠肾组织NF-κB、MCP-1表达的影响[J]. 天津中医药大学学报, 2016, 35 (3): 167–172. |
| [9] | 杨利剑, 张莹雯. 当归补血汤对大鼠糖尿病足iNOS mRNA表达的影响[J]. 武汉大学学报(医学版), 2010, 54 (5): 592–595. |
| [10] | Srinivasan K, Viswanad B, Asrat L, et al. Combination of high-fat diet-fed and low-dose streptozotocin-treated rat:a model for type 2 diabetes and pharmacological screening[J]. Pharmacollgical Research, 2005, 52 (4): 313–320. DOI:10.1016/j.phrs.2005.05.004 |
| [11] | 李鑫, 董朝侠, 蔡兰英, 等. 中药干预糖尿病鼠肾脏蛋白激酶C信号通路的研究进展[J]. 中国实验方剂学杂志, 2015, 21 (6): 230–234. |
| [12] | 张世卿, 佟丽. 胰岛素抵抗作用发生机制及实验模型的研究进展[J]. 中药新药与临床药理, 2012, 23 (3): 364–368. DOI:10.3969/j.issn.1003-9783.2012.03.034 |
| [13] | 贾伟平. 胰岛素抵抗在2型糖尿病发病机制中的作用[J]. 诊断学理论与实践, 2009, 8 (3): 233–236. |
| [14] | 廖端芳, 关永源. 蛋白激酶C-ζ研究进展[J]. 中国药理学通报, 2002, 28 (1): 13–16. DOI:10.3321/j.issn:1001-1978.2002.01.005 |
 2018, Vol. 35
2018, Vol. 35