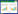文章信息
- 余婷, 韩亚非
- YU Ting, HAN Yafei
- 苦参素对慢性脑缺血大鼠海马CA1区神经元凋亡保护作用的研究
- Inhibitory effect of oxymatrine on apoptosis in hippocampal CA1 region of the rats with chronic cerebral ischemia
- 天津中医药, 2018, 35(11): 863-867
- Tianjin Journal of Traditional Chinese Medicine, 2018, 35(11): 863-867
- http://dx.doi.org/10.11656/j.issn.1672-1519.2018.11.17
-
文章历史
- 收稿日期: 2018-06-06
2. 邯郸市中心医院神经外四科, 邯郸 056001
细胞凋亡是缺血性脑病神经元迟发性死亡的主要形式,是缺血性脑损伤的主要病理机制之一[1-2],而海马区神经元是对脑组织缺血缺氧最为敏感的部位。苦参素是中药苦参的主要有效成分之一,既往研究发现苦参素能够通过抑制细胞凋亡而对心肌缺血、肝脏缺血起到一定的保护作用[3-4],本实验制备慢性脑缺血大鼠模型并给予苦参素,探讨苦参素通过抑制大脑海马CA1区神经元凋亡而对慢性脑缺血损伤起到一定的保护作用及其可能的作用机制。
1 材料与方法 1.1 实验动物清洁级SD大鼠(雌雄不限)购自河北医科大学实验动物中心[SCXK(冀)2013-1-003],适应性饲养1周后进行实验。
1.2 药物与试剂苦参素购自南京泽朗医药科技有限公司(批号:20170114);末端标记(TUNEL)试剂盒购自北京博奥森生物技术有限公司(批号:170324);半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)多克隆抗体、核因子-κB(NF-κB)多克隆抗体、B淋巴细胞瘤-2(Bcl-2)多克隆抗体、Bcl-2相关X蛋白(Bax)多克隆抗体和ABC-DAB试剂盒购自上海碧云天生物技术有限公司(批号:201701009、201703012、201703029、201702001、201704006);超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、丙二醛(MDA)试剂盒购自南京建成生物工程研究所(批号:20170309、20170413、20170114);白介素-1β(IL-1β)、白介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)试剂盒购自北京博奥森生物技术有限公司(批号:170129、170312、170116)。
1.3 实验方法 1.3.1 动物分组与模型制备取100只实验用大鼠按照随机数字表法随机分为假手术组、模型组和苦参素低[25 mg/(kg·d)]、中[50 mg/(kg·d)]、高[100 mg/(kg·d)]剂量组,每组20只。采用结扎双侧颈总动脉制备慢性脑缺血大鼠模型,假手术组行手术操作但不结扎双侧颈总动脉。术后第2天开始腹腔注射给药治疗(每日1次),疗程7 d[5]。
1.3.2 观察大脑海马CA1区神经元形态结构及凋亡状况每组随机取10只大鼠,实施深度麻醉后断头取脑,去除嗅球、小脑和低位脑干,多聚甲醛溶液(浓度4%)固定3 d、石蜡包埋、切片、脱蜡水化,然后行常规苏木精-伊红(HE)染色后通过倒置光学显微镜观察大脑海马CA1区神经元形态(海马CA1区范围见图 1);行TUNEL染色后观察海马CA1区神经元凋亡状况并计算凋亡指数(AI),AI(%)=(视野凋亡细胞数/视野细胞总数)×100%,每只取5张切片,每张切片取5个互不重叠的视野,取平均值。

|
| 图 1 大鼠大脑海马组织结构图 Fig. 1 Brain hippocampus tissue structure of rats |
取1.3.2制备的大鼠脑组织石蜡切片,脱蜡水化处理后,通过ABC-DAB法进行染色:乙醇梯度脱蜡水化、磷酸盐缓冲液(PBS)洗涤、3%过氧化氢-甲醇溶液孵育25 min、PBS洗涤、山羊血清封闭1.5 h、滴加一抗4 ℃过夜、PBS洗涤、滴加二抗室温孵育1.5 h、PBS洗涤、滴加辣根过氧化物酶标记的链霉卵白素室温孵育1 h、PBS洗涤、DAB显色5 min、充分水洗、梯度脱水、封片,然后通过倒置光学显微镜观察并照相保存。每只大鼠取5张切片、每张图片同一部位选取互不重叠的5个视野,采用Image Pro plus图像分析系统测定图片灰度并半定量分析海马区Bcl-2、Bax蛋白表达。
1.3.4 检测海马组织Caspase-3、NF-κB蛋白表达取每组剩余的10只大鼠,实施麻醉后断头取脑并剥取海马组织,研磨匀浆、经12 000 r/min低温(4 ℃)离心20 min处理后取沉淀,行BCA蛋白定量、高温蛋白变性,电泳;待溴酚蓝接近胶底部时停止、转膜、春红溶液染色,室温下5%脱脂奶粉封闭2 h,一抗Caspase-3、NF-κB、β-actin(1:500)4 ℃过夜;洗膜,二抗(1:100)37 ℃恒温孵育1 h后经ECL显色。根据条带灰度值半定量分析Caspase-3、NF-κB蛋白表达。
1.3.5 检测抗氧化酶活性和MDA含量遵照试剂盒步骤处理后通过紫外-可见分光光度计测定抗氧化酶(SOD、CAT)活性和MDA含量。
1.3.6 检测海马组织炎症细胞因子含量遵照试剂盒操作处理后通过酶标仪测定海马组织炎症细胞因子(IL-1β、TNF-α、IL-6)含量。
1.4 统计学处理运用软件SPSS 19.0进行统计分析,计量资料以均数±标准差(x±s)表示,多组间均数比较采用单因素方差分析,组间两两比较若方差齐采用LSD-t检验,若方差不齐采用Dunnett’s T3法,P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠大脑海马CA1区神经元形态结构假手术组大鼠海马CA1区神经元层次清晰,排列整齐,形态完整,核膜、核仁清晰,形态结构未见异常;模型组大鼠海马CA1区神经元呈现层次紊乱,排列稀疏、间隙增大、数量减少,胞体肿胀变形,胞核固缩或溶解等形态结构病理性改变;与模型组比较,苦参素各剂量组海马CA1区神经元病理性形态结构改变呈不同程度改善,该效果以苦参素高剂量组最为显著。结果见图 2。
|
| 图 2 各组大鼠大脑海马CA1区神经元形态结构(HE,×400) Fig. 2 Morphology and structure of hippocampal CA1 neurons of rat brain in each group (HE, ×400) A:假手术组;B:模型组;C:苦参素低剂量组;D:苦参素中剂量组;E:苦参素高剂量组 |
假手术组大鼠大脑海马CA1区仅见少量凋亡细胞;与假手术组比较,模型组大鼠海马CA1区凋亡细胞数量显著增多;与模型组比较,苦参素各剂量组大鼠海马CA1区凋亡细胞数量呈不同程度减少,以苦参素高剂量组最为显著,见图 3。与假手术组比较,模型组大鼠海马CA1区神经元AI显著升高(P < 0.01),而与模型组比较,苦参素中、高剂量组AI显著降低(P < 0.01)。

|
| 图 3 各组大鼠海马CA1区神经元凋亡状况(TUNEL,×400) Fig. 3 Apoptosis of neurons in hippocampal CA1 area of rats in each group (TUNEL, ×400) A:假手术组;B:模型组;C:苦参素低剂量组;D:苦参素中剂量组;E:苦参素高剂量组 |
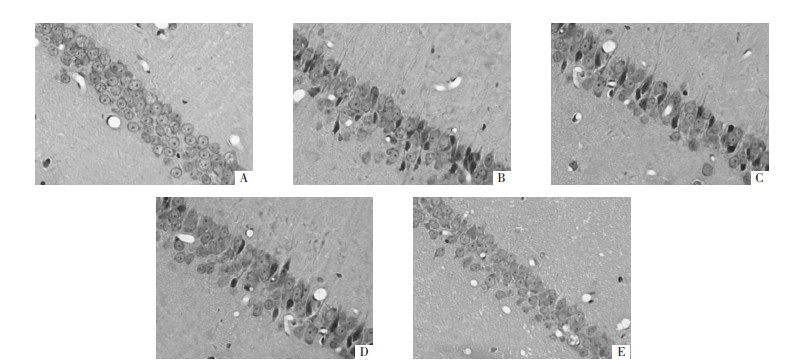
与假手术组比较,模型组大鼠海马组织Bcl-2表达明显下调、灰度显著降低(P < 0.01),Bax表达显著上调、灰度显著升高(P < 0.01);与模型组比较,苦参素各剂量组海马组织Bcl-2表达上调、Bax表达下调,苦参素对Bcl-2、Bax表达的影响呈一定剂量依赖性,调控效果以苦参素高剂量组最为显著;与模型组比较,苦参素中、高剂量组Bcl-2表达灰度值显著升高(P < 0.05或P < 0.01)、Bax表达灰度值显著降低(P < 0.01),Bcl-2/Bax比值显著升高(P < 0.01)。见表 1。
|
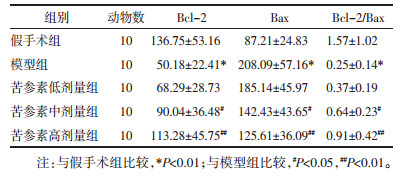
与假手术组比较,模型组大鼠海马组织Caspase-3、NF-κB蛋白表达显著下调(P < 0.01);与模型组比较,苦参素中、高剂量组大鼠海马组织Caspase-3、NF-κB蛋白表达均显著下调(P < 0.05或P < 0.01)。见表 2。
|
与假手术组比较,模型组大鼠海马组织抗氧化酶(SOD、CAT)活性显著降低且MDA含量显著升高(P < 0.01);与模型组比较,苦参素中、高剂量组大鼠海马组织SOD、CAT活性显著提高且MDA含量显著降低(P < 0.05或P < 0.01)。见表 3。
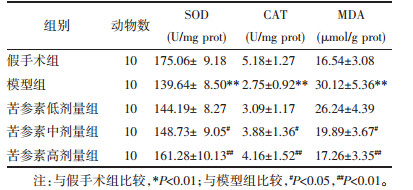
|
与假手术组比较,模型组大鼠海马组织炎症细胞因子(TNF-α、IL-1β、IL-6)含量显著升高(P < 0.01);与模型组比较,苦参素中、高剂量组大鼠TNF-α、IL-1β、IL-6含量均显著降低(P < 0.05或P < 0.01),结果见表 4。
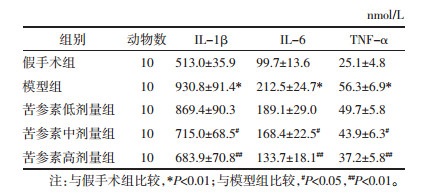
|
海马组织不仅与多种神经性和精神性疾病相关,而且与空间学习记忆密切相关,海马对缺血缺氧十分敏感,尤其CA1区椎体系细胞极易受缺血缺氧损伤[6],而细胞继发性凋亡是神经元迟发性死亡的主要形式,因此抑制海马CA1区细胞凋亡可能是降低慢性缺血性脑病损伤的有效途径。
Caspase-3蛋白在细胞凋亡过程中具有非常关键的调控作用,参与细胞凋亡的启动及整个过程的调节[7]。Bcl-2基因家族是一系列原癌基因蛋白,在细胞凋亡过程中发挥着重要的调控作用,其中Bcl-2和Bax具有较高的同源性,但功能相反[8]。Bcl-2能够通过抑制线粒体细胞色素C释放,抑制半胱氨酸天冬氨酸蛋白酶激活,表现出抑制细胞凋亡的作用;Bax能够促进细胞色素C释放,激活Caspase-9,并且能够与Bcl-2形成二聚体而抑制Bcl-2活性,因此Bax具有促凋亡的作用,而Bax/bcl-2比值更加能够体现Bcl-2基因家族对细胞凋亡的调控作用[9-10]。此外,体内氧自由基(ROS)过剩是细胞凋亡的重要诱发因素,而NF-κB蛋白则是连接氧化应激和细胞凋亡的“桥梁”[11]。正常生理状态下NF-κB以无活性状态存在于细胞质中,而当细胞受ROS攻击时将激活NF-κB蛋白,活化NF-κB进入细胞核并与凋亡相关基因c-myc等NF-κB调控元件结合,促进凋亡相关基因转录并诱导细胞凋亡[12];此外,活化的NF-κB蛋白还能够促进巨噬细胞活化和浸润、诱导促凋亡信号释放而导致细胞凋亡[11]。正常生理状态下体内ROS在抗氧化酶SOD、CAT相继催化作用下被还原生成H2O和O2 [13-14];细胞膜主要成分不饱和脂肪酸极易被ROS攻击生成MDA,因此MDA含量水平能够间接反映机体内ROS水平[15]。炎症细胞因子(TNF-α、IL-1β、IL-6)是临床上监测炎症反应的常用指标,炎症反应与细胞凋亡密切相关[16],并且NF-κB蛋白在炎症反应和细胞凋亡间起到桥梁作用[17]。
苦参(Sophora flavescens Ait.)为豆科苦参属多年生落叶亚灌木植物苦参的根,为传统中药品种之一,《本草纲目》、《神农本草经》等均有记载,其味苦、性寒,具有清热燥湿、利水退黄、祛风杀虫之功效;苦参素是苦参的主要有效成分之一,具有抗炎、改善微循环等药理学作用[18-19]。本实验研究发现经50~100 mg/kg苦参素治疗能够抑制海马CA1区神经元病变并抑制该区域神经元凋亡、降低凋亡指数,上调海马组织Bcl-2表达、下调Bax表达并提高Bcl-2/Bax比值,下调海马组织Caspase-3、NF-κB蛋白表达,提高SOD、CAT活性并降低MDA含量,降低炎症细胞因子IL-1β、IL-6、TNF-α含量;提示苦参素具有抑制慢性脑缺血大鼠海马CA1区细胞凋亡的药理学作用,其机制可能与苦参素调节凋亡相关蛋白表达以及提高ROS清除能力有关。
| [1] | 刘斌, 董晓柳, 张文彦, 等. 急性脑缺血再灌注大鼠海马CA1区细胞凋亡与β-catenin、GSK-3β蛋白表达的关系[J]. 山东医药, 2012, 52 (17): 28–31. DOI:10.3969/j.issn.1002-266X.2012.17.010 |
| [2] | 高维娟, 张霞, 刘莎莎. 大鼠脑缺血再灌注后海马CA1区Caspase-3的表达及细胞凋亡的动态变化[J]. 中国老年学杂志, 2013, 12 (33): 6202–6204. |
| [3] | 陈树杰. 苦参素对心肌缺血再灌注损伤大鼠氧化应激和细胞凋亡的影响[J]. 现代中西医结合杂志, 2016, 25 (5): 476–485. DOI:10.3969/j.issn.1008-8849.2016.05.007 |
| [4] | 孟凡强, 姜洪池, 孙学英, 等. 苦参素对大鼠肝缺血再灌注中肝细胞的保护作用及其机制探讨[J]. 中华医学杂志, 2005, 85 (28): 1991–1994. DOI:10.3760/j:issn:0376-2491.2005.28.012 |
| [5] | 罗伟, 壮荣, 吴昊, 等. 阿司匹林对全脑缺血大鼠记忆功能的影响[J]. 中国行为医学科学, 2004, 13 (2): 142–143. DOI:10.3760/cma.j.issn.1674-6554.2004.02.010 |
| [6] | 刘新建, 温慧敏, 黄英, 等. 大鼠缺氧缺血后海马神经元凋亡及凋亡抑制蛋白XIAP表达的变化[J]. 中国老年学杂志, 2013, 33 (10): 2323–2324. DOI:10.3969/j.issn.1005-9202.2013.10.042 |
| [7] | 董雅洁, 高维娟. Bcl-2、bax、caspase-3在细胞凋亡中的作用及其关系[J]. 中国老年学杂志, 2012, 32 (21): 4828–4829. DOI:10.3969/j.issn.1005-9202.2012.21.123 |
| [8] | Saeedi Borujeni MJ, Hami J, Haghir H, et al. Evaluation of Bax and Bcl-2 proteins expression in the rat hippocampus due to childhood febrile seizure[J]. Iran J Child Neurol, 2016, 10 (1): 53–60. |
| [9] | Renault TT, Dejean LM, Manon S, et al. A brewing understanding of the regulation of Bax function by Bcl-xL and Bcl-2[J]. Mech Ageing Dev, 2016, S0047-6374 (16): 201–210. |
| [10] | Saeedi MJ, Hami J, Haghir H, et al. Evaluation of Bax and Bcl-2 proteins expression in the rat hippocampus due to childhood febrile seizure[J]. Iran J Child Neurol, 2016, 10 (1): 53–60. |
| [11] | Zhang Q, Huang WD, Lyu XY, et al. Ghrelin protects H9c2 cells from hydrogen peroxide-induced apoptosis through NF-κB and mitochondria-mediated signaling[J]. Eur J Pharmacol, 2011, 654 (2): 142–149. DOI:10.1016/j.ejphar.2010.12.011 |
| [12] | Deshpande SS, Angkeow P, Huang J, et al. Rac1 inhibits TNF-alpha-induced endothelial cell apoptosis:dual regulation by reactive oxygen species[J]. FASB J, 2000, 14 (12): 1705–1714. DOI:10.1096/fj.99-0910com |
| [13] | Jin Y, Liu K, Peng J, et al. Rhizoma dioscoreae nipponicae polysaccharides protect HUVECs from H2O2-induced injury by regulating PPARγ factor and the NADPH oxidase/ROS-NF-κB signal pathway[J]. Toxicol Lett, 2014, 232 (1): 149–158. |
| [14] | Lartigue A, Burlat B, Coutard B, et al. The Megavirus chilensis Cu, Zn-superoxide dismutase:the first viral structure of a typical cellular copper chaperone-independent hyperstable dimeric enzyme[J]. J Virol, 2015, 89 (1): 824–832. DOI:10.1128/JVI.02588-14 |
| [15] | Kwiecien S, Magierowska K, Magierowski M, et al. Role of sensory afferent nerves, lipid peroxidation and antioxidative enzymes in the carbon monoxide-induced gastroprotection against stress ulcerogenesis[J]. J Physiol Pharmacol, 2016, 67 (5): 717–729. |
| [16] | 姜舒, 芮耀诚, 李铁军. 心肌梗死中涉及炎症和凋亡的机制[J]. 药学实践杂志, 2016, 34 (2): 119–123. DOI:10.3969/j.issn.1006-0111.2016.02.007 |
| [17] | 齐晅, 田玉, 孙超, 等. NF-κB信号通路的阻断对类风湿关节炎滑膜细胞凋亡与炎症的影响[J]. 中国老年学杂志, 2015, 35 (24): 7022–7024. DOI:10.3969/j.issn.1005-9202.2015.24.025 |
| [18] | 黄秀梅, 李波. 氧化苦参碱对TNF-α、IL-6和IL-8的影响[J]. 中成药, 2003, 25 (11): 903–906. DOI:10.3969/j.issn.1001-1528.2003.11.015 |
| [19] | 王雪芬, 王磊, 陈树杰. 苦参素对大鼠心肌缺血再灌注损伤的保护作用及其机制研究[J]. 中国中医急症, 2016, 25 (6): 988–992. DOI:10.3969/j.issn.1004-745X.2016.06.013 |
2. Fourth Department of Neurosurgery, Handan Central Hospital, Handan 056001, China
 2018, Vol. 35
2018, Vol. 35