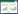文章信息
- 苏景深, 刘恩顺, 孙增涛, 郑莉, 赵鑫民, 陈善夫
- SU Jingshen, LIU Enshun, SUN Zengtao, ZHENG Li, ZHAO Xinmin, CHEN Shanfu
- 通腑泻肺法对ALI/ARDS大鼠肠屏障的保护作用
- Protective effect of Tongfu Xiefei method on intestinal barrier of ALI/ARDS rats
- 天津中医药, 2018, 35(12): 931-934
- Tianjin Journal of Traditional Chinese Medicine, 2018, 35(12): 931-934
- http://dx.doi.org/10.11656/j.issn.1672-1519.2018.12.16
-
文章历史
- 收稿日期: 2018-06-20
2. 天津市津南区咸水沽医院, 天津 300073;
3. 天津中医药大学, 天津 300193
急性肺损伤/急性呼吸窘迫综合征(ALI/ARDS)作为一种临床危重症几乎涉及各个学科,肠道屏障功能在ALI/ARDS发病过程中起的作用越来越受到人们重视。肠道不仅是诸多危重疾病的靶器官,更是启动者,肠道屏障功能已成为判断危重患者预后的一个重要指标[1-2]。中医从“肺与大肠相表里”理论出发,运用通腑泻肺方法治疗肺系脓毒血症在临床上取得了较好的疗效[3]。前期研究发现,通腑泻肺中药能够降低血清细胞因子水平,减轻肺组织和全身的炎症损伤[4]。为此,笔者用脂多糖(LPS)复制大鼠ALI/ARDS模型,用通腑泻肺中药进行干预,探讨其对ALI/ARDS大鼠肠屏障的影响。
1 材料 1.1 动物健康SD大鼠27只,雄性,体质量(200±20)g,购自北京维通利华实验动物技术有限公司(许可证号:SCXX(京)2012-0001),购入后置中国医学科学院生物医学工程研究所实验中心常规饲养。
1.2 药物及试剂通腑泻肺中药颗粒剂(葶苈子、桑白皮、大黄、枳实、厚朴),购自天津中医药大学第二附属医院药房。通腑泻肺方用蒸馏水配置,4 ℃冰箱保存备用。大肠杆菌内毒素脂多糖(美国,Sigma公司)。免疫组化试剂盒购自北京中杉金桥生物公司。
1.3 仪器去离子水仪,PALL, Purelab Plu。高速离心机,Centrifuge 5415D,Eppendorf公司。分光光度计,NANODROP 2000,Therno scientific。涡旋振荡仪,QL-902,海门市其林贝尔仪器制造有限公司。转移脱色摇床,TS-8,海门其林贝尔仪器制造公司。
2 方法 2.1 ALI/ARDS模型的建立及分组给药动物购入后适应性饲养1周,将大鼠按随机数字随机分为空白对照组、模型组、中药组,每组9只。模型组与中药组于左侧尾静脉注射内毒素8 mg/kg,复制ALI/ARDS模型。正常对照组大鼠静脉注射生理盐水。对照组与模型组在造模完成后即用生理盐水灌服,每次0.01 mL/g。治疗组在造模完成后给予通腑泻肺中药灌胃,每次0.01 mL/g,每日1次,共7日。
2.2 镜下观察给药1周后,截取距幽门下15 cm处肠组织,10%甲醛溶液固定,常规石蜡切片,进行苏木精-伊红(HE)染色检测。光镜下观察,比较分析各组大鼠肠组织病理学改变。
2.3 酶联免疫吸附反应(ELISA)法检测大鼠血血浆D-乳酸及DAO水平于大鼠腹主动脉取血,离心后进行ELISA实验,分别测定血浆中浆D-乳酸、DAO的表达情况。操作步骤按参照试剂盒说明书进行。将检测结果用ELISA标准曲线专用软件分别作出浆D-乳酸、DAO浓度的标准曲线,分别用标准曲线计算出各检测孔中浆D-乳酸及DAO的浓度。
2.4 免疫组化染色方法检测检测肠组织NF-κB P65及TLR4蛋白的表达将组织切片行脱蜡、水化处理后,高压修复抗原,用3%过氧化氢溶液消除内源性过氧化酶,血清封闭后各组切片分别加入兔源性核转录因子-κB(NF-κB)P65及TLR4多克隆抗体(均为1:100稀释),4 ℃过夜后加入兔二抗,经二氨基联苯胺兰(DAB)显色,光镜下观察。NF-κB P65及TLR4的阳性反应产物均呈棕黄色。光学显微镜下随机观察5个视野、拍照,代表该动物肺组织蛋白表达强度。应用Image-Pro Plus6.0软件分析阳性细胞数,同时将空白组阳性细胞率设置为100%,计算其他组别的阳性细胞率,并对结果进行统计分析。
2.5 统计学方法采用SPSS19.0统计软件包进行统计分析。数据以均数±标准差(x±s)表示,多组间比较用单因素方差分析,组间两两比较采用Newman-Keuls检验,P < 0.05为差异有统计学意义。
3 结果 3.1 大鼠肠组织病理情况空白组大鼠肠组织光镜下可见肠绒毛排列整齐,上皮完整,绒毛局部轻度变矮、增粗,细胞结构正常;部分黏膜下层水肿,部分固有层轻度水肿,部分黏膜层与肌层轻度分离。模型组大鼠肠组织可见肠绒毛局部上皮脱失,绒毛变矮、增粗、融合;黏膜下层广泛水肿,血管增生、较多炎细胞浸润,可见孤立淋巴小结;固有层较多淋巴细胞为主的炎细胞浸润;黏膜层与肌层广泛分离。中药组大鼠肠组织光镜下可见肠黏膜上皮完整,大部分上皮平坦,局部绒毛变矮、增粗,细胞结构正常;黏膜下层轻度水肿,部分固有层轻度水肿,少量淋巴细胞浸润;部分黏膜层与肌层轻度分离,见图 1。
|
| 图 1 各组大鼠肠组织病理结果 Fig. 1 Intestinal histopathology results of rats in each group |
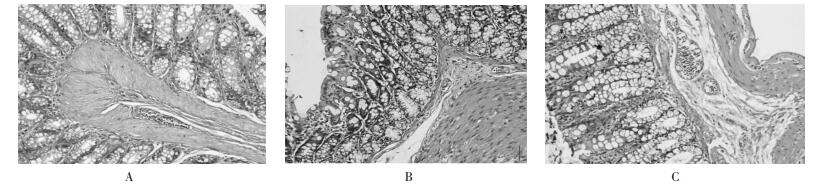
与空白组相比,模型组可见大鼠血浆D-乳酸、DAO含量显著升高(P < 0.05)。与模型组相比, 治疗组血浆D-乳酸、DAO含量明显降低(P < 0.05),见表 1。
|
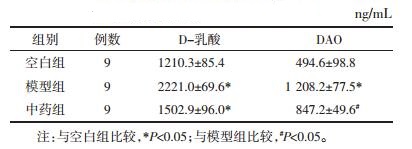
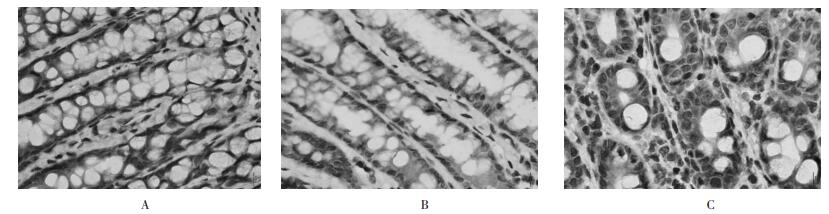
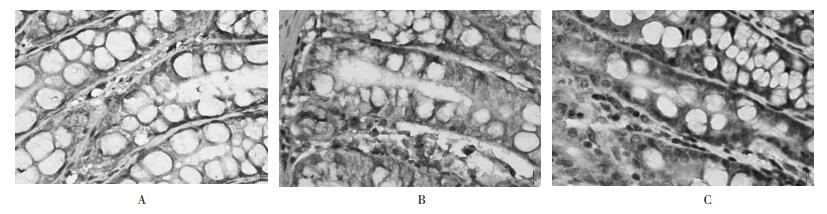
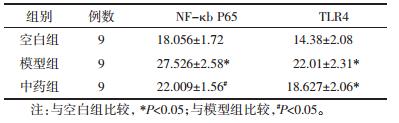
与空白组比较,模型组可见NF-κB P65表达显著升高(P < 0.05);中药组经过治疗干预后,NF-κB P65表达下降,差异具有统计学意义(P < 0.05)。与空白组比较,模型组可见TLR4表达增强,差异有统计学意义(P < 0.05);中药组经过治疗干预后,TLR4表达显著下降,差异具有统计学意义(P < 0.05),见图 2、图 3、表 2。
|
| 图 2 NF-κB P65在肠组织的表达 Fig. 2 Expression of NF-κ B P65 in the intestinal tissue |
|
| 图 3 TLR4在肠组织的表达 Fig. 3 Expression of TLR4 in the intestinal tissue |
|
长期以来,人们对肠道功能的认识偏重于肠道对营养物质的消化吸收。对危重患者通常认为胃肠功能处于休眠状态,忽略了胃肠功能在患者整体病理生理过程中的作用。20世纪60年代,Ravin等首先提出胃肠道是发生多器官功能衰竭前无明确感染灶的病人发生脓毒症的潜在致病源。20世纪80年代Border等进一步提出肠源脓毒血症(Gos)的概念。1988年Wilmore等提出了“肠道发病的中心器官”学说,肠道屏障功能已引起了人们广泛而密切的关注。ALI/ARDS状态下,炎症介质大量产生并相互作用, 形成网络,且不断循环促进,形成“瀑布样”反应, 造成肠黏膜损伤加重甚至衰竭,肠道的屏障功能受到削弱或损害, 可使大量的细菌和内毒素经过门静脉和肠黏膜淋巴系统侵入循环,造成肠源性内毒素血症和菌群移位,并在一定条件下激发细胞因子和其他炎症介质的连锁反应, 引起全身器官的损害[5]。已有许多研究证明肠道在全身炎症反应综合征(SIRS)、脓毒症、MODS的连续发生发展中起重要作用[6-7]。有研究发现脓毒症引起的肺、肠和肾的上皮功能紊乱,屏障功能和离子运输功能受到影响,从而发生器官功能障碍,造成死亡[8]。研究表明选择性肠道去污能抑制SIRS患者内毒素和炎症介质的释放,并能起到较好的保护作用,其机制可能与保护肠黏膜屏障功能有关[9]。
根据ALI/ARDS临床表现的呼吸窘迫、发绀、便秘、腹满等特点,传统医学从“肺与大肠相表里”这一体现脏腑相关的整体观的理论出发,将ALI/ARDS病机特点概括为肺肠同病,治疗当以通腑泻肺为法。通腑泻肺中药由大黄、枳实、厚朴、葶苈子、桑白皮组成。方中大黄、厚朴、枳实,可以轻下热结,除满消痞。葶苈子、桑白皮泻肺平喘,行水消肿。全方药简力专,既能泻肺平喘,又能通腑泻热,肺肠同治。研究发现大黄和早期肠内营养支持治疗能改善大鼠肠缺血-再灌注损伤后肠黏膜屏障的影响,减轻血清内毒素血症和细菌易位[10]。药理研究证实[11]大黄能够改善肠黏膜血流灌注,改善肠黏膜缺血缺氧状态,促进胃肠蠕动恢复, 保护胃肠黏膜屏障。桑白皮丙酮提取物能够使豚鼠肠系膜毛细血管交叉数目明显增加,改善血流状态,增加血流速度。
本实验结果发现,模型组大鼠肠组织病理可见肠绒毛变矮、增粗融合,黏膜下层广泛水肿,炎细胞浸润,固有层较多淋巴细胞为主的炎细胞浸润;黏膜层与肌层广泛分离。通腑泻肺中药干预后的大鼠肠组织病理损伤减轻。模型组大鼠血浆D-乳酸、DAO明显升高,提示模型组大鼠肠黏膜受到损伤,其通透性增高,肠组织细胞受损坏死释放大量DAO入血,血浆DAO活性增高。通腑泻肺中药干预后可降低血浆D-乳酸和DAO,提示运用通腑泻肺法可以减轻ALI/ARDS模型大鼠肠黏膜损伤,对肠屏障具有保护作用。模型组大鼠肠组织NF-κB P65、TLR4蛋白表达升高,通腑泻肺中药干预后其表达显著降低,提示通腑泻肺中药可以抑制TLR4、NF-κB介导的炎症反应,降低炎症反应程度。本实验发现通腑泻肺中药对ALI/ARDS病理过程中释放的大量炎性细胞因子有抑制作用,改善ALI/ARDS时肠黏膜的缺血缺氧状态,增加肠黏膜血流灌注,减轻肠黏膜细胞损害,降低肠黏膜通透性,对肠黏膜屏障起到保护作用。但是其作用机制复杂,靶点众多,需要进一步深入探索。
| [1] | Magnotti LJ, Deitch EA. Burns, bacteriatranslocation, gutbarrier function and failure[J]. J Burn Care Rehabil, 2005, 26 (5): 383–391. DOI:10.1097/01.bcr.0000176878.79267.e8 |
| [2] | Hassoun HT, Kone BC, Mercer DW, et al. Post-injury multiple organ failure:therole of the gut[J]. Shock, 2001, 15 (1): 1–10. DOI:10.1097/00024382-200115010-00001 |
| [3] | 张涛, 熊旭东, 李淑芳. 通腑泻肺方治疗肺系脓毒症(痰热壅肺证)的临床研究[J]. 中国中医急症, 2014, 23 (10): 1788–1790. DOI:10.3969/j.issn.1004-745X.2014.10.006 |
| [4] | 刘恩顺, 苏景深, 孙增涛, 等. 通腑泻肺法对ALI/ARDS大鼠免疫炎症损伤影响的实验研究[J]. 天津中医药, 2011, 28 (2): 97–100. |
| [5] | Jakubczyk M, Rozowicz A, Spychalska K, et al. Analysis of occurrence of bacteraemia with pathogens from gastrointestinal tract in patients fed parenterally and enterally in the intensive care unit[J]. Prz Gastroenterol, 2016, 11 : 127–130. |
| [6] | Ruh J, vogel F, Sehxnidt E, et al. Effects of hydrogen peroxidescavenger Catal as eonvillous mieroeireulation in the rats mallintestine inamodel of inflamation bowel disease[J]. Microvase Res, 2000, 59 (3): 329–337. DOI:10.1006/mvre.1999.2201 |
| [7] | Schulz K, Sommer O, Jargon D, et al. Cytokine and radical inhibition in septic intestinal barrier failure[J]. J Surg Res, 2015, 193 (2): 831–840. DOI:10.1016/j.jss.2014.08.056 |
| [8] | Chawla LS, Fink M, Goldstein SL, et al. The Epithelium as a target in sepsis[J]. J Shock, 2016, 45 (3): 249–258. |
| [9] | Wang Y, Lu S, Gao J, Wang Z, et al. Effect of selective gut decontamination in regulation of inflammatory reaction in patients with systemic inflammatory response syndrome[J]. Zhonghua Wei Zhong Bing Ji Jiu Yi Xue, 2015, 27 (6): 484–488. |
| [10] | 杨海波, 张静喆, 蔡骏, 等. 大黄和早期肠内营养对肠缺血-再灌注损伤大鼠肠屏障功能的影响[J]. 肠外与肠内营养, 2011, 18 (6): 364–367. DOI:10.3969/j.issn.1007-810X.2011.06.014 |
| [11] | 陈德昌, 景炳文, 杨兴易, 等. 大黄对危重症患者胃肠道的保护作用[J]. 中国危重病急救医学, 2000, 12 (2): 87–90. DOI:10.3760/j.issn:1003-0603.2000.02.008 |
2. Tianjin Jinnan District Xianshuigu Hospital, Tianjin 300073, China;
3. Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China
 2018, Vol. 35
2018, Vol. 35