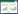文章信息
- 李兵, 张婵, 林芳, 李自明, 周剑
- LI Bing, ZHANG Chan, LIN Fang, LI Ziming, ZHOU Jian
- 葛根素通过Nrf2/ARE通路调控小神经胶质BV-2细胞的氧化应激损伤
- Protective effects of puerarin on oxidative stress in BV-2 microglia through Nrf2/ARE signaling pathway
- 天津中医药, 2018, 35(12): 943-946
- Tianjin Journal of Traditional Chinese Medicine, 2018, 35(12): 943-946
- http://dx.doi.org/10.11656/j.issn.1672-1519.2018.12.19
-
文章历史
- 收稿日期: 2018-08-20
帕金森病多常见于老年人,属于一种神经退行性功能障碍病变,临床病症主要为震颤麻痹,病理特征表现在多巴胺能神经元损伤[1]。早期研究表明机体受到氧化应激刺激时,机体氧化/抗氧化系统失衡,抗氧化能力减弱,导致自由基过得堆积,引起机体的严重损伤。其中活性氧(ROS)是氧化应激损伤的主要产物之一,并且在帕金森病发生发展中起着重要的作用[2]。发现核转录因子(Nrf2)可以通过介导抗氧化反应元件(AER)活性来调节氧化应激途径[3]。于是,探讨Nrf2/AER信号通路的调控作用对帕金森病的发病机制的研究具有重大意义。早期也有研究发现葛根素对6-羟多巴胺所致帕金森病大鼠具有保护作用[4],而且葛根素还可通过Nrf2/ARE信号通路抵抗氧化应激对创伤性脑损伤的神经保护[5]。因此,本文旨在研究葛根素对BV-2细胞氧化应激损伤的保护作用,并对其可能调控Nrf2/ARE信号通路活化这一机制进行探讨。
1 材料及方法 1.1 材料及试剂小神经胶质BV-2细胞购买于南京科默生物细胞库;葛根素(武汉远成共创科技有限公司,纯度98%,批号:23521-698-23);CCK8试剂盒(上海威奥生物科技有限公司,批号:CJ-150-25);丙二醛(MDA)试剂盒(上海恒远生物科技有限公司,批号:SHP-1230-24);一氧化氮(NO)试剂盒(江苏泽雨生物科技有限公司,批号:HTC-4203-54);超氧化物歧化酶(SOD)试剂盒(北京默沙克生物科技有限公司,批号:SJ-1540-93);BCA蛋白浓度测定试剂盒(北京索莱宝生物科技有限公司,批号:C15740);SDS-PAGE凝胶配制试剂盒(武汉谷歌生物科技有限公司,批号:20170512);RPMI 1640培养基(Gibco公司,批号:RT-1630-21);β-actin、HO-1、SOD1、Jak2、p-Jak2、State3及p-State3一抗均购自美国Sigma公司;对应二抗购自武汉谷歌生物有限公司。
1.2 仪器酶标仪(南京德铁仪器公司,型号:HBS-1096A);单人超净台(济南鑫贝西生物技术有限公司,型号:BBS-V800);细胞培养箱(上海旦鼎国际贸易有限公司,型号:SANYO);双色红外激光成像系统(美国BIO-RAD,批号:LI-COR ODYSSEY)。
1.3 BV-2细胞培养将单人超净工作台及相关实验物品紫外光照消毒30 min,复苏BV-2细胞进行传代培养,1640完全培养基(10%胎牛血清,1%的100 U/mL青霉素及100 mg/mL链霉素)于37 ℃、5%CO2培养箱中培养,每隔2 d换液1次,培养3~4 d进行传代培养,并在倒置显微镜下观察细胞形态,取对数生长期细胞进行后续实验。
1.4 细胞存活率实验取对数期细胞进行消化、离心、重悬、计数后,取适量细胞数接种于96孔板中,培养过夜,分为空白对照组、H2O2诱导模型组、H2O2+5 μmol/L葛根素组、H2O2+10 μmol/L葛根素组、H2O2+20 μmol/L葛根素组,培养24 h后吸干旧培养基,每孔加入100 μL含10 μL CCK8试剂的完全培养基,继续于37 ℃、5 %CO2培养箱中孵育1 h,然后在波长450 nm处的酶标仪中测定每孔吸光度值。
1.5 细胞匀浆MDA、NO及SOD检测取对数期细胞进行消化、离心、重悬、计数后,取适量细胞数接种于6孔板中,培养过夜,分为空白对照组、H2O2诱导模型组、H2O2+5 μmol/L葛根素组、H2O2+10 μmol/L葛根素组、H2O2+20 μmol/L葛根素组,于37 ℃、5%CO2培养箱中培养24 h后,收集细胞制备成匀浆,按照试剂盒操作说明书进行MDA、NO水平及SOD活性检测。
1.6 免疫印迹检测蛋白水平取对数期细胞进行消化、离心、重悬、计数后,取适量细胞数接种于6孔板中,培养过夜,分为空白对照组、H2O2诱导模型组、H2O2+5 μmol/L葛根素组、H2O2+10 μmol/L葛根素组、H2O2+20 μmol/L葛根素组,于37 ℃、5 %CO2培养箱中培养24 h后,收集细胞、裂解、离心、收集上清、检测蛋白浓度。然后每孔上样量50 μg,进行电泳分析、转膜、封闭、孵育一抗过夜、洗膜、孵育二抗、洗膜及蛋白表达分析。
1.7 统计学分析采用SPSS 20.0软件进行统计分析,实验数据用(x±s)表示,组间比较采用单因素方差分析检验,组间两两比较采用LSD法,P < 0.05具有统计学意义。
2 结果 2.1 葛根素对BV-2细胞存活率的影响采用CCK8试剂盒分析了葛根素对BV-2细胞存活率的影响,结果如表 1所示。结果显示:单纯的H2O2刺激可明显降低细胞的存活率,相对于正常对照组差异有统计学意义(P < 0.05);而经过不同剂量葛根素干预24 h后,可见葛根素可明显提高细胞的存活率,并随着药物剂量升高细胞的相对存活率升高的越明显,表现出浓度依赖性,并且各药物组与H2O2诱导组之间差异均有统计学意义(P < 0.05),药物组两两之间的比较差异也有统计学意义(P < 0.05)。
|
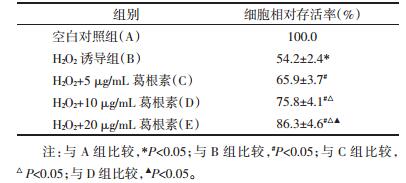
相关试剂盒分析了葛根素对BV-2细胞氧化应激产物含量的影响,结果见表 2。结果显示:单纯的H2O2干预可明显诱导MDA、NO的释放及降低SOD的活性,相对于正常对照组差异有统计学意义(P < 0.05);经过不同浓度葛根素干预后,匀浆中MDA、NO的水平显著减少,而SOD酶活性则明显升高,与H2O2诱导组相比差异均有统计学意义(P < 0.05),并且随着葛根素剂量的升高,3种指标与H2O2诱导组之间的差异越显著,表现出浓度依赖性。
|
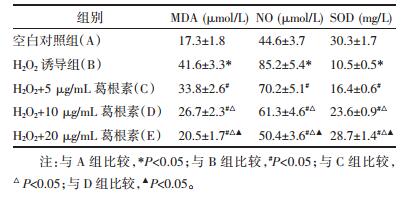
H2O2干预组BV-2细胞中细胞核内Nrf2的表达显著低于正常对照组,差异有统计学意义(P < 0.05)。随着不同剂量的葛根素干预后,胞核内Nrf2的表达显著升高,与H2O2干预组相比差异均有统计学意义(P < 0.05)。如图 1所示。
|
| 图 1 葛根素对Nrf2核转位的影响(n=6) Fig. 1 Effect of puerarin on Nrf2 translocation in the BV-2 cell(n=6) |
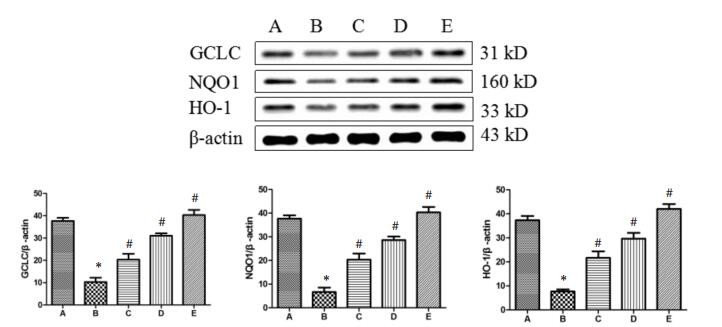
H2O2干预组BV-2细胞中GCLC、NQO1和HO-1蛋白的表达显著低于正常对照组,差异有统计学意义(P < 0.05)。随着不同剂量的葛根素干预后,细胞中GCLC、NQO1和HO-1蛋白的表达显著升高,与H2O2干预组相比差异均有统计学意义(P < 0.05)。如图 2所示。
|
| 图 2 葛根素对GCLC、NQO1和HO-1蛋白的影响(n=6) Fig. 2 Effect of puerarin on the expression of GCLC, NQO1 and HO-1 in the BV-2 cell (n=6) 与空白对照组比较,*P<0.05;与H2O2诱导组比较,#P<0.05。A:空白对照组;B:H2O2诱导组;C:H2O2+5 μg/mL葛根素组;D:H2O2+10 μg/mL葛根素组;E:H2O2+20 μg/mL葛根素组。 |
当前有关研究显示,葛根素具有广泛的药理作用,如在治疗高脂血症、糖尿病、老年性痴呆、心脏缺血再灌注损伤等疾病都表现出良好的疗效[6],并且其针对不同的疾病治疗机制也各不相同。在葛根素改善心脏缺血/再灌注损伤过程中,主要通过诱导PI3K/AKT信号通路活化进一步上调eNOS基因表达来实现。氧化应激属于大量自由基堆积引发的损伤,引起机体氧化/抗氧化系统失衡,而且氧化应激还是导致衰老和病态的一个重要原因[7]。诱导抗氧化因子间协调作用能够帮助恢复抗氧化系统功能,从而有效的对抗氧化应激损伤。H2O2是诱导氧化应激损伤的良好诱导剂,虽然小神经胶质细胞是大脑的神经性免疫细胞,对炎性因子比较敏感,并且还能够进一步诱导氧化应激损伤。然而,文章主要探讨葛根素对BV-2细胞氧化应激损伤的影响,采用H2O2诱导的氧化应激模型比较单一,可以降低其他炎性反应的影响。文章采用H2O2诱导BV-2细胞氧化应激损伤模型,发现H2O2诱导组细胞产生的氧化应激产物MDA及NO显著升高,抗氧化酶SOD活性显著降低,说明氧化应激损伤模型构建成功。经过不同浓度葛根素干预损伤细胞后发现,不同剂量的葛根素可明显增加细胞的存活率、降低氧化应激产物MDA及NO的释放及增强SOD酶活性,提示葛根素对氧化应激损伤的BV-2细胞具有较好的保护作用。
前期研究证实葛根素能够促进脑组织内源性抗氧化剂活性,达到清除脑组织堆积的自由基,缓解氧化应激损伤,改善神经元的损伤[8-9]。但葛根素作用的具体机制尚不是很清楚,已有研究说明人体内多种抗氧化酶均含有一个相同的启动子序列,即抗氧化反应元件(ARE)[10]。其中转录因子NF-E2相关因子2(Nrf2)与ARE结合在抗氧化应激损伤中发挥着关键性作用。Nrf2/ARE信号通路为细胞内作用的抗氧化防御机制,即当机体受到受到外界刺激时发生细胞内氧化还原状态的变化,其中Nrf2能磷酸化进而与Keap1解偶联,进入细胞核,进而与相关基因的ARE序列结合编码靶基因的转录[11]。本文研究发现葛根素可明显增强Nrf2的转位,并诱导其下游靶基因GCLC、NQO1及HO-1蛋白的表达。综上所述,葛根素可明显降低BV-2细胞的氧化应激损伤,其作用机制可能与Nrf2/ARE信号通路的活化有关。
| [1] | 罗海龙, 尹昌浩, 姜爱英. 止颤平郁汤配合美多巴治疗帕金森病33例[J]. 中国实验方剂学杂志, 2011, 17 (11): 294–297. DOI:10.3969/j.issn.1005-9903.2011.11.089 |
| [2] | 王冬梅, 海静如, 魏风, 等. 帕宁方对帕金森病大鼠行为及氧化应激反应的影响[J]. 中国实验方剂学杂志, 2012, 18 (10): 199–204. DOI:10.3969/j.issn.1005-9903.2012.10.055 |
| [3] | Tufekci KU, Civi Bayin E, Genc S, et al. The Nrf2/ARE pathway:a promising target to counteract mitochondrial dysfunction in Parkinson's disease[J]. Parkinsons Dis, 2011, 2 (4): 1–7. |
| [4] | 黎荣, 徐灵源, 梁韬, 等. 葛根素对6-羟多巴胺所致帕金森病大鼠黑质组织Nrf2/ARE通路的影响[J]. 中国实验方剂学杂志, 2013, 19 (6): 230–233. |
| [5] | 陈江生, 陈保东, 凌毕益, 等. 葛根素通过Nrf2-ARE信号通路抵抗氧化应激对创伤性脑损伤的神经保护作用[J]. 卒中与神经疾病, 2017, 24 (2): 91–94. DOI:10.3969/j.issn.1007-0478.2017.02.002 |
| [6] | 蔡雅卫, 张岫美, 魏欣冰. 乙酰葛根素对低糖低氧/复供损伤大鼠大脑皮层神经元凋亡的影响[J]. 中国中医药科技, 2013, 20 (2): 155–156. DOI:10.3969/j.issn.1005-7072.2013.02.037 |
| [7] | Sies H. Oxidative stress:oxidants and antioxidants[J]. Exp Physiol, 2013, 82 (2): 291–296. |
| [8] | Wang JW, Wang HD, Cong ZX, et al. Puerarin ameliorates oxidative stress in a rodent model of traumatic brain injury[J]. J Surg Res, 2014, 186 (1): 328–37. DOI:10.1016/j.jss.2013.08.027 |
| [9] | Zhou Y, Xie N, Li L, et al. Puerarin alleviates cognitive impairment and oxidative stress in APP/PS1 transgenic mice[J]. Int J Neuropsychopharmacol, 2014, 17 (4): 635–644. DOI:10.1017/S146114571300148X |
| [10] | Leonarduzzi G, Sottero B, Poli G. Targeting tissue oxidative damage by means of eell signaling modulators:the antioxidant concept revisited[J]. Pharmaeol Ther, 2010, 128 (2): 336–374. DOI:10.1016/j.pharmthera.2010.08.003 |
| [11] | Abed DA, Goldstein M, Albanyan H, et al. Discovery of direct inhibitors of Keap1-Nrf2 protein-protein interaction as potential therapeutic and preventive agents[J]. Acta Pharm Sin B, 2015, 5 (4): 285–299. DOI:10.1016/j.apsb.2015.05.008 |
 2018, Vol. 35
2018, Vol. 35