文章信息
- 刘钰, 何永恒
- LIU Yu, HE Yongheng
- 专利方四妙君逸软膏促愈机制的实验研究
- Experimental study of mechanism of promoting wound healing of patented product of Simiao Junyi ointment
- 天津中医药, 2018, 35(2): 134-138
- Tianjin Journal of Traditional Chinese Medicine, 2018, 35(2): 134-138
- http://dx.doi.org/10.11656/j.issn.1672-1519.2018.02.17
-
文章历史
- 收稿日期: 2017-12-05
专利方四妙君逸软膏(以下简称专利方)来源于湖南中医药大学第二附属医院著名专家何永恒教授的经验方,通过正交实验优选出该方的最佳配比,利用现代技术提取该方的有效部位,采取最优成型工艺制成的一种外用于肛肠病术后的止痛促愈中药复方,并在此基础上经过多次工艺改良制成现在的专利药膏——四妙君逸软膏(专利号:ZL2012103028669)[1-4]。在前期研究中本课题组发现该药膏除具镇痛作用外还兼一定的促愈[5-8]作用,但其具体作用机制不明,值得进一步研究,现将本研究结果报道如下。
1 材料与方法 1.1 实验动物SPF级SD大鼠90只,雄性,体质量(260~280)g,由湖南中医药大学动物实验中心提供[合格证号:scxk(湘)2011-0003],饲养于本校动物实验中心SPF级动物房。
1.2 药品、试剂与仪器专利方四妙君逸软膏(湖南中医药大学药学院药剂学教研室制备提供,批号:20150321);卡波姆基质软膏(湖南中医药大学药学院药剂学教研室制备提供,批号:20150115);重组人表皮生长因子凝胶(中国桂林华诺威基因药业有限公司生产,批号:20140604);龙珠软膏(马应龙药业集团股份有限公司,批号:141104);转化生长因子-α(TGF-α)酶联免疫吸附(ELISA)试剂盒(南京建成科技有限公司,批号:BPE10963B 201511);白介素-1β(IL-1β)ELISA试剂盒(武汉博士德生物工程有限公司,批号:1151151522);表皮生长因子受体(EGFR)抗体(北京博奥森生物技术有限公司,批号:20151126)。HHS-2电子恒温不锈钢水浴锅(上海南阳仪器有限公司);DNP-9162型电热恒温培养箱(上海精宏实验设备有限公司);Motic B5显微摄像图像分析系统(麦克奥迪实业集团公司);OLYMPUS BX43型双目生物摄像显微镜(日本产)。
1.3 实验方法 1.3.1 动物模型的制备将90只大鼠按每只3 mL/kg的剂量标准将水合氯醛注射入腹腔内进行麻醉。麻醉成功后,在大鼠的背部,腰椎正中偏上用电动剃刀剃毛备皮,面积约7 cm×4 cm大小。脱毛处常规消毒,铺无菌单,选择背中部脊柱两侧各旁开1 cm,距肩脚骨以下2 cm处制备创面,用创伤制作器切割2个直径为18 mm圆形创面,深达皮下深筋膜层,形成机械创伤动物模型[9]。
1.3.2 实验方法按随机数字表法将造模成功的90只SD大鼠分为5组,每组18只,每只大鼠背部2个创面,统一以右侧创面为给药组,左侧为自身对照组,每日统一上午8点至9点换药1次,其中模型组不予任何药膏,空白对照组予卡波姆基质软膏(2.6 g/kg),重组人表皮生长因子组予重组人表皮生长因子凝胶(2.6 g/kg),龙珠软膏组予龙珠软膏(2.6 g/kg),专利方组予专利方(2.6 g/kg)。每组内再随机均分为3组,于造模后第7、14天分别处死每个大组里的第1、2组大鼠,剩下第3组大鼠一直观察右侧创面至完全上皮化。
1.3.3 宏观整体水平观察不同时相点大鼠创面愈合情况每次换药时将大鼠置于预设装置上固定,揭去敷料后,碘伏消毒伤口周缘,取固定距离处垂直于伤口拍摄带标尺伤口图片,采用Image J1.48软件(美国国立卫生研究院)处理图片,计算伤口面积[10]。再根据创面愈合率=(原创面面积-未愈合创面面积)/原创面面积×100%计算各组大鼠术后第7天和第14天的创面愈合率。观察记录大鼠右侧创面完全上皮化的最终时间。用苏木精-伊红染色法(HE染色法)观察大鼠的病理组织愈合情况,并结合改良细化的病理组织学愈合标准(见表 3)[11]给各组大鼠创面愈合情况评分,最后用统计学方法定量分析其创面愈合情况。
| 分 | ||||||
| 标准 | 评分 | |||||
| 0 | 1 | 2 | 3 | 4 | 5 | |
| 表皮结构 | 缺乏 | 完全破坏 | 部分坏死 | 溃疡 | 部分破坏 | 正常 |
| 真皮-表皮邻接 | 无表皮对真皮附着 | < 25%表皮对真皮附着 | > 25%且 < 50%表皮对真皮附着 | > 50%且 < 75%表皮对真皮附着 | > 75%且 < 100%表皮对真皮附着 | 正常 |
| 胶原束 | 无胶原束 | 有少量胶原束,且胶原束破坏 | 有胶原束,大部分胶原束紊乱 | 有胶原束,胶原束,少部分紊乱 | 有少量胶原束,胶原束排列有序 | 正常 |
| 表皮再生 | 无 | < 25% | > 25%且 < 50% | > 50%且 < 75% | > 75% | > 90% |
| 粒细胞浸润 | > 21 | 16-20 | 11-15 | 6-10 | < 5 | < 3 |
用免疫组化法测大鼠背部创面肉芽组织中EGFR的表达。用ELISA法测大鼠血清中TGF-α和IL-1β浓度。
1.3.5 统计学方法用SPSS 19.0统计软件分析处理,计量资料以均数±标准差(x±s)表示, 完全随机设计资料满足正态性和方差齐性后采用单因素方差分析;组间两两比较采用LSD法;P < 0.05表示差异有统计学意义。
2 结果与结论 2.1 宏观整体水平对不同时相点大鼠创面愈合情况的观察结果 2.1.1 不同时相点各组大鼠创面愈合率比较各组大鼠右侧创面愈合率的比较,见表 1。重组人表皮生长因子组在第7和14天创面愈合率最大,且与专利方组和龙珠软膏组比较差异有统计学意义(P < 0.01),而专利方组与龙珠软膏组比较差异无统计学意义(P > 0.05)。
| % | |||
| 组别 | 动物数 | 第7天愈合率 | 第14天愈合率 |
| 模型组 | 6 | 41.20±0.53**##ΔΔ | 82.02±0.77**##ΔΔ |
| 空白对照组 | 6 | 41.72±0.88**##ΔΔ | 82.60±1.05**##ΔΔ |
| 重组人表皮生长因子组 | 6 | 50.55±1.25## | 96.97±1.22## |
| 龙珠软膏组 | 6 | 47.03±1.11** | 91.73±0.56** |
| 专利方组 | 6 | 47.55±1.29** | 92.33±0.93** |
| 注:与重组人表皮生长因子组比较,*P < 0.05,**P < 0.01;与龙珠软膏组比较,#P < 0.05,##P < 0.01;与专利方组比较,ΔP < 0.05,ΔΔP < 0.01。 | |||
重组人表皮生长因子组创面愈合时间最短,专利方组次之,但两者之间比较差异无统计学意义(P > 0.05)。见表 2。
| 组别 | 动物数 | 愈合时间(d) |
| 模型组 | 6 | 19.17±0.75**##ΔΔ |
| 空白对照组 | 6 | 18.67±0.52**##ΔΔ |
| 重组人表皮生长因子组 | 6 | 16.00±0.63# |
| 龙珠软膏组 | 6 | 17.00±0.89* |
| 专利方组 | 6 | 16.67±0.82 |
| 注:与重组人表皮生长因子组比较,*P < 0.05,*P < 0.01;与龙珠软膏组比较,#P < 0.05,#P < 0.01,与专利方组比较,ΔP < 0.05,ΔΔP < 0.01。 | ||
目前常用的组织病理学评分标准较简单,总值较小[11],不适合对多个组别进行统计学多重比较,因此本研究在此标准基础上结合肛肠病术后创面愈合特点将各个评分标准细化,进行统计学分析。标准见表 3。
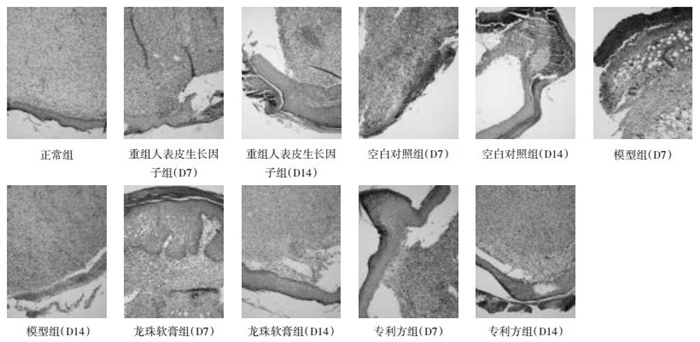
3个治疗组间比较总体趋势为重组人表皮生长因子组得分最高,专利方组次之,龙珠软膏组最低。其中第7天专利方组与重组人表皮生长因子组以及龙珠软膏组比较均有统计学意义(P < 0.05)。第14天专利方组与重组人表皮生长因子组比较差异有统计学意义(P < 0.05),与龙珠软膏组比较差异无统计学意义(P > 0.05)。见表 4、图 1。
| 分 | |||
| 组别 | 动物数 | 第7天 | 第14天 |
| 模型组 | 6 | 7.33±2.42**##ΔΔ | 14.67±1.51**##ΔΔ |
| 空白对照组 | 6 | 9.17±1.47**##ΔΔ | 15.67±0.82**##ΔΔ |
| 重组人表皮生长因子组 | 6 | 17.33±0.52##Δ | 20.50±1.05##Δ |
| 龙珠软膏组 | 6 | 11.67±1.86**Δ | 18.00±0.89** |
| 专利方组 | 6 | 15.17±0.98*# | 19.17±1.17* |
| 注:与重组人表皮生长因子组比较,*P < 0.05,**P < 0.01;与龙珠软膏组比较,#P < 0.05,##P < 0.01,与专利方组比较,◇P < 0.05,ΔΔP < 0.01。 | |||
|
| 图 1 各组大鼠创面肉芽组织不同时相点愈合情况HE染色(10×) Fig. 1 Healing situation of granulation tissue of wound surface on different time in each group of rats(10×) |
第7天和14天专利方组与重组人表皮生长因子组比差异有统计学意义(P < 0.01), 与龙珠软膏组比较差异无统计学意义(P > 0.05)。见表 5、图 2。
| 组别 | 动物数 | 第7天 | 第14天 |
| 模型组 | 6 | 85.62±4.04**##ΔΔ | 125.32±4.30**##ΔΔ |
| 空白对照组 | 6 | 81.90±4.48**##ΔΔ | 125.35±1.23**##ΔΔ |
| 重组人表皮生长因子组 | 6 | 32.60±4.47##ΔΔ | 104.73±2.13##ΔΔ |
| 龙珠软膏组 | 6 | 60.52±3.86** | 113.03±4.23** |
| 专利方组 | 6 | 57.23±3.99** | 110.48±1.11** |
| 注:与重组人表皮生长因子组比较, *P < 0.05, **P < 0.01;与龙珠软膏组比较,#P < 0.05,##P < 0.01,与专利方组比较,ΔP < 0.05,ΔΔP < 0.01。 | |||

|
| 图 2 各组大鼠创面肉芽组织不同时相点EGFR含量免疫组化图片(40×) Fig. 2 Immunohistochemisty of EGFR content of granulation tissue of wound surface on different time in each group of rats(40×) |
第7天专利方组与重组人表皮生长因子组比差异有统计学意义(P < 0.05),与龙珠软膏组比差异有统计学意义(P < 0.05);第14天专利方组与重组人表皮生长因子组比差异有统计学意义(P < 0.05),与龙珠软膏组比差异无统计学意义(P > 0.05)。见表 6。
| pg/mL | |||
| 组别 | 动物数 | 第7天 | 第14天 |
| 模型组 | 6 | 133.08±8.83**##ΔΔ | 112.76±11.53**ΔΔ |
| 空白对照组 | 6 | 145.77±7.88**##ΔΔ | 119.55±9.27**Δ |
| 重组人表皮生长因子组 | 6 | 201.71±13.27##Δ | 137.83±2.15##Δ |
| 龙珠软膏组 | 6 | 172.07±7.49**Δ | 122.14±2.99**# |
| 专利方组 | 6 | 187.40±13.71*# | 129.15±1.95* |
| 注:与重组人表皮生长因子组比较,*P < 0.05, **P < 0.01;与龙珠软膏组比较,#P < 0.05,##P < 0.01,与专利方组比较,ΔP < 0.05,ΔΔP < 0.01 | |||
第7天专利方组与重组人表皮生长因子和龙珠软膏组比较差异均无统计学意义(P > 0.05)。第14天各组大鼠血清中IL-1β显色不明显,未检测到。见表 7。
| pg/mL | ||
| 组别 | 动物数 | 第7天IL-1β浓度 |
| 模型组 | 6 | 99.09±24.13ΔΔ●● |
| 空白对照组 | 6 | 86.73±11.08ΔΔ●● |
| 重组人表皮生长因子组 | 6 | 74.38±13.21**## |
| 龙珠软膏组 | 6 | 75.60±7.34**## |
| 专利方组 | 6 | 71.79±13.78**## |
| 注:与模型组比较, *P < 0.05; **P < 0.01;与空白对照组比较,#P < 0.05, ##P < 0.01;与重组人表皮生长因子组比较,ΔP < 0.05,ΔΔP < 0.01;与龙珠软膏组比较,● P < 0.05,●●P < 0.01。 | ||
从创面愈合率、愈合时间和病理组织学观察等宏观观察指标结果可知专利方具有良好的促愈作用,且作用与龙珠软膏相当。虽然专利方组创面上皮化速度未及表皮生长因子组快,但是肉芽组织增长速度较快。这符合肛肠病术后创面要求肉芽组织的生长快于表皮生长的特点,否则容易形成死腔影响愈合。
随着分子生物学的发展, 许多研究认为创面愈合是一个生长因子和细胞因子相互协调作用的复杂过程[12]。生长因子在创伤修复和组织再生方面的作用已得到证实[13-15],其中EGFR可刺激组织细胞增殖、分化、迁移,促进新生肉芽组织形成和伤口的再上皮化, 加速多种组织的创伤愈合[16]。因此,在创面愈合过程中EGFR是组织再生的一个基本调节者,其作用非常重要。而TGF-α是EGFR的配体家族成员之一,被证实在促进创面愈合再生方面具有比表皮生长因子(EGF)更大的效能[17]。本实验中5组大鼠肉芽组织中的EGFR受体均在第7天表达最多,密度最高,这与有报道人的烧伤创面中EGFR表达第7天达到峰值[18]的研究结果相似。TGF-α的趋势同EGFR,说明TGF-α与EGFR受体表达水平呈正相关关系,提示本研究中的专利方可能是通过提高TGF-α与EGFR受体的结合产生促愈机制。
本课题组前期研究发现专利方的镇痛机制与炎症因子有关[8],细胞因子能刺激靶细胞分裂增殖和各种组织修复,增加细胞外基质合成,在创伤和大面积烧伤创面的修复重建中起着重要的作用,本研究结果提示专利方的促愈机制与其能够减少早期炎症因子IL-1β以及提高生长因子TGF-α的表达有关。因此推测专利方的止痛促愈机制与其抗炎机制有关。因此,专利方四妙君逸软膏能通过提高蛋白含量,上调生长因子TGF-α和EGFR的表达水平,降低炎症因子IL-1β浓度,从而促进创面愈合。
| [1] | 何永恒, 胡响当. 用于肛肠病术后镇痛的四妙君逸软膏组方研究[J]. 中华中医药杂志, 2010, 25 (10): 1694–1697. |
| [2] | 金艺淑, 何群, 何永恒, 等. 正交试验优选四妙君逸软膏提取工艺[J]. 中国药房, 2011, 22 (7): 603–605. |
| [3] | 何群, 韩军涛, 陈光宇, 等. 四妙君逸软膏与散剂离体透皮特性的比较研究[J]. 中成药, 2012, 34 (6): 1052–1056. |
| [4] | 彭思源, 何群, 陈光宇, 等. 四妙君逸软膏制剂处方筛选研究[J]. 中成药, 2015, 37 (11): 2544–2546. |
| [5] | 何永恒, 张湘杰, 罗敏. 四妙君逸软膏用于肛肠病术后换药镇痛的药理学实验研究[J]. 中华中医药杂志, 2010, 25 (11): 1871–1874. |
| [6] | 何永恒, 鲁龙生, 王晓艳. 四妙君逸软膏用于肛肠病术后止痛促愈的临床研究[J]. 湖南中医药大学学报, 2010, 30 (11): 51–54. |
| [7] | 何永恒, 罗敏. 四妙君逸软膏换药用于促进肛肠病术后创面愈合的研究[J]. 中国新药杂志, 2012, 21 (3): 18. |
| [8] | 何永恒, 李艳华. 四妙君逸软膏对肛肠病术后疼痛模型大鼠血清TNF-α, IL-6, IL-10影响的实验研究[C]. 2012医学前沿——中华中医药学会肛肠分会第十四次全国肛肠学术交流大会论文精选, 2012. |
| [9] | 付小兵, 王德文. 现代创伤修复学[M]. 北京: 人民军医出版社, 1999. |
| [10] | Irving BA, Weltman JY, Brock DW, et al. NIH ImageJ and slice-o-matic computed tomography imaging software to quantify soft tissue[J]. Obesity, 2007, 15 (2): 370–376. DOI:10.1038/oby.2007.573 |
| [11] | 黄康, 陈玉林. 创面愈合评价指标进展[J]. 中国修复重建外科杂志, 2001, 15 (2): 126–129. |
| [12] | 隋志甫, 刘静杰, 谷延敏, 等. 创面修复中骨桥蛋白和表皮生长因子受体表达变化的实验研究[J]. 中国医药导报, 2011, 8 (17): 22–24. DOI:10.3969/j.issn.1673-7210.2011.17.008 |
| [13] | Behm B, Babilas P, Landthaler M, et al. Cytokines, chemokines and growth factors in wound healing[J]. Journal of the European Academy of Dermatology and Venereology, 2012, 26 (7): 812–820. DOI:10.1111/jdv.2012.26.issue-7 |
| [14] | 王大鹏, 张桂梅, 罗力佳. 细胞生长因子修复骨骼肌损伤[J]. 中国组织工程研究, 2016, 20 (2): 273–278. DOI:10.3969/j.issn.2095-4344.2016.02.021 |
| [15] | 吴伟.重组人表皮生长因子与碱性成纤维生长因子促进角膜上皮损伤修复及血管新生[J].广州:南方医科大学, 2012. |
| [16] | Dinh T, Braunagel S, Rosenblum BI. Growth Factors in Wound Healing:The Present and the Future?[J]. Clinics in podiatric medicine and surgery, 2015, 32 (1): 109–119. DOI:10.1016/j.cpm.2014.09.010 |
| [17] | The molecular and cellular biology of wound repair[M]. Berlin: Springer Science & Business Media, 2013. |
| [18] | Eldad A, Weinberg A, Breiterman S, et al. Early nonsurgical removal of chemically injured tissue enhances wound healing in partial thickness burns[J]. Burns, 1998, 24 (2): 166–172. DOI:10.1016/S0305-4179(97)00086-7 |
 2018, Vol. 35
2018, Vol. 35