文章信息
- 赵海燕, 陈立波, 黎丽萍, 黄兴, 李静, 胡园园, 吕术昕
- ZHAO Haiyan, CHEN Libo, LI Liping, HUANG Xing, LI Jing, HU Yuanyuan, LYU Shuxin
- 虫草素对糖毒性胰腺INS-1E细胞保护作用
- Protection of Cordycepin in pancreatic INS-1E cells against glucotoxicity
- 天津中医药, 2018, 35(2): 139-142
- Tianjin Journal of Traditional Chinese Medicine, 2018, 35(2): 139-142
- http://dx.doi.org/10.11656/j.issn.1672-1519.2018.02.18
-
文章历史
- 收稿日期: 2017-12-04
2型糖尿病是以高血糖为首发特征的代谢障碍性疾病,与基因和环境因素密切相关[1]。胰岛素是机体唯一降低血糖的激素,主要由胰腺β细胞分泌。当β细胞的数量减少和功能受到损伤,不能适应环境变化分泌适量的胰岛素时, 血糖就会升高。持续高血糖可直接损害β细胞影响其功能,引起β细胞分泌胰岛素能力减弱和β细胞凋亡[2-3],进而加重血糖升高形成恶性循环, 这种现象称之为葡萄糖毒性[4]。虫草素是从蛹虫草中分离提取出的单体,属于腺苷类化合物,具有多种药理作用和生物效应。研究发现虫草素具有抗肿瘤、抗炎、抗病毒、免疫调节等药理作用[5],这些结果提示虫草素可能是一个多靶点的化合物,目前国内关于虫草素对糖尿病的治疗研究鲜有报道,本文初步探讨虫草素对胰腺β细胞在高糖毒性下的保护作用。
1 实验材料 1.1 药品与试剂虫草素购买于美国Sigma公司;胎牛血清(批号16000-044)、RPMI1640(批号22240089)购于美国Gibco公司;CCK-8细胞计数试剂盒(批号20160412)购于北京钮因华信科技发展有限公司;Akt(批号sc-8312),p-Akt(批号sc-4060s)和β-actin(批号sc-47778)抗体购于美国Santa Cruz公司,辣根过氧化酶标记鼠二抗(鼠抗兔IgG)(批号ZB2305)购买于北京中杉金桥公司,显影液购买于美国Millipore公司,胰岛素酶联免疫吸附剂测定(ELISA)试剂盒购于美国Salem公司,INS-1E胰岛细胞株购于协和细胞资源库。
1.2 仪器TECAN GENios pro酶标仪(瑞士);电子天平(德国Sartorius公司,型号BS124S)倒置显微镜(中国重庆光电仪器有限公司,型号XDS-1B);超净工作台(苏州净化公司,型号SW-CJ-2D);纯水仪(英国ELCA,型号Ultra-Genetics);水套式CO2培养箱(美国Thermoforma公司,型号3111),垂直电泳仪(美国Biorad公司)。
2 实验方法 2.1 CCK-8法检测INS-1E细胞增殖活性按照CCK-8细胞计数试剂盒说明书测定各组细胞增殖活性。细胞悬液(1×105/mL)按100 μL/孔的量加入96孔板中(边缘孔用无菌水填充),高糖(30 mmol/L葡萄糖)环境下培养,每孔加入含虫草素终浓度分别为6.25、12.5、25 μmol/L的培养液,用只含有溶媒的培养液作为空白对照,每个剂量组做7复孔,在培养箱培养24 h后,加入CCK-8试剂10 μL/孔,在培养箱孵育2 h后,用酶标仪测定各孔在450 nm波长的吸光度值。
细胞存活率(%)=A(加药)-A(空白)/A(0加药)-A(空白)×100
2.2 ELISA法检测胰岛素分泌和合成对数生长期的INS-1E细胞以8×104个/孔接种于24孔板中,分别用低糖(5.5 mmol/L葡萄糖)、高糖(30 mmol/L葡萄糖)和高糖+25 μmol/L虫草素培养3 d后,先用无糖的KRB[包括(mmol/L):135 NaCl,3.6 KCl,1.5 CaCl2,0.5 MgCl2,0.5 NaH2PO4,5 NaHCO3,10 HEPES及0.1% BSA,pH=7.4]缓冲液平衡1 h,再用含16.8 mmol/L葡萄糖的KRB缓冲液刺激30 min,分别收集上清和细胞,用ELISA试剂盒检测上清和细胞中胰岛素的量,并用相应的细胞蛋白量进行量化。
2.3 蛋白免疫印迹法(Western-blot)检测蛋白表达INS-1E细胞相应处理培养4 d后,用蛋白提取试剂盒提取细胞蛋白,利用BCA蛋白定量试剂盒定量,每组取等量蛋白(30 μg/lane)的样品进行电泳。完成电泳后转膜,转膜电流为300 mA,转膜时间为60 min。完成转膜后,置于封闭液含5%(W/V)的脱脂奶粉TBST溶液中,室温,封闭1 h。封闭结束后,用TBST洗涤膜一次,时间5 min。将待检测蛋白与用TBST稀释的一抗4 ℃冰箱过夜。一抗作用结束后,用TBST洗涤3次。将一抗相应的结合有辣根过氧化物酶的二抗按1:5 000稀释后,室温作用1 h。二抗作用完成后,洗涤膜3次,利用化学发光系统显色。
3 数据统计学处理使用SPSS 19.0软件,所有实验数据以均数±标准差(x±s)表示,两组间比较采用两独立样本t检验,多组资料之间比较采用单因素方差分析;两两比较采用LSD法,P < 0.05认为有统计学差异。
4 实验结果 4.1 高糖毒性对INS-1E细胞胰岛素分泌的影响将胰岛INS-1E细胞分别在低糖(5.5 mmol/L葡萄糖)和高糖(30 mmol/L葡萄糖)环境下培养3 d,用无糖的KRB缓冲液平衡1 h,再用含2.8 mmol/L或16.8 mmol/L葡萄糖的KRB缓冲液刺激30 min,用ELISA检测胰岛素分泌情况,发现高糖培养后INS-1E细胞对糖刺激的胰岛素分泌显著降低(P < 0.05),甚至对葡萄糖刺激失去反应性,而在低糖环境下培养的细胞在葡萄糖的刺激下胰岛素正常分泌,见表 1。
| 组别 | 胰岛素分泌量(ng/mg) | |
| 2.8 mmol/L | 16.8 mmol/L | |
| 5.5 mmol/L葡萄糖 | 47.50±7.32 | 99.41±12.42* |
| 30 mmol/L葡萄糖 | 50.27±9.48 | 53.13±6.52# |
| 注:与用G5.5葡萄糖培养用2.8mmol/L葡萄糖刺激的细胞比较,*P < 0.05;与用G5.5葡萄糖培养用16.8mmol/L葡萄糖刺激的细胞比较,#P < 0.05。 | ||
将胰腺INS-1E细胞在高糖(30 mmol/L葡萄糖)环境下,同时给予浓度分别为6.125、12.5、25 μmol/L的虫草素进行处理3 d后,用CCK-8试剂盒测量细胞增殖情况并计算细胞存活率。结果提示,单纯高糖毒性抑制胰腺细胞增殖,虫草素能够保护高糖毒性下胰腺INS-1E促进细胞增殖,提高细胞的存活率(P < 0.01),见表 2。
| 组别 | 剂量(μmol/L) | 细胞存活率(%) |
| 正常组 | - | 100 |
| 阳性组 | 30 mmol/L葡萄糖 | 49.13±6.54* |
| 虫草素组 | 6.125 | 51.52±7.67# |
| 虫草素组 | 12.5 | 55.34±8.14# |
| 虫草素组 | 25 | 89.78±10.24## |
| 注:与正常组比较,*P < 0.05;与阳性组(30 mmol/L葡萄糖)比较,#P < 0.05,##P < 0.01。 | ||
将胰腺INS-1E细胞在高糖(30 mmol/L葡萄糖)环境下,同时给予浓度为25 μmol/L的虫草素进行处理3 d后,用ELISA试剂盒测量细胞上清液胰岛素的含量,结果提示,在高糖毒性的环境下,虫草素能够促进胰腺细胞分泌胰岛素(P < 0.01),见表 3。
| 组别 | 剂量 | 胰岛素分泌量(ng/mg) |
| 对照组 | 5.5 mmol/L葡萄糖 | 99.47±10.57** |
| 阳性组 | 30 mmol/L葡萄糖 | 49.89± 4.65 |
| 虫草素+30 mmol/L葡萄糖组 | 25 μmol/L | 79.91± 6.32## |
| 注:与G30(30 mmol/L葡萄糖)比较,**P < 0.01;与G30(30 mmol/L葡萄糖)比较,##P < 0.01。 | ||
将胰腺INS-1E细胞在高糖(30 mmol/L葡萄糖)环境下,同时给予浓度为25 μmol/L的虫草素进行处理3 d后,收集细胞,提取总蛋白,用ELISA试剂盒测量总蛋白胰岛素的含量,结果提示,在高糖毒性的环境下,虫草素能够促进胰腺细胞合成胰岛素(P < 0.01),见表 4。
| 组别 | 剂量 | 胰岛素合成量(μg/mg) |
| 对照组 | 5.5 mmol/L葡萄糖 | 150.58±4.79** |
| 阳性组 | 30 mmol/L葡萄糖 | 48.51±3.27 |
| 虫草素+30 mmol/L葡萄糖组 | 25 μmol/L | 90.27±4.88## |
| 注:与G30(30 mmol/L葡萄糖)比较,**P < 0.01;与G30(30 mmol/L葡萄糖)比较,##P < 0.01。 | ||
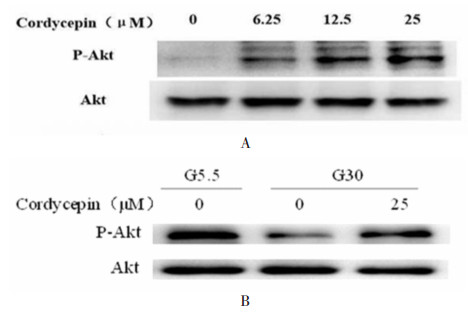
胰腺INS-1E细胞用不同浓度的虫草素处理2 h,收集细胞提取总蛋白,用Western-blot检测Akt磷酸化,发现虫草素能够增加Akt磷酸化水平,并具有浓度依赖性,见图 5A。将胰腺INS-1E细胞分别在低糖(5.5 mmol/L葡萄糖)和高糖(30 mmol/L葡萄糖)环境下培养3 d,同时在高糖环境下给予浓度为25 μmol/L的虫草素进行处理,收集细胞,提取总蛋白,结果提示,虫草素能够促进糖毒性INS-1E细胞Akt磷酸化作用,见图 5B。
|
| 图 5 虫草素促进糖毒性INS-1E细胞Akt磷酸化作用 Fig. 5 Akt phosphorylation of Cordycepin on glucotoxicity pancreas INS-1E cell |
糖尿病的发生是多因素造成的结果,或因β细胞本身原因引起的胰岛素合成和分泌不足,或因分泌的胰岛素在体内不能正常发挥作用。在引起糖尿病的众多因素中,其持续的高血糖对胰岛β细胞的损伤,引起β细胞的功能下降和调亡,进而引起胰岛素的合成和释放减少,是其中一个重要因素,这种高糖引起的β细胞的损伤称为糖毒性[6],近年研究表明2型糖尿病的发生发展与葡萄糖毒性所致β细胞数量减少和功能障碍有着密切的关系[7]。本文研究表明,在高糖环境下,虫草素能够减少糖毒性对胰腺INS-1E细胞的损伤,提高细胞的存活率,同时,糖毒性能够引起胰腺INS-1E细胞对胰岛素的合成和释放减少,虫草素能够在糖毒性条件下促进胰腺INS-1E细胞对胰岛素的合成和释放,虫草素在细胞水平上能够保护糖毒性对胰腺β细胞损伤作用。
Akt/PKB是一类非常重要的促进细胞存活的蛋白激酶。在哺乳动物体内,有3种非常保守的由不同基因编码的Akt异构体:PKBα/Akt1,PKBβ/Akt2及PKBγ/Akt3[4],3种异构体在β细胞均有表达[8]。Akt在细胞内的作用非常广泛,Akt磷酸化后可以促进细胞增殖,减少细胞凋亡[9-13],并且Akt磷酸化后能够使转录因子FoxO1磷酸化促进其从细胞核内转位至胞浆从而促进胰岛素生成的关键转录因子(PDX-1)的入核,继而增加胰岛素基因的转录[14-17],促进胰岛素的合成。虽然Akt调控胰岛素分泌的机制还不清楚,但研究发现Akt可以调节控制β细胞葡萄糖敏感性和代谢的蛋白葡萄糖转运蛋白2(GLUT2)和葡萄糖激酶(GCK)的表达[18-19]。此外,研究表明Akt可以调控胰岛素囊泡胞吐相关的SNARE(syntaxin-1、SNAP25、VAMP2)蛋白的表达[11];在转基因鼠的胰岛内过表达组成性磷酸化Akt可以促进胰岛素分泌,并且可以抵抗链脲霉素诱发的糖尿病[14]。相反,抑制Akt的磷酸化后β细胞分泌胰岛素明显减少[18],这些结果提示Akt能够调节β细胞胰岛素分泌。此外,有研究表明Akt活性在胰岛素抵抗和2型糖尿病患者体内显著降低[20]。本研究发现,虫草素在胰腺INS-1E细胞上能够促进Akt的磷酸化,活化Akt,并具有剂量依赖性,在糖毒性的环境下能够抑制胰腺INS-1E细胞的Akt磷酸化,经虫草素处理后能够促进Akt磷酸化,进而推测虫草素对糖毒性胰腺INS-1E细胞的保护作用可能与促进Akt的磷酸化,激活Akt有关,为进一步研究虫草素保护糖毒性损伤的胰岛细胞机制奠定了初步的科学依据。
| [1] | Peng D, Wang J, Zhang R, et al. CDKAL1 rs7756992 is associated with diabetic retinopathy in a Chinese population with type 2 diabetes[J]. Sci Rep, 2017, 7 (1): 8812–8824. DOI:10.1038/s41598-017-09010-w |
| [2] | Jia C, Chen H, Wei M, et al. Gold nanoparticle-based miR155 antagonist macrophage delivery restores the cardiac function in ovariectomized diabetic mouse model[J]. Int J Nanomedicine, 2017, 12 : 4963–4979. DOI:10.2147/IJN |
| [3] | Huang CN, Wang CJ, Lee YJ, et al. Active subfractions of Abelmoschus esculentus substantially prevent free fatty acid-induced β cell apoptosis via inhibiting dipeptidyl peptidase-4[J]. PloSone, 2017, 12 (7): e0180285. DOI:10.1371/journal.pone.0180285 |
| [4] | Zou HH, Yang PP, Huang TL, et al. PLK2 plays an essential role in high D-glucose-induced apoptosis, ROS generation and inflammation in Podocytes[J]. Sci Rep, 2017, 7 (1): 4261. DOI:10.1038/s41598-017-00686-8 |
| [5] | Hwang JH, Park SJ, Ko WG, et al. Cordycepin induces human lung cancer cell apoptosis by inhibiting nitric oxide mediated ERK/Slug signaling pathway[J]. Am J Cancer Res, 2017, 7 (3): 417–432. |
| [6] | Katsura T, Kawamori D, Aida E, et al. Glucotoxicity induces abnormal glucagon secretion through impaired insulin signaling in InR1G cells[J]. PloSone, 2107, 12 (4): e0176271. |
| [7] | Quinault A, Gausseres B, Bailbe D, et al. Disrupted dynamics of F-actin and insulin granule fusion in INS-1832/13 beta-cells exposed toglucotoxicity:partial restoration by glucagon-like peptide 1[J]. Biochim Biophys Acta, 2016, 1862 (8): 1401–1411. DOI:10.1016/j.bbadis.2016.04.007 |
| [8] | Moeinifard M, Hassan ZM, Fauabian F, et al. Britannin induces apoptosis through AKT-FOXO1 pathway in human pancreatic cancer cells[J]. Biomed Pharmacother, 2017, 94 : 1101–1110. DOI:10.1016/j.biopha.2017.08.025 |
| [9] | Xue M, Ji X, Xue C, et al. Caspase-dependent and caspase-independent induction of apoptosis in breast cancer by fucoidan via the PI3K/AKT/GSK3β pathway in vivo and in vitro[J]. Biomed Pharmacother, 2017 (94): 898–908. |
| [10] | Li Y, Liu J, Yang X, et al. Ginkgol C17:1 inhibits tumor growth by blunting the EGF-PI3K/Akt signaling pathway[J]. J Biomed Res, 2017, 31 (3): 232–239. |
| [11] | Lynda E, Norman B, Ernesto BM. Emerging role of protein kinase B/Akt signaling in pancreatic β-cell mass and function[J]. The International Journal of Biochemistry & Cell Biology, 2006, 38 (5-6): 689–695. |
| [12] | Chen L, Liu C, Gao J, et al. Inhibition of miro1 disturbs mitophagy and pancreatic β-cell function interfering insulin release via IRS-Akt-Foxo1 in diabetes[J]. Oncotarget, 2017, 8 (53): 90693–90705. |
| [13] | Purvis SD, Chiazza F, Chen J, et al. Annexin A1 attenuates microvascular complications through restoration of Akt signalling in a murine model of type 1 diabetes[J]. Diabetologia, 2018, 61 (2): 482–495. DOI:10.1007/s00125-017-4469-y |
| [14] | Buteau J, Spatz ML, Accili D. Transcription factor FoxO1 mediates glucagon-like peptide-1 effect sonpancreati cB-cell mass[J]. Diabetes, 2006, 55 (5): 1190–1196. DOI:10.2337/db05-0825 |
| [15] | Lyer S, Han L, Ambroqin E, et al. Deletion of FoxO1, 3, and 4 in osteoblast progenitors attenuates the loss of cancellous bone mass in a mouse model of type 1 diabetes[J]. J Bone Miner Res, 2017, 32 (1): 60–69. DOI:10.1002/jbmr.2934 |
| [16] | Lee HY, Youn SW, Cho HJ, et al. FOXO1 impairs whereas statin protects endothelial function in diabetes through reciprocal regulation of Kruppel-like factor 2[J]. Cardiovasc Res, 2013, 97 (1): 145–52. |
| [17] | Kluth O, Mirhashemi F, Scherneck S, et al. Dissociation of lipotoxicity and glucotoxicity in a mouse model of obesity associated diabetes:role of fork head box O1(FOXO1) in glucose-induced beta cell failure[J]. Diabetologia, 2011, 54 (3): 605–15. DOI:10.1007/s00125-010-1973-8 |
| [18] | Kim MK, Shin HM, Jung H, et al. Comparison of pancreatic beta cells and alpha cells under hyperglycemia:Inverse coupling in pAkt-FoxO1[J]. Diabetes Res Clin Pract, 2017, 131 : 1–11. DOI:10.1016/j.diabres.2017.05.017 |
| [19] | Yi L, Wei C, Fan W. Fine-particulate matter (PM2.5), a risk factor for rat gestational diabetes with altered blood glucose and pancreatic GLUT2 expression[J]. Gynecol Endocrinol, 2017, 33 (8): 611–616. DOI:10.1080/09513590.2017.1301923 |
| [20] | Mackenzie RW, Elliott BT. Akt/PKB activation and insulin signaling:anovel insulin signaling pathway in the treatment of type 2 diabetes[J]. Diabetes Mateb Syndr Obes, 2014, 2014 (default): 55–64. |
 2018, Vol. 35
2018, Vol. 35