文章信息
- 吴晓东, 张峰, 梁瑞峰
- WU Xiaodong, ZHANG Feng, LIANG Ruifeng
- 大黄素与丹参素合用对四氯化碳诱导大鼠肝纤维化的保护作用
- Effects of combination of emodin and tanshinol in hepatic fibrosis rats induced by carbon tetrachloride
- 天津中医药, 2018, 35(2): 143-146
- Tianjin Journal of Traditional Chinese Medicine, 2018, 35(2): 143-146
- http://dx.doi.org/10.11656/j.issn.1672-1519.2018.02.19
-
文章历史
- 收稿日期: 2018-01-10
2. 河南省中医药研究院, 郑州 450004
肝纤维化是各种病因所致慢性肝病的共同病理过程,也是向肝硬化发展的重要中间环节[1]。目前普遍认为,肝纤维化若能早期发现并予有效治疗,其病理过程是可被逆转的,而发展到肝硬化阶段则是不可逆的[2]。大黄、丹参在中医治疗器官纤维化领域中发挥着重要作用,大黄素是大黄的有效成分,具有抗炎抗氧化、保护肝肾等作用[3],丹参素是丹参的活性成分之一,具有抗组织缺血、扩张血管、抗纤维化等药理活性[4],然而未见有这两种作用机制不同的有效成分联合应用对大鼠肝纤维化影响的报道。本研究通过腹腔注射四氯化碳(CCl4)建立大鼠肝纤维模型,观察对大黄素和丹参素合用对肝纤维化大鼠的影响,为临床应用提供相关依据。
1 实验材料 1.1 动物SPF级雄性SD大鼠50只,体质量(200±20)g,由河南省实验动物中心提供,合格证号:SCXK(豫)2015-0004。
1.2 药品及试剂丹参素、大黄素(成都曼思特生物科技有限公司);Masson染色试剂盒,丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、羟脯胺酸(HYP)试剂盒(南京建成生物工程研究所);层粘连蛋白(LN)、透明质酸(HA)、Ⅲ型前胶原(PCⅢ)试剂盒(武汉华美生物工程有限公司)。
1.3 仪器Synergy NEO型全功能酶标仪(Bio-Tek公司);2K15型低温离心机(Sigma公司);CX31型显微镜(Olympus公司)。
2 方法 2.1 模型复制与分组SD大鼠按体质量随机分为正常组、模型组、大黄素组(40 mg/kg)、大黄素丹参素合用低剂量组(大黄素20 mg/kg+丹参素20 mg/kg)、高剂量(大黄素40 mg/kg+丹参素40 mg/kg)组,每组10只。除空白组腹腔注射橄榄油溶液外,其余各组大鼠均腹腔注射30%四氯化碳橄榄油[5]混悬液(2 mL/kg),每周2次,连续7周。从第3周开始,除注射造模外,各实验组分别灌胃相应的药物,正常组、模型组灌胃等体积双蒸水,每日1次,连续6周。末次给药后禁食不禁水24 h,大鼠麻醉后腹主动脉取血,离心分离血清,-20 ℃保存,取肝脏固定部位10%中性甲醛保存作组织病理学观察,另一部分-80 ℃保存。
2.2 肝脏组织病理学观察肝脏组织经中性甲醛固定,石蜡包埋,切片,常规苏木精-伊红(HE)染色,观察肝组织病理学形态。Masson染色后,观察肝组织中胶原纤维沉积情况。纤维化程度分级见参照文献[6]:无明显胶原纤维增生即表示为“-”;胶原纤维增多,从汇管区或中央静脉呈星状向外延伸,无纤维隔形成表示为“+”;胶原纤维明显增多并形成相互不连接的纤维隔表示为“++”;胶原纤维相互连接成完全的纤维隔,分割肝实质表示为“+++”。
2.3 肝功能检测离心分离血清,按照试剂盒说明书微板法检测大鼠血清中ALT、AST、ALP的活性,评价大鼠肝功能。
2.4 肝纤维化标志物检测酶联免疫吸附(ELISA)法检测大鼠血清中肝纤维化标志物LN、HA和PCⅢ的水平。精密称取冷冻保存的肝组织加生理盐水匀浆,酸水解法检测大鼠肝匀浆中HYP的含量。
2.5 统计学分析采用SPSS 18.0对结果进行统计分析,数据以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较用LSD法,P < 0.05为差异有统计学意义。
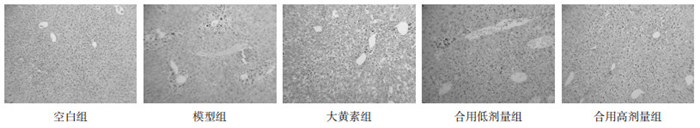
3 结果 3.1 大鼠肝组织病理变化HE染色显示,空白组大鼠肝索整齐、呈放射状排列,肝小叶结构完整,肝细胞无变性及坏死,未见淋巴细胞浸润;模型组大鼠肝索断裂,肝小叶结构紊乱,肝细胞可见明显坏死及大量淋巴细胞浸润,伴有胶原纤维增粗增厚;大黄素组可见部分肝小叶结构被破坏,肝细胞排列相对紊乱,少量淋巴细胞浸润,损伤程度明显减轻;合用组肝细胞排列相对整齐,肝细胞结构异常较少见,HE染色结果见图 1。Masson染色显示,空白组肝组织肝索排列整齐,呈条索状向四周放射状排列,小叶结构清晰,仅在汇管区可见少量胶原纤维;模型组肝细胞排列紊乱,汇管区和中央静脉之间胶原纤维明显增多,形成纤维纵隔,交结形成完全或不完全假小叶,同时可见细胞变性、坏死;大黄组肝小叶结构有所恢复,仍可见胶原纤维;合用组大鼠肝小叶结构破坏减轻,胶原纤维沉积减少,结果见图 2。
|
| 图 1 各组大鼠肝组织病理形态学(HE染色,×100) Fig. 1 Histopathological of liver observed in different groups (HE, ×100) |

|
| 图 2 各组大鼠肝组织病理形态学(Masson染色,×100) Fig. 2 Histopathological of liver observed in different groups (Masson, ×100) |
与空白组比较,模型组大鼠血清中ALT、AST和ALP活性显著升高(P < 0.01);与模型组比较,大黄素组、合用低剂量组、高剂量组大鼠血清中ALT、AST和ALP水平均显著降低(P < 0.05或P < 0.01);与大黄素组相比,合用高剂量组大鼠ALT、AST和ALP水平显著降低(P < 0.05)。结果见表 1。
| 组别 | 动物数 | ALT(U/L) | AST(U/L) | ALP(U/L) |
| 空白组 | 10 | 63.71±6.20 | 156.28±12.93 | 137.51±10.59 |
| 模型组 | 10 | 127.25±11.09* | 243.77±19.30* | 208.14±16.73* |
| 大黄素组 | 10 | 90.43±8.92## | 198.71±15.57# | 163.43±14.09## |
| 合用低剂量组 | 10 | 92.36±10.13# | 193.09±15.92## | 168.60±15.62## |
| 合用高剂量组 | 10 | 76.56±6.79##Δ | 175.82±14.81##Δ | 146.87±12.28##Δ |
| 注:与正常组比较, *P < 0.01;与模型组比较,#P < 0.05,##P < 0.01;与大黄素组比较,ΔP < 0.05,ΔΔP < 0.01。 | ||||
与对照组比较,模型组大鼠血清中LN、HA、PCⅢ和肝匀浆中HYP含量显著升高(P < 0.01);与模型组比较,大黄素组、合用低剂量组、高剂量组大鼠血清中LN、HA、PCⅢ和肝匀浆中HYP含量显著降低(P < 0.05或P < 0.01);与大黄素组相比,合用高剂量组大鼠LN、HA和HYP显著降低(P < 0.05或P < 0.01)。结果见表 2。
| 组别 | 动物数 | LN(μg/L) | HA(μg/L) | PCⅢ(μg/L) | HYP(μg/L) |
| 空白组 | 10 | 35.72±4.45 | 58.69±7.02 | 18.09±2.21 | 129.17±15.09 |
| 模型组 | 10 | 76.90± 10.92* | 133.18±15.87* | 35.04±4.41* | 406.95±38.53* |
| 大黄素组 | 10 | 56.26±5.81## | 92.63±10.23# | 24.32±3.05# | 233.49±24.81## |
| 合用低剂量组 | 10 | 59.09±7.76# | 87.10±11.45# | 25.67±3.76# | 217.30±25.36## |
| 合用高剂量组 | 10 | 44.57±4.80##Δ | 74.87±9.51##Δ | 21.35±2.39## | 155.49±18.45##ΔΔ |
| 注:与正常组比较,*P < 0.01;与模型组比较,#P < 0.05,##P < 0.01;与大黄素组比较,ΔP < 0.05,ΔΔP < 0.01 | |||||
肝纤维化是由慢性肝损伤引起的以细胞外基质过度沉积为特征的常见多发病,严重威胁着人类的健康。现代医学认为早期肝纤维化经过有效的治疗是可逆的,通过抗纤维化治疗可使肝纤维化进程明显减缓,程度明显减轻,若不能有效治疗,肝纤维化会最终发展为肝硬化甚至肝恶性肿瘤[7-9]。因此,进行有效的抗肝纤维化是阻止肝脏疾病加重的关键环节。
本实验采用腹腔注射CC14的经典方法制备大鼠肝纤维化模型,CC14可直接溶解肝细胞膜,并在肝细胞内质网中经肝细胞细胞色素P450酶代谢转化为活泼的三氯甲基自由基和氯甲基自由基,引起脂质过氧化反应,导致肝细胞损伤[10]。单剂量注射CC14可导致肝细胞脂肪变性、坏死,引起肝损伤,长期重复给药可导致肝纤维化、肝硬化甚至肝恶性肿瘤[11]。当肝细胞损伤时,胞质内的ALT、AST、ALP等外漏入血,因此血清中ALT、AST、ALP水平可反映肝脏受损伤的程度[12]。本研究发现,大黄素组、合用中、高剂量组大鼠血清ALT、AST和ALP水平显著下降,合用高剂量组较大黄素组血清ALT、AST和ALP水平更低,表明大黄素可明显改善大鼠肝功能,大黄素与丹参素合用可进一步增加改善肝功能的效应。
肝纤维化患者的细胞外基质大量生成并沉积于肝脏,大量研究表明,血清中HA、LN、PCⅢ的含量与肝纤维化程度高度有关,是反映肝纤维化的灵敏指标[13-17]。HA由激活的肝星状细胞合成,在肝纤维化早期其他指标尚未异常时就会升高,可反映肝纤维化的形成和纤维化程度。LN是基底膜主要多糖之一,由肝细胞和血窦内皮细胞合成,当肝纤维化发生时,LN明显沉积并释放入血,使血清中LN含量升高血清LN水平可反映肝纤维化的进展与严重程度。PCⅢ被N-末端酶裂解后进入血液中,随着肝纤维合成的活跃而增多。肝脏中HYP的含量直接反映肝脏纤维化的程度[18-20]。本研究发现,药物干预后,大鼠血清中LN、HA、PCⅢ含量下降,肝匀浆中HYP含量明显减少,合用高剂量组较大黄素组各项指标进一步改善,表明大黄素能够抗肝纤维化,丹参素可增强大黄素抗肝纤维化的作用。
大黄素是泻下类中药大黄的有效成分之一,具有抗炎抗氧化、保护肝肾、抗肿瘤等多种生物活性;丹参素是活血化瘀类中药丹参的活性成分之一,具有抗缺血、扩张血管、抗动脉粥样硬化、抗组织纤维化等药理作用。本实验考察了这两种作用机制不同的有效成分联合应用对大鼠肝纤维化的影响,结果显示两者具有协同作用,其机制有待深入研究。
| [1] | 朱亚平, 卜淑蕊. 肝纤维化发病机制研究新进展[J]. 肝脏, 2016, 21 (5): 401–403. |
| [2] | Bracht T, Schweinsberg V, Trippler M, et al. Analysis of disease-associated protein expression using quantitative proteomics-fibulin-5 is expressed in association with hepatic fibrosis[J]. J Proteome Res, 2015, 14 (5): 2278–2286. DOI:10.1021/acs.jproteome.5b00053 |
| [3] | 祝婷婷, 刘晓, 汪小莉, 等. 大黄不同方法炮制后药理作用及化学成分变化研究进展[J]. 中国新药杂志, 2016, 25 (8): 883–887. |
| [4] | 张建永, 王岚, 梁日欣, 等. 基于网络药理学分析丹参山楂组分配伍抗动脉粥样硬化的作用机制研究[J]. 中国中药杂志, 2016, 41 (23): 4408–4415. |
| [5] | 张晓珣, 王俊, 赵宇, 等. 牛蒡子苷元对四氯化碳致大鼠肝纤维化的治疗作用[J]. 中国药理学与毒理学杂志, 2016, 30 (1): 53–60. |
| [6] | 景晶, 赵金英, 华冰, 等. 甘草总黄酮抑制硫代乙酰胺诱导肝纤维化大鼠肝组织中TGF-β1及Caspase-3的表达[J]. 中国中药杂志, 2015, 40 (15): 3034–3040. |
| [7] | 王静滨, 张杨, 李贺薇, 等. 柔肝丸治疗乙型肝炎肝纤维化临床研究[J]. 中医药信息, 2013, 30 (3): 64–66. |
| [8] | 王静, 王绪霖. 软肝煎对高脂饮食肝纤维化大鼠HA、LV、PCⅢ、CⅢ及病理的影响[J]. 天津中医药, 2017, 34 (2): 128–131. |
| [9] | 李欣, 朱英. 肝纤维化发生相关信号传导通路研究进展[J]. 实用肝脏病杂志, 2015, 18 (1): 101–104. |
| [10] | Doustimotlagh AH, Dehpour AR, Nourbakhsh M, et al. Alteration in membrane protein, antioxidant status and hexokinase activity in erythrocytes of CCl4-induced cirrhotic rats[J]. Acta Med Iran, 2014, 52 (11): 795–803. |
| [11] | 闫冰川, 丁常清, 江伟炽, 等. 长期腹腔注射四氯化碳诱导小鼠肝纤维化模型的建立[J]. 中华实验外科杂志, 2015, 32 (6): 1464–1465. |
| [12] | 董红筠, 王敬, 李萍, 等. 软肝化纤丸抗慢性乙型肝炎肝纤维化60例临床观察[J]. 天津中医药, 2013, 30 (5): 266–268. DOI:10.11656/j.issn.1672-1519.2013.05.04 |
| [13] | 张玲荣, 郝彦琴, 任姣龙, 等. 慢性乙肝患者肝纤维化与肝硬度、超声量化指标、血清肝纤维化指标的相关性[J]. 山西医科大学学报, 2015, 46 (1): 45–48. |
| [14] | 李静, 杨雅娟, 冯艳, 等. 牛磺酸对实验性肝纤维化大鼠保护作用的研究[J]. 天津中医药, 2017, 34 (5): 336–340. DOI:10.11656/j.issn.1672-1519.2017.05.15 |
| [15] | 任建琳, 王健, 胡晔, 等. 柴胡皂苷d对免疫性肝纤维化大鼠TGF-β1、HYP、SOD、MDA的影响[J]. 现代预防医学, 2012, 39 (12): 3044–3047. |
| [16] | 孟明辉. JAK/STAT信号转导通路在肝纤维化发病机制中作用的实验研究[D]. 石家庄: 河北医科大学, 2011. |
| [17] | 郑艳丽. IGF-1在大鼠肝纤维化过程中的动态变化及扶正化瘀方对肝纤维化的影响[D]. 石家庄: 河北医科大学, 2011. |
| [18] | 曲蕃升, 程玉, 彭金咏. 胶原代谢在肝纤维化中的作用及中药调控胶原代谢研究进展[J]. 中国药师, 2017, 20 (4): 728–731. |
| [19] | 王晓萍, 周语平. 复肝宁对免疫性肝纤维化大鼠HYP SOD MDA的影响[J]. 中华中医药学刊, 2008, 27 (11): 2492–2494. |
| [20] | 毕红征, 赵君玫, 黄国钧. HG颗粒对CCl_4复合因素所致肝纤维化大鼠血清HYP及TGFβ-1含量的影响[J]. 河南中医学院学报, 2007, 23 (2): 29–31. |
2. Henan Provincial Academy of Traditional Chinese Medicine, Zhengzhou 450004, China
 2018, Vol. 35
2018, Vol. 35