文章信息
- 白云, 朱瑞超, 李晋, 马琳, 何俊, 常艳旭
- BAI Yun, ZHU Ruichao, LI Jin, MA Lin, HE Jun, CHANG Yanxu
- 超高效液相色谱法同时测定金花葵花中5个黄酮类成分含量
- Simultaneous determination of five flavonoids in the flowers of Aurea helianthus by ultra performance liquid chromatography method
- 天津中医药, 2018, 35(2): 147-150
- Tianjin Journal of Traditional Chinese Medicine, 2018, 35(2): 147-150
- http://dx.doi.org/10.11656/j.issn.1672-1519.2018.02.20
-
文章历史
- 收稿日期: 2017-12-08
金花葵为锦葵科秋葵属一年生草本植物,别名菜芙蓉或野芙蓉[1]。野生金花葵是生长在深山悬崖间的濒危花卉,主要分布在河北地区[2]。金花葵含有黄酮类化合物、不饱和脂肪酸、维生素E及锌、硒、铁人体必需微量元素等,其中黄酮类化合物是其主要的活性成分并且含量超出目前黄酮生产常用原料银杏、大豆等数十倍[3-5]。张路等[6]利用索式提取法分离提取并用紫外分光光度法测得金花葵根茎中总黄酮含量为2.72%。宋琳琳等[7]利用超声波提取并用比色法测得金花葵花中总黄酮含量为8.47%。金花葵具有解热、镇痛、抗氧化、调节免疫力、降血脂等功效;花蕾泡水饮用可扩张血管;根、茎、叶粉碎后过筛制成的面粉具有很高的营养价值;嫩果富含植物雄激素,具有滋阴壮阳等功效[8-10]。它被认为在200多种秋葵植物中最具药用、食用、保健价值。
目前,除明朝《顺德府志》中记载顺德府有特产植物金花葵外,在各版《中华人民共和国药典》及卫生部药品部颁标准中未见收载。其化学成分测定指标比较单一,除金丝桃苷外其他黄酮类成分的质量分析未见报道,含量测定的方法主要是传统高效液相色谱法[11-12]。本研究采用超高效液相色谱法(UPLC色谱法),同时测定金花葵花中芦丁、金丝桃苷、异槲皮苷、杨梅素和槲皮素的含量,比较不同产地及不同花期样品含量差异,以评价金花葵花的质量,为今后的开发利用提供科学依据。
1 仪器与材料 1.1 仪器Waters ACQUITY超高效液相色谱仪(美国Waters公司);AX205十万分之一电子天平(瑞士Mettler Toledo公司);BP121S万分之一天平(德国Sartorius公司);SB-1000YDTD超声清洗器(宁波新芝生物科技股份有限公司);FW135型粉碎机(天津市泰斯特仪器有限公司);3K15型高速离心机(美国Sigma公司);XW-80A型涡旋混合器(上海沪西分析仪器厂)。
1.2 实验材料金花葵花购买自不同产地,经天津中医药大学马琳教授鉴定为锦葵科秋葵属植物金花葵(Hibiscus manihot L.)的干燥花, 保存于天津中医药大学中医药研究院。金花葵花经粉碎机粉碎后过60目筛网,备用。标准品包括芦丁、金丝桃苷、异槲皮苷、杨梅素和槲皮素纯度均大于98%,购自成都德斯特生物科技有限公司。乙腈(Merck公司),甲醇(Merck公司),甲酸(美国ACS恩科化学)均为色谱纯。超纯水由Mill-QⅡ型超纯水机制备(Millipore公司)。
2 方法与结果 2.1 色谱条件色谱柱:ACQUITY UPLC BEH C18(1.7 μm, 2.1 mm×100 mm);保护柱:Waters C18柱(2.1 mm×12.5 mm, 5 μm);流动相A:乙腈,B:超纯水(含0.1%甲酸);流速:0.3mL/min;柱温:35 ℃;进样体积:2 μL;检测波长:360 nm。梯度洗脱程序如下:0~1 min:12%~15%A, 1~5 min:15%~16%A, 5~7 min:16%~30%A, 7~9 min:30%~70%A, 9~10 min:70%~95%A, 10~11 min:95%~12%A。
2.2 标准品溶液的制备分别精密称取芦丁、金丝桃苷、异槲皮苷、杨梅素、槲皮素标准品适量,用85%甲醇溶解配制使其浓度均为1 mg/mL的标准品贮备液,分别吸取各储备溶液适量配制成含芦丁50 μg/mL,金丝桃苷300 μg/mL,异槲皮苷200 μg/mL,杨梅素50 μg/mL,槲皮素25 μg/mL的混合标准品溶液,再用甲醇依次稀释到合适的浓度,置于4℃冰箱内备用。
2.3 供试品溶液的制备精密称取金葵花粉末1 g,置于锥形瓶中,加入30 mL 85%甲醇溶液,称质量,超声波提取25 min,补足质量,所得溶液14 000 r/min离心10 min,取上清液,作为供试品溶液(n=3),取上清液稀释5倍后进样分析。
2.4 方法学考察 2.4.1 标准曲线及线性范围本实验采用外标法同时测定金花葵花中5个化合物的含量。将混合标准品储备液用85%甲醇稀释成8个不同浓度的混合标准品溶液,并按上述色谱条件依次进样2 μl,以浓度(μg/mL)为横坐标(X),峰面积为纵坐标(Ŷ)制作标准曲线。以信噪比S/N为3:1作为其检测限(LOD),S/N为10:1作为其定量限(LOQ)。5个化合物的标准曲线、LOD与LOQ结果见表 2,从表中可以得知,该5个化合物在各自线性范围内相关系数r2≥0.999,表明5个化合物在其线性范围内呈现良好的线性关系。
| 化学成分 | 回归方程 | 线性范围(μg/mL) | r2 | LOD(μg/mL) | LOQ(μg/mL) |
| 芦丁 | Ŷ=8 901X+1 225 | 0.2~ 50 | 0.999 6 | 0.1 | 0.2 |
| 金丝桃苷 | Ŷ=12 802X+9 318 | 2.4~300 | 0.999 5 | 1.2 | 2.4 |
| 异槲皮苷 | Ŷ=14 201X+9 872 | 0.8~200 | 0.999 0 | 0.4 | 0.8 |
| 杨梅素 | Ŷ=16 059X-1 092 | 0.2~ 50 | 0.999 3 | 0.1 | 0.2 |
| 槲皮素 | Ŷ=22 933X+1 142 | 0.08~ 25 | 0.999 8 | 0.04 | 0.08 |
配制低、中、高3个浓度的混合标准品溶液,分别在同1 d内连续进样6次作为日内精密度的考察,连续3 d分别进样6次作为日间精密度的考察。计算此5个化合物峰面积的相对标准偏差(RSD)值。并且根据标准曲线计算5个化合物的浓度值,将测得的浓度值与实际浓度值进行比较,得到各化合物的准确度。日内与日间精密度试验结果见表 2,各化学成分的峰面积RSD均小于5%表明该仪器精密度良好。
| 化学成分 | 浓度(μg/mL) | 日内精密度 | 日间精密度 | |||
| RSD(%) | 准确度(%) | RSD(%) | 准确度(%) | |||
| 0.4 | 0.26 | 105 | 4.19 | 103 | ||
| 芦丁 | 2.0 | 1.23 | 107 | 2.23 | 106 | |
| 20.0 | 2.40 | 103 | 2.26 | 104 | ||
| 4.8 | 0.40 | 104 | 4.22 | 106 | ||
| 金丝桃苷 | 24.0 | 0.39 | 94 | 2.67 | 97 | |
| 240.0 | 0.92 | 105 | 3.16 | 98 | ||
| 3.2 | 0.36 | 91 | 4.44 | 95 | ||
| 异槲皮苷 | 16.0 | 0.54 | 91 | 3.04 | 94 | |
| 160.0 | 0.31 | 92 | 3.23 | 96 | ||
| 0.4 | 0.80 | 105 | 3.47 | 103 | ||
| 杨梅素 | 2.0 | 3.17 | 96 | 3.34 | 95 | |
| 20.0 | 1.61 | 105 | 2.33 | 103 | ||
| 0.4 | 0.98 | 103 | 4.36 | 103 | ||
| 槲皮素 | 2.0 | 3.24 | 101 | 4.03 | 104 | |
| 20.0 | 0.38 | 105 | 2.55 | 98 | ||
取同一批次的金花葵花粉末,按照上述样品溶液制备方法平行提取6份,连续进样分析,测得芦丁、金丝桃苷、异槲皮苷、杨梅素和槲皮素5种化合物峰面积的RSD值分别为2.38%、2.80%、2.80%、4.11%、3.23%,结果表明本方法重现性良好。
2.4.4 稳定性实验将供试品溶液按照上述色谱条件分别在0、2、4、6、8、12、24 h内进样测定,测得芦丁、金丝桃苷、异槲皮苷、杨梅素和槲皮素5种化合物峰面积的RSD值分别为0.61%、2.23%、2.35%、2.10%、0.96%,表明供试品溶液在24 h内稳定性良好。
2.4.5 加样回收率精密称取同一批次已知含量的金花葵花粉末,并分别精密加入金花葵中各成分含量的100%,此操作平行6份,按照“样品溶液的制备”项下方法处理并按照上述色谱条件测定,通过公式(测得量-原有量)/加标量×100%,计算各化学成分的平均回收率,结果见表 3。
| 化学成分 | 原有量(mg) | 加入量(mg) | 测得量(mg) | 平均回收率(%) | RSD(%) |
| 芦丁 | 0.029 0 | 0.045 1 | 0.072 7 | 97.0 | 3.00 |
| 金丝桃苷 | 0.173 0 | 0.205 0 | 0.388 2 | 105.0 | 0.82 |
| 异槲皮苷 | 0.088 3 | 0.099 0 | 0.186 1 | 99.0 | 2.71 |
| 杨梅素 | 0.014 0 | 0.012 0 | 0.021 8 | 95.0 | 4.38 |
| 槲皮素 | 0.004 8 | 0.004 8 | 0.009 4 | 95.0 | 2.32 |
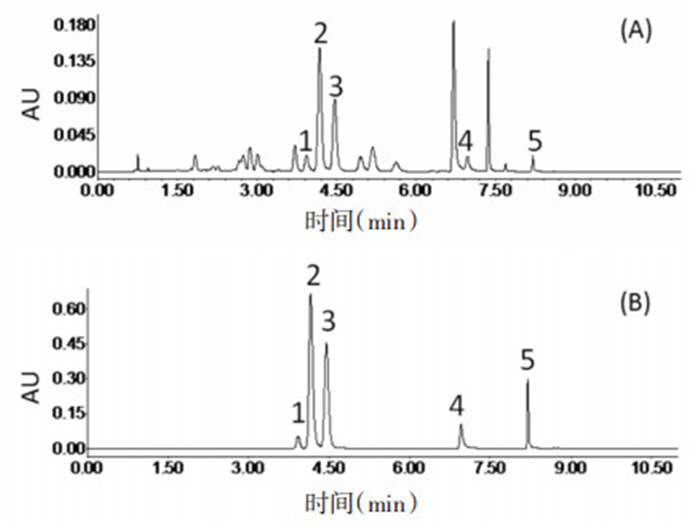
精密称取金花葵花粉末适量,按照制备供试品溶液的方法制备,样品稀释5倍后按照上述的色谱条件进样分析,5种分析物的分离度良好,图 1为样品溶液(A)与混合标准品溶液(B)的高效液相色谱图。根据上述“标准曲线及线性范围”所得的回归方程计算不同批次供试品溶液中5种化学成分的含量,见表 4。从表 4可知取自河南南阳同一产地不同采收期的样品,金花葵末期花中5种成分(芦丁、金丝桃苷、异槲皮苷、杨梅素和槲皮素)的含量明显高于初期花中5种成分的含量;不同产地相同采收期的样品中5种含量差异较大;发现金丝桃苷和异槲皮苷是金花葵中主要黄酮成分,其中金丝桃苷在3.56 ~10.07 mg/g范围之间,异槲皮苷在2.29 ~5.22 mg/g范围之间,其他3种成分含量均低于2.5 mg/g。
|
| 图 1 金花葵样品(A)和混合对照品(B)的色谱图 Fig. 1 Typical chromatogram,(A) Sample,(B) Mixed reference substances 1.芦丁;2.金丝桃苷;3.异槲皮苷;4.杨梅素;5.槲皮素 |
| mg/g | |||||
| 化合物(批次) | 芦丁 | 金丝桃苷 | 异槲皮苷 | 杨梅素 | 槲皮素 |
| 河南南阳(末期花) | 1.65 | 10.07 | 5.22 | 0.71 | 0.29 |
| 河南南阳(初期花) | 0.75 | 4.89 | 2.99 | 0.39 | 0.75 |
| 福建松溪 | 0.90 | 6.96 | 3.96 | 1.16 | 0.83 |
| 杭州萧山 | 1.51 | 6.68 | 5.71 | 0.24 | 1.19 |
| 山东枣庄 | 1.25 | 7.39 | 4.22 | 0.84 | 0.93 |
| 安徽亳州 | 0.74 | 4.83 | 2.29 | 0.06 | 0.30 |
| 河南新乡 | 1.12 | 7.67 | 3.63 | 0.15 | 0.21 |
| 河北邯郸 | 1.41 | 9.27 | 4.72 | 0.25 | 0.52 |
| 安徽安庆 | 2.00 | 3.56 | 4.09 | 1.13 | 2.12 |
本实验采用超声波提取法提取金花葵花中黄酮类成分,甲醇溶液作为提取溶剂。选择料液比、提取时间、甲醇浓度3个因素作为对黄酮类化合物提取有影响的参数,进行单因素实验。在其他两因素不变的前提下,分别考察了不同料液比(g/mL)A(1:15,1:25,1:35,1:45,1:55)、不同提取时间C(20、30、40、50、60 min)以及不同甲醇浓度A(50%,60%,70%,80%,90%)这3个因素对5个化合物提取总量的影响。根据单因素实验的结果:当料液比为1:25时,5种化合物的提取总量最高;当提取时间为30 min时,5种化合物的提取总量最高;当甲醇浓度为80%时,5种化合物的提取总量最高。在此水平左右选取两个水平即每个因素各选取3个水平,应用正交设计软件Ⅱ v3.1,L9(34)正交表设计正交实验,结果见表 5。根据极差分析,甲醇浓度对金花葵花黄酮类化合物提取影响最大。分别选择平均数大的水平A3、B1、C3组合成最优水平组合,即精密称取1 g金花葵花粉末于具塞锥形瓶内,加入30 mL 85%甲醇,超声25 min,对金花葵花进行提取,可作为供试品的最佳提取条件。
| 项目 | A(g/mL) | B(min) | C(%) | D(空列) | 含量(mg/g)异槲皮苷 | 总含量(mg) | ||||
| 芦丁 | 金丝桃苷 | 异槲皮苷 | 杨梅素 | 槲皮素 | ||||||
| 实验1 | 1:20 | 25 | 75 | - | 1.170 5 | 12.547 5 | 5.643 1 | 0.787 2 | 0.294 9 | 20.443 3 |
| 实验2 | 1:20 | 30 | 80 | - | 1.159 3 | 12.317 2 | 5.516 5 | 0.809 7 | 0.291 6 | 20.094 4 |
| 实验3 | 1:20 | 35 | 85 | - | 1.141 7 | 12.271 5 | 5.526 9 | 0.810 4 | 0.283 0 | 20.033 4 |
| 实验4 | 1:25 | 25 | 80 | - | 1.161 5 | 12.323 7 | 5.459 9 | 0.765 4 | 0.276 7 | 19.978 2 |
| 实验5 | 1:25 | 30 | 85 | - | 1.156 5 | 12.472 7 | 5.570 0 | 0.778 1 | 0.284 9 | 20.262 3 |
| 实验6 | 1:25 | 35 | 75 | - | 1.135 0 | 12.877 0 | 5.665 7 | 0.772 4 | 0.299 5 | 20.749 7 |
| 实验7 | 1:30 | 25 | 85 | - | 1.203 7 | 13.326 7 | 6.033 8 | 0.870 1 | 0.298 0 | 21.732 3 |
| 实验8 | 1:30 | 30 | 75 | - | 1.115 8 | 12.665 9 | 5.691 8 | 0.762 3 | 0.302 8 | 20.538 7 |
| 实验9 | 1:30 | 35 | 80 | - | 1.076 2 | 12.250 5 | 5.500 2 | 0.773 8 | 0.269 2 | 19.869 9 |
| 均值1 | 20.190 | 20.718 | 20.577 | - | ||||||
| 均值2 | 20.330 | 29.298 | 19.981 | - | ||||||
| 均值3 | 20.714 | 20.218 | 20.676 | - | ||||||
| 极差 | 0.524 | 0.500 | 0.695 | - | ||||||
为使5种待测化合物达到最佳的分离效果,本实验对流动相组成,柱温,流速等条件进行了考察和优化。本文采用乙腈-水梯度洗脱,考察了在水相中加入不同浓度甲酸(0.05、0.1、0.2%)、柱温(30、35、40 ℃)以及流速(0.2、0.3、0.4 mL/min)。结果表明,流动相为乙腈-0.1%甲酸水、柱温30 ℃和流速0.3 mL/min时对金花葵花样品进行梯度洗脱,各化合物基线分离较好、灵敏度高、峰型较好。
4 结论本研究建立测定金花葵花中的5种成分芦丁、金丝桃苷、异槲皮苷、杨梅素、槲皮素的含量的UPLC分析方法。方法学验证结果表明该方法稳定可靠、灵敏度高且分析时间短,在10 min内实现了金花葵花5种待测化合物基线分离,适用于金花葵花的定量研究。从含量测定结果可知:不同采收期间,金花葵含量存在差异,其中含量较高的金丝桃苷、异槲皮苷在末期花中的含量约为初期花中的两倍,可能与金花葵花中的水分含量有关;不同产地间的含量差异可能是由于温度,湿度等地理气候不同。此次测定结果可为今后金花葵花的利用提供数据支撑。
| [1] | 卢丹, 贾瑞波. 中药金花葵的研究进展[J]. 中国药物评价, 2015, 5 (2): 90–92. |
| [2] | 曹利华, 苗明三. 金花葵的现代研究与综合利用分析[J]. 中医学报, 2016, 31 (12): 1966–1968. |
| [3] | 兰蓉, 李浡, 刘卉, 等. 金花葵总黄酮的提取和含量测定[J]. 江苏农业科学, 2012, 40 (12): 280–282. DOI:10.3969/j.issn.1002-1302.2012.12.112 |
| [4] | 危晴, 兰蓉, 辛秀兰, 等. 紫外分光光度法测定金花葵籽中总黄酮的含量[J]. 安徽农业科学, 2012, 52 (12): 7050–7050. DOI:10.3969/j.issn.0517-6611.2012.12.023 |
| [5] | 李浡, 胡定煜, 辛秀兰, 等. 原子光谱法测定金花葵花瓣及种子中微量元素[J]. 食品研究与开发, 2012, 33 (4): 152–155. |
| [6] | 张路, 于慧敏, 杜凤沛, 等. 金花葵中总黄酮的分离提取及含量测定[J]. 吉林师范大学学报(自然科学版), 2015, 37 (4): 104–108. |
| [7] | 宋琳琳, 黄蓓蓓, 张朝晖. 金花葵花中总黄酮的超声波提取工艺[J]. 贵州农业科学, 2016, 44 (2): 70–72. |
| [8] | 张建. 金花葵花总黄酮解热抗炎作用的实验研究[J]. 中国医科大学学报, 2011, 40 (8): 763–764. |
| [9] | 杨秀松. 金花葵粗黄酮提取物的免疫调节作用研究[J]. 中国药师, 2013, 16 (9): 1307–1311. |
| [10] | 李芸, 杨秀松, 何计国. 金花葵黄酮对高脂血症大鼠血脂的影响[J]. 食品科学, 2012, 33 (1): 248–251. |
| [11] | 邱金玲, 刘朋, 熊维政, 等. 金花葵中金丝桃苷的含量测定[J]. 中医学报, 2015, 30 (12): 1793–1795. |
| [12] | 易剑峰. HPLC法测定金花葵花中金丝桃苷的含量[J]. 宜春学院学报, 2007, 29 (4): 72–72. |
 2018, Vol. 35
2018, Vol. 35