文章信息
- 乔建军
- QIAO Jianjun
- 芪术两活汤治疗痛风性关节炎大鼠实验研究
- Experimental study of rat models with gouty arthritis treated by Qizhu Lianghuo decoction
- 天津中医药, 2018, 35(3): 217-220
- Tianjin Journal of Traditional Chinese Medicine, 2018, 35(3): 217-220
- http://dx.doi.org/10.11656/j.issn.1672-1519.2018.03.17
-
文章历史
- 收稿日期: 2017-11-07
芪术两活汤(QZLHD)系清代陈士铎《辨证录》卷三遍身骨痛门首载,主要用于治疗痛风之证,“然痛风之症,多感于风湿,而风湿之感,多入于骨髓”,“以骨髓属肾,肾可补而不可泻”,“泻胃与大肠之风湿,而肾之风湿自去”。该方对痛风的治疗辨证明确,但其现代医学理论依据尚未得以确定。关节的红肿、热痛是痛风性关节炎最常见临床表现,故抗炎镇痛作用是评价药物治疗痛风性关节炎疗效的重要指标。前期实验表明QZLHD水提液对痛风性关节炎大鼠具有抗炎作用,本实验观察QZLHD水提液乙酸乙酯部位及乙醇部位在痛风性关节炎大鼠模型上的药效,以探讨QZLHD对痛风性关节炎的治疗效果及有效成分群,以期为临床应用此方提供实验依据。
1 材料 1.1 实验动物清洁级雄性Sprague-Dawley大鼠,8~10周龄,体质量(290±10)g(购自北京华阜康生物科技股份有限公司,许可证号:SCXK(京)2014-0004,置于本实验室饲养房内饲养1周后用于实验。室温(20±2)℃,湿度50%±5%。每日清洁一次底垫,期间自由进食普通鼠饲料,饮用自来水。
1.2 药品与试剂人参(批号:201512),肉桂(批号:201508),白术(批号:201512),黄芪(批号:201506),茯苓(批号:201501),甘草(批号:201512),羌活(批号:201508),独活(批号:201511)均购于国药乐仁堂医药有限公司张家口市分公司,阿司匹林片(批号:20151222,重庆迪康长江制药有限公司),尿酸钠(美国sigma公司,批号:U2875-5G);白介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)酶联免疫吸附反应(ELISA)试剂盒(武汉默沙克生物科技有限公司);尿酸试剂盒(北京柏定生物工程有限公司,批号:000020161);苏木素伊红(HE)染色试剂盒(北京索莱宝生物有限公司,批号:20150622)。
1.3 仪器1510型全波长酶标仪(美国赛默飞世尔科技公司),万分之一Sartorius精密电子天平(德国赛多利斯天平公司),TL4型偏振光高倍显微镜(日本OLYMPUS公司),KDC-2044型低速冷冻离心机(科大创新股份有限公司),BL-2000医学图像分析系统(成都泰盟软件有限公司)。
2 方法 2.1 QZLHD的提取及供试液的制备将药材于60℃干燥2 h后,按照QZLHD处方的比例(人参:肉桂:白术:黄芪:茯苓:甘草:羌活:独活=9:9:30:30:15:3:1.5:1.5),称取QZLHD药材20 kg,加5倍量的蒸馏水回流提取40 min,过滤后,滤渣加3倍量的蒸馏水,继续回流提取30 min,过滤后,合并两次滤液,浓缩为膏状,质量为3.2 kg。依次用乙酸乙酯、75%乙醇提取,每次1 000 mL,各提取3次,浓缩后,得乙酸乙酯部位50 g、乙醇部位500 g。分别加水适量制成混悬液,溶解时加入适量Tween 80助溶,制备各药用部位浓度分别为:2.5和25 mg/mL的供试液,浓度均约相当于1 g药材/mL[1]。
2.2 实验分组及给药取清洁级雄性SD大鼠90只,随机分为9组,每组10只,即正常组、模型组、阿司匹林组(270 mg/kg)、QZLHD水提液乙酸乙酯部位低、中、高剂量组(15、25、50 mg/kg)及QZLHD水提液乙醇部位低、中、高剂量组(150、250、500 mg/kg)。造模5 h后灌胃给药,连续给药7 d,模型组和正常组给予等体积生理盐水。
2.3 大鼠痛风性关节炎模型的制备参照文献[3]方法制备大鼠痛风性关节炎模型。大鼠腹腔注射0.3%戊巴比妥钠10 mL/kg麻醉,左侧后足踝关节背侧常规消毒后,将注射针与胫骨成45°方向刺入踝关节腔,注入均匀混合的浓度为30 g/L尿酸钠混悬液0.1 mL,正常组踝关节腔中注射0.1 mL生理盐水。
2.4 指标测定 2.4.1 关节肿胀度测定于造模后5 h、24 h、3 d、5 d、7 d,采用缚线法测定大鼠右后踝关节同一部位的周径,按以下公式计算肿胀度[3]。
肿胀度=(致炎后踝关节周径-致炎前踝关节周径)/致炎前踝关节周径
2.4.2 大鼠血清中尿酸(UA)的含量测定末次给药3 h后将大鼠用0.3%戊巴比妥钠10 mL/kg腹腔注射麻醉后腹主动脉取血,室温放置2 h,3 500 r/min离心10 min,留取血清,按尿酸试剂盒说明书测定血清中尿酸含量。
2.4.3 大鼠血清IL-1β、TNF-α含量的检测取2.4.2项下制备的血清,按照ELISA试剂盒说明书操作检测并计算IL-1β、TNF-α浓度[4-5]。
2.4.4 大鼠关节组织病理形态学观察及单位面积炎症细胞计数大鼠取血后,取关节组织,10%甲醛固定30 h,8%硝酸溶液中脱钙48 h,梯度乙醇脱水,二甲苯透明,石蜡包埋后,常规切片,厚度3 μm,HE染色。于400倍光镜下观察关节软组织病理形态学改变[6-7];选取炎症细胞最密集区域,观察关节软组织及关节腔内炎症细胞聚集情况,计数单个镜下视野内淋巴细胞数。
2.5 统计方法采用SPSS 19.0软件进行统计学处理,实验数据用平均数±标准差(x±s)表示,组间比较采用单因素方差分析,两两比较若方差齐采用LSD检验,若方差不齐采用Dunnett’s T3检验,P < 0.05时认为差异有统计学意义。
3 结果 3.1 关节肿胀度测定与正常组大鼠比较,造模后5 h、24 h、3 d、5 d、7 d模型组大鼠的关节肿胀均显著增加(P<0.01),24 h肿胀最为明显,出现明显的造模关节局部皮肤发红、皮温升高、运动障碍等致炎症状,关节肿胀度在达高峰后下降。与模型组比较,各治疗组在5 h时,关节肿胀均无显著差异。24 h后,阿司匹林组各时间点关节肿胀均显著减轻(P<0.01);QZLHD水提液乙醇部位组均能显著降低肿胀度(P<0.01),且具有剂量依赖性;其余各组与模型组比较差异均无显著性(P>0.05)。见表 1。
| cm | |||||||
| 分组 | 动物数 | 给药剂量(mg/kg) | 关节肿胀度 | ||||
| 5h | 24h | 3d | 5d | 7d | |||
| 正常组 | 10 | - | 0.063±0.007 | 0.042±0.006 | 0.020±0.007 | 0.007±0.007 | 0.005±0.005 |
| 模型组 | 10 | - | 0.553±0.033# | 0.719±0.022* | 0.699±0.018* | 0.396±0.025* | 0.212±0.007* |
| 阿司匹林组 | 10 | 270 | 0.554±0.024 | 0.257±0.031# | 0.168±0.016# | 0.176±0.025# | 0.102±0.006# |
| 乙醇高剂量组 | 10 | 500 | 0.555±0.022 | 0.378±0.024# | 0.278±0.014# | 0.219±0.025# | 0.103±0.016# |
| 乙醇中剂量组 | 10 | 250 | 0.555±0.005 | 0.388±0.013# | 0.326±0.008# | 0.275±0.022# | 0.108±0.008# |
| 乙醇低剂量组 | 10 | 150 | 0.556±0.034 | 0.402±0.032# | 0.375±0.025# | 0.311±0.024# | 0.114±0.016# |
| 乙酸乙酯高剂量组 | 10 | 50 | 0.561±0.054 | 0.725±0.022 | 0.694±0.015 | 0.399±0.026 | 0.215±0.012 |
| 乙酸乙酯中剂量组 | 10 | 25 | 0.545±0.062 | 0.711±0.021 | 0.696±0.013 | 0.401±0.025 | 0.208±0.010 |
| 乙酸乙酯低剂量组 | 10 | 15 | 0.552±0.016 | 0.725±0.006 | 0.696±0.014 | 0.414±0.025 | 0.221±0.015 |
| 注:与正常组比较,*P < 0.01;与模型组比较,#P < 0.01。 | |||||||
与正常组比较,模型组UA水平显著增高(P<0.01)。与模型组比较,阿司匹林组和QZLHD水提液乙醇部位低、中、高剂量组能显著降低血清中UA水平(P<0.01),乙酸乙酯部位组与模型组比较差异均无显著性(P>0.05)。见表 2。
| 分组 | 动物数 | 给药剂量(mg/kg) | 尿酸水平(mg/L) | 淋巴细胞(个/400倍镜) | IL-1β(pg/mL) | TNF-α(pg/mL) |
| 正常组 | 10 | - | 36.005±1.387 | 0.79±0.94 | 262.1±102.6 | 232.5±72.6 |
| 模型组 | 10 | - | 64.113±1.107** | 52.11±23.78** | 431.4±101.5* | 323.5±67.7* |
| 阿司匹林组 | 10 | 270 | 39.614±1.125## | 10.79±4.49## | 279.4±98.3# | 243.7±68.6# |
| 乙醇高剂量组 | 10 | 500 | 40.614±1.105## | 11.19±3.25## | 291.5±71.3# | 245.1±70.3# |
| 乙醇中剂量组 | 10 | 250 | 47.662±1.134## | 15.74±4.66## | 345.3±88.3# | 265.2±58.5# |
| 乙醇低剂量组 | 10 | 150 | 51.258±1.156## | 18.88±7.76 | 369.3±93.4# | 275.7±78.5# |
| 乙酸乙酯高剂量组 | 10 | 50 | 66.343±1.542** | 51.54±22.38** | 433.5±91.5* | 314.5±69.4* |
| 乙酸乙酯中剂量组 | 10 | 25 | 63.347±1.232** | 54.23±26.23** | 425.6±45.6* | 344.8±88.4* |
| 乙酸乙酯低剂量组 | 10 | 15 | 62.865±1.007** | 53.41±25.12** | 433.5±91.5* | 323.5±69.8* |
| 注:与正常组比较,*P < 0.05,**P < 0.01;与模型组比较,#P < 0.05,##P < 0.01。 | ||||||
模型组大鼠血清IL-1β及TNF-α浓度均显著高于正常组(P<0.05);乙醇低、中、高剂量组及阿司匹林组大鼠血清IL-1β及TNF-α浓度显著低于模型组(P<0.05),乙酸乙酯部位组与模型组比较差异无显著性(P>0.05)。见表 2。
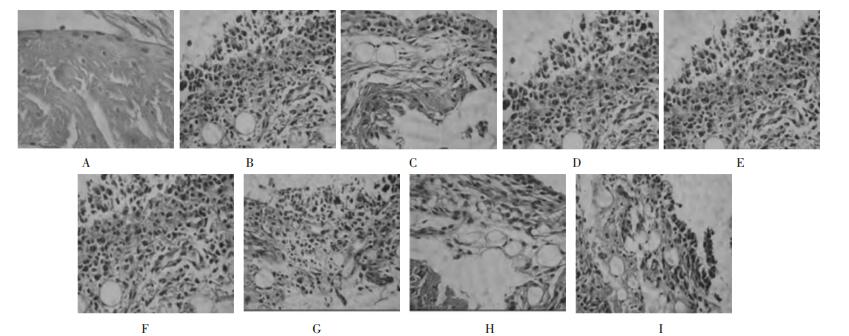
3.4 大鼠关节组织病理形态学改变及单位面积炎症细胞计数正常组大鼠的踝关节滑膜组织结构清晰,无炎细胞浸润。模型组滑膜组织内见有尿酸盐结晶体,炎症明显,炎细胞浸润,滑膜细胞排列不整齐,纤维炎性蛋白渗出物。与模型组比较,阿司匹林组滑膜组织有轻度炎性渗出,滑膜细胞增生,但细胞排列较整齐,结构较完整。QZLHD水提液乙醇部位低剂量组滑膜组织有水肿,表面有炎性渗出,细胞边缘不规整;中剂量组滑膜组织炎性渗出明显减轻,有水肿,无炎细胞浸润,细胞边缘整齐,形态较规则;高剂量组滑膜组织有水肿,炎细胞浸润,但渗出减轻;QZLHD水提液乙酸乙酯部位高、中、低剂量组滑膜组织内病理形态与模型组相似,可见有尿酸盐结晶体,炎症明显,炎细胞浸润,滑膜细胞排列不整齐,纤维炎性蛋白渗出物。见图 1。模型组及QZLHD水提液乙酸乙酯部位组淋巴细胞计数显著高于正常组(P<0.01),阿司匹林组和QZLHD水提液乙醇部位低、中、高剂量组均显著低于模型组(P<0.01),结果见表 2。
|
| 图 1 QZLHD对大鼠关节病理组织变化的影响(HE,×400) Fig. 1 Effects of QZLHD on pathological morphology of the joint tissue of rats(HE, ×400) A.正常组;B.模型组;C.阿司匹林组;D. QZLHD水提液乙醇部位低剂量组;E. QZLHD水提液乙醇部位中剂量组;F. QZLHD水提液乙醇部位高剂量组;G. QZLHD水提液乙酸乙酯部位低剂量组;H. QZLHD水提液乙酸乙酯部位中剂量组;I. QZLHD水提液乙酸乙酯部位高剂量组 |
痛风是长期嘌呤代谢紊乱和尿酸排泄减少引起的一组疾病。高尿酸血症和尿酸盐结晶沉淀是其重要临床特征,同时,血尿酸的测定也是痛风的临床诊断项目之一[8]。本研究表明,QZLHD水提液乙醇低、中、高剂量组大鼠血尿酸水平显著低于模型组,并且能显著降低关节肿胀度,改变大鼠关节组织病理形态,可有效控制痛风性关节炎的症状。
血清IL-1β是目前公认的最重要的炎症细胞因子之一,大量IL-1β聚集有确切的致炎作用[9]。在关节部,IL-1β可刺激TNF-α等细胞因子的分泌[10],因此,TNF-α也与痛风性关节炎有密切的关系。本实验结果表明,QZLHD水提液乙醇部位低、中、高剂量组及阿司匹林组大鼠血清IL-1β及TNF-α浓度显著低于模型组,提示,QZLHD对痛风性关节炎的治疗作用与抑制IL-1β及TNF-α表达有关。
研究表明QZLHD水提液乙醇部位能显著抑制痛风性关节炎模型大鼠踝关节肿胀度,显著降低模型大鼠血清中UA水平,并能改善滑膜组织病理状态。而QZLHD水提液乙酸乙酯部位均未见改善作用,提示QZLHD治疗痛风性关节炎的有效部位是乙醇提取物。说明QZLHD治疗痛风性关节炎是极性较高的成分,如:人参皂苷、肉桂酸、黄酮苷等共同作用的结果,乙酸乙酯部位中的主要成分为黄酮苷元、香豆素等,结果未发现QZLHD乙酸乙酯部位具有治疗急性痛风性关节炎的作用。此结论提示对QZLHD的进一步开发利用应针对乙醇部位,即高极性化学成分进行深入研究,以确定其确切物质基础。
| [1] | 杜冠华. 实验药理学[M]. 北京: 中国协和医科大学出版社, 2004: 26. |
| [2] | 陈昉, 姚红, 童娟, 等. 白子菜提取物对痛风性关节炎大鼠模型的抗炎免疫作用[J]. 广州中医药大学学报, 2015, 32 (2): 275–281. |
| [3] | 姜德友, 张晓鑫, 解颖, 等. 痛风宁防治急性痛风性关节炎的实验研究[J]. 天津中医药, 2012, 29 (4): 372–374. |
| [4] | 徐轶尔, 孙贵才, 郑春雨, 等. 豨莶草对尿酸钠引起痛风性关节炎IL-1β、TNF-α、NF-κB表达的影响[J]. 风湿病与关节炎, 2015, 4 (1): 9–13. |
| [5] | 张磊, 邓强, 赵道洲, 等. 痛风圣液对大鼠痛风性关节炎模型IL-1β、TNF-α、IL-4的影响[J]. 西部中医药, 2014, 27 (11): 7–10. DOI:10.3969/j.issn.1004-6852.2014.11.003 |
| [6] | 杨俊玲, 卢军, 刘晶, 等. 白喉乌头及其炮制品对佐剂致类风湿性关节炎大鼠的实验研究[J]. 中成药, 2015, 37 (11): 2495–2501. |
| [7] | 严国鸿, 黄燕, 李煌, 等. 双藤痹痛凝胶膏剂对胶原诱导性关节炎模型大鼠的作用[J]. 中药药理与临床, 2014, 30 (1): 119–121. |
| [8] | 佟强. 血必净注射液治疗急性痛风性关节炎的临床观察[J]. 天津中医药, 2013, 30 (8): 462–464. DOI:10.11656/j.issn.1672-1519.2013.08.06 |
| [9] | 李钟, 韩彬, 黄惠珠, 等. 虎杖-桂枝药对配伍对痛风性关节炎大鼠TLR4/MyD88信号转导通路的影响[J]. 广州中医药大学学报, 2015, 32 (6): 1040–1046. |
| [10] | 侯晓东, 刘洪柏, 刘克敏. 体外冲击波对兔膝骨关节炎软骨白细胞介素-1β及肿瘤坏死因子-α表达的影响[J]. 中国康复理论与实践, 2014, 20 (2): 121–124. |
 2018, Vol. 35
2018, Vol. 35