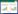文章信息
- 张中群, 张竞, 刘永彬, 王彧, 柴欣
- ZHANG Zhongqun, ZHANG Jing, LIU Yongbin, WANG Yu, CHAI Xin
- Thermal Shift高通量筛选法快速筛选覆盆子中雌激素样活性化合物
- Rapid screening of estrogen-like active compounds from Rubus chingii Hu by Thermal Shift high throughput screening method
- 天津中医药, 2018, 35(3): 221-224
- Tianjin Journal of Traditional Chinese Medicine, 2018, 35(3): 221-224
- http://dx.doi.org/10.11656/j.issn.1672-1519.2018.03.18
-
文章历史
- 收稿日期: 2017-11-08
2. 天津艾赛博生物技术有限公司, 天津 300457
覆盆子为蔷薇科植物华东覆盆子(Rubus chingii Hu)的干燥果实,具有强壮、补益、补肾壮阳的功效[1]。现代药理研究表明覆盆子具有抗氧化、抗炎、抗血栓、抗肿瘤等活性,其主要含有黄酮类、萜类、甾体类、酚酸类等化合物[2]。
Thermal Shift Assay是近年新发展的一种基于荧光技术的快速检测方法[3],通过实时检测蛋白荧光染料(如Sypro Orange)的荧光信号观察蛋白的热稳定性[4]。Protein Thermal Shift方法不仅可以快速测定蛋白热稳定性,还可以作为一个高效的筛选工具[5],筛选对蛋白有作用的配体化合物。不同配体对蛋白热稳定性的影响不同,有的提高蛋白热稳定性,有的则降低蛋白热稳定性[6],在实验过程中通过观察蛋白的熔解温度(Tm)判断配体化合物对蛋白的作用强弱。
覆盆子具有抗骨质疏松作用[7],与其化学成分的雌激素样活性相关[8-9],研究表明覆盆子的乙酸乙酯部位具有较强的雌激素样作用,显著促进MCF-7细胞增殖[10]。本研究采用Thermal Shift高通量筛选方法,对覆盆子中的10个主要化学成分(覆盆子酸、山柰酚、山柰酚-3-O-芸香糖苷、山柰酚-3-O-葡萄糖苷、山柰酚-3-O-洋槐糖苷、槲皮素-3-O-洋槐糖苷、芦丁、异槲皮苷、金丝桃苷和短叶苏木酚酸)进行筛选。
1 材料 1.1 质粒与菌株pET-32a、pET-28a由南开大学郭宇副教授课题组惠赠;DH5α、BL21(DE3)感受态细胞购自全式金生物技术有限公司。优化的hERα、hERβ基因由苏州金唯智生物科技有限公司合成并构建至pUC-57载体中。
1.2 药物与试剂覆盆子酸、山柰酚、山柰酚-3-O-芸香糖苷、山柰酚-3-O-葡萄糖苷、山柰酚-3-O-洋槐糖苷、槲皮素-3-O-洋槐糖苷、芦丁、异槲皮苷、金丝桃苷和短叶苏木酚酸为本实验室自制;琼脂糖凝胶DNA回收试剂盒、快速质粒小提试剂盒购自天根生化科技有限公司;Sal I、BamH I、Nde I限制性核酸内切酶为Thermo公司产品;LB Broth、氯化钠、甘油、咪唑、氨苄青霉素、卡那霉素、IPTG、Tris、Heps购自上海生工生物科技有限公司;Ni-NTA纯化介质,Hi-Trap Heparin柱购自GE Healthcare;雌二醇(E2)、SYPRO® Orange Protein Gel Stain dye购自Sigma Aldrich。
1.3 仪器高压破菌机(JNBIO,中国);AKTA Explore蛋白纯化系统(GE Healthcare);Real-Time PCR(LightCycler® 480, 罗氏)。
2 方法 2.1 hERα-LBD、hERβ-LBD基因扩增采用primer引物设计软件,通过编码hERα-LBD、hERβ-LBD的基因序列设计hERα-LBD、hERβ-LBD扩增的上、下游引物。hERα-LBD(上游引物:5'-GCGGAT-CCAAGAAAAACAGCCTGGC-3',下游引物:5'-TTG-TCGACTTACGGTGCATGTAAACGGTGT-3)和hERβ-LBD(上游引物:5'-TTCATATGATGGATATCAAGA-ATAGCCCG-3',下游引物:5'-ATGGATCCTTACTG-ACTCTGCGGATTCTG-3')。以人工合成的hERα、hERβ全长基因为模板,扩增hERα-LBD、hERβ-LBD基因片段。PCR扩增条件为:94℃预变性5 min,95℃变性50 s,58℃退火50 s,72℃延伸2 min,30个循环。通过琼脂糖凝胶电泳检测扩增产物。
2.2 原核表达重组质粒的构建采用琼脂糖凝胶电泳检测扩增产物,琼脂糖凝胶DNA回收试剂盒回收扩增产物。将pET32a质粒和hERα-LBD扩增产物分别用BamH Ⅰ和SaLⅠ双酶切;pET28a质粒和hERβ-LBD扩增产物分别用Nde Ⅰ和BamH Ⅰ双酶切,回收基因和质粒。将基因与载体连接转化DH5a感受态细胞,提取质粒并双酶切鉴定为阳性克隆后测序验证插入序列的完整性和正确性。
2.3 重组质粒转化取两支100 μL BL21(DE3)商业感受态细胞,分别加入1 μL pET32a、pET28a重组质粒,冰浴30 min,42℃热激90 s,再次冰浴6 min,随后转入1 mL无抗LB液体培养基中,37℃振荡培养1 h使细胞复苏,取200 μL涂固体LB平板,37℃培养箱中过夜培养。
2.4 hERα-LBD、hERβ-LBD重组蛋白的表达纯化将hERα-LBD或hERβ-LBD BL21(DE3)阳性转化子接种到5 mL带有抗性的LB液体培养基(含100 μg/mL氨苄青霉素或50 μg/mL卡那霉素)培养5 h,紫外可见分光光度计600 nm检测,当吸光度A值为0.6时转入800 mL LB液体培养基(含100 μg/mL氨苄青霉素或50 μg/mL卡那霉素)中37℃继续振荡培养。当600 nm的吸光度A值为0.6时,降温至16℃然后加入0.25 mmol/L IPTG诱导培养16 h。4 000 g,4℃条件下,离心15 min倒掉上清液,加入适量体积的裂解缓冲液(hERα-LBD:20 mmol/L Hepes、300 mmol/L NaCl、10%甘油、pH 7.5;hERβ-LBD:20 mmol/L Tris-HCl、300 mmol/L NaCl、10%甘油、pH 8.5)振荡重悬收集细胞。收集后的细胞采用高压破菌机4℃循环破碎,25 000 g离心30 min,取上清液。采用预处理的Ni-NTA亲和层析柱处理上清液,裂解缓冲液(含50 mmol/L咪唑)去除杂质蛋白,含500 mmol/L咪唑的裂解缓冲液洗脱目的蛋白。目的蛋白浓缩后,4℃条件下10 000 g离心10 min,取上清液,采用AKTA Exploer层析系统进一步纯化。hERα-LBD流动相为(缓冲液A:20 mmol/L Hepes、50 mmol/L NaCl、5%甘油,pH 7.5,缓冲液B:20 mmol/L Hepes、1 mol/L NaCl、5%甘油,pH 7.5);hERβ-LBD流动相为(缓冲液A:20 mmol/L Tris-HCl、50 mmol/L NaCl、5%甘油,pH 8.5,缓冲液B:20 mmol/L Tris-HCl、1 mol/L NaCl、5%甘油,pH 8.5)。收集纯化后的流分并取样用于SDS-PAGE分析。
2.5 Thermal Shift Assays候选化合物覆盆子酸、山柰酚、山柰酚-3-O-芸香糖苷、山柰酚-3-O-葡萄糖苷、山柰酚-3-O-洋槐糖苷、槲皮素-3-O-洋槐糖苷、芦丁、异槲皮苷、金丝桃苷、短叶苏木酚酸以及阳性对照E2分别用二甲基亚砜(DMSO)配制成100 mmol/L的母液,备用。hERα-LBD、hERβ-LBD、Sypro Orange、候选化合物分别用相应的储存缓冲液(hERα-LBD测试体系:含20 mmol/L Hepes,300 mmol/L NaCl,pH 7.5;hERβ-LBD测试体系:含20 mmol/L Tris-HCl,300 mmol/L NaCl,pH 8.5)稀释,分别将两个蛋白稀释至10 μmol/L,化合物稀释至100 μmol/L。候选化合物与蛋白溶液以1:1(v/v)混匀后加入96孔板中,每孔20 μL,平行设置3个复孔,冰上孵育30 min,避光加入稀释后的Sypro Orange1 μL(商品母液稀释1000倍),封膜,在4℃条件下1000 g,离心2 min使孔内无气泡。以E2为阳性对照,以含蛋白的缓冲液的为阴性对照,以储存缓冲液为空白对照。采用Real-Time PCR-LightCycler® 480系统通过连续测定20~95℃过程中SYPRO Orange染料的荧光强度变化从而监测蛋白的去折叠过程。采用LightCycler® 480软件(V1.5.0,Roche)拟合熔解曲线、计算蛋白熔化温度(Tm)。
3 结果 3.1 hERα-LBD、hERβ-LBD重组蛋白SDS-PAGE蛋白经AKTA Exploer层析系统进一步纯化,收集流分,每500 μL为一个流分,采用SDS-PAGE对hERα-LBD、hERβ-LBD重组蛋白进行分析,分析结果如图 1所示。
|
| 图 1 hERα-LBD (A) 、hERα-LBD (B) 的 SDS-PAGE 结果(M:Marker) Fig. 1 SDS-PAGE results of hERα-LBD (A) and hERα-LBD (B) (M: Marker) |
由图 1可见hERα-LBD、hERβ-LBD大小与目的蛋白一致且纯度均在95%以上,可用于进一步配体结合实验。合并流分用30 kD超滤离心管浓缩并换液到储存缓冲液中,Nanodrop2000测得hERα-LBD的浓度为6 mg/mL,hERβ-LBD的浓度为3.5 mg/mL,液氮瞬间冷冻,-80℃保存。
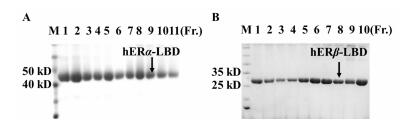
3.2 候选化合物对受体蛋白热稳定性的影响蛋白随温度升高会发生解链从而暴露出疏水性氨基酸,利用这一特性,可以特异性的添加一些仅与暴露的疏水性氨基酸结合的蛋白荧光染料,通过实时检测荧光信号即可观察蛋白的热稳定性状况。本实验根据PCR-LightCycler480系统检测到的蛋白熔解荧光信号随温度的实时变化,结合候选化合物对hERα-LBD或hERα-LBD的Thermal Shift图像,计算出候选化合物对hERα-LBD或hERα-LBD的熔化温度变化(ΔT)。以ΔT为指标筛选具有作用的配体化合物,结果如图 2所示,当ΔT > 2时为对受体蛋白具有作用的配体化合物[6]。
|
| 图 2 候选化合物对 hERα-LBD、hERβ-LBD 熔解温度的影响 Fig. 2 Effects of candidate compounds on melting temperature of hERα-LBD and hERβ-LBD |
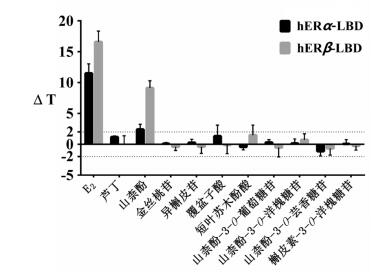
由图 2所示,E2显著提高了两种雌激素受体配体结合域(hERα-LBD、hERβ-LBD)的热稳定性;在候选化合物中山柰酚能明显提高hERα-LBD和hERβ-LBD的熔解温度(ΔT > 2),尤其对hERβ-LBD的作用较显著。山柰酚作用于两种雌激素受体亚型配体结合域的实时熔解曲线如图 3所示。
|
| 图 3 山柰酚对 hERα-LBD(A)、hERβ-LBD(B)熔解温度的影响 Fig. 3 Effects of Kaempferol on melting temperature of hERα-LBD (A) and hERβ-LBD (B) |
雌激素为甾体类化合物,具有广泛的生物活性,不仅在女性生殖器官的发育、第二性征的维持中起着重要的作用,而且对骨质代谢、脂类代谢、心血管和神经系统等也有重要的作用[11-13]。雌激素的经典作用机制认为,雌激素首先与雌激素受体上的配体结合区合并使受体二聚化,进一步使雌激素受体的DNA结合区(DBD)与靶基因启动子上的雌激素应答元件(ERE)结合,从而启动靶基因的转录[14-15]。雌激素可用于治疗绝经期女性心血管疾病、绝经后骨质疏松等疾病,因此激素替代治疗(HRT)广泛应用于临床。然而HRT是把双刃剑,带来改善的同时也带来不少的毒副作用,如:子宫内膜出血、乳房胀痛,增加中风、静脉血栓、乳腺肿瘤、子宫内膜肿瘤等的发生率[16-17]。植物雌激素(PE)是一类从天然植物中提取,结构与内源性雌激素相似的一类化合物,能够模拟雌激素在人体内的理化作用,与雌激素受体的两种亚型均可结合并将其激活[18-20],但亲和力相对较弱。植物雌激素对绝经后骨质疏松、肿瘤、心血管疾病、老年性痴呆症等疾病有独特的预防和治疗功效,同时比雌激素有更多优点[21]。植物雌激素根据其化学结构,主要分为4大类:黄酮类、香豆素类、木脂素类以及二苯乙烯类[22-23]。
黄酮类化合物是覆盆子代谢过程中产生的重要天然有机化合物,是覆盆子中主要活性成分之一,山柰酚属于黄酮类化合物,具有、抗肿瘤、抗炎、抗氧化、抗菌、抗病毒等多种功效[24]。本研究基于雌激素受体与配体结合发挥作用的机制,采用高通量筛选方法筛选覆盆子中的植物雌激素,操作简单,为筛选中药中雌激素样活性化合物或者其它可通过与靶蛋白结合发挥作用的活性化合物提供了一个高效、快速的研究方法。
| [1] | 程丹, 李洁, 周斌, 等. 覆盆子化学成分与药理作用研究进展[J]. 中药材, 2012, 35 (11): 1873–1876. |
| [2] | 杜龙飞, 李洁, 杨龙, 等. 覆盆子的化学成分研究[J]. 天然产物研究与开发, 2014, 26 (12): 1957–1960. |
| [3] | 朱俊萍, 范东瀛. Thermal Shift Assays在重组森林脑炎病毒丝氨酸蛋白酶纯化中的应用[J]. 中国生物工程杂志, 2009, 29 (11): 53–59. |
| [4] | De CL, Wang X, Spyrou JA, et al. More-powerful virus inhibitors from structure-based analysis of HEV71 capsid-binding molecules[J]. Nat Struct Mol Biol, 2014, 21 (3): 282–288. DOI:10.1038/nsmb.2769 |
| [5] | Zubriene A, Matuliene J, Baranauskiene L, et al. Measurement of nanomolar dissociation constants by titration calorimetry and thermal shift assay-radicicol binding to Hsp90 and ethoxzolamide binding to CAⅡ[J]. Int J Mol Sci, 2009, 10 (6): 2662–2680. DOI:10.3390/ijms10062662 |
| [6] | Fu X, Wang Z, Li L, et al. Novel Chemical Ligands to Ebola Virus and Marburg Virus Nucleoproteins Identified by Combining Affinity Mass Spectrometry and Metabolomics Approaches[J]. Sci Rep, 2016 (6): 29680. |
| [7] | 龚剑秋, 梁文清. 覆盆子抗骨质疏松化学组成及抗骨质疏松活性成分研究[J]. 中华中医药学刊, 2016, 34 (3): 657–659. |
| [8] | 王俊玲, 黄思敏, 梁启瑶, 等. 雌激素的来源及其在骨代谢中的作用[J]. 中国骨质疏松杂志, 2015, 21 (6): 729–732. |
| [9] | Lagari VS, Levis S. Phytoestrogens in the prevention of postmenopausal bone loss[J]. Clin Densitom, 2013, 16 (4): 445–449. DOI:10.1016/j.jocd.2013.08.011 |
| [10] | 程科军. Ⅰ. 覆盆子活性成分研究Ⅱ. 金雀根中二苯乙烯类成分的稳定性研究[D]. 上海: 复旦大学, 2008. |
| [11] | Takeshi U. Pharmaceutical prospects of phytoestrogens[J]. Endocr J, 2006, 53 (1): 7. DOI:10.1507/endocrj.53.7 |
| [12] | 袁婷婷, 张乃丹, 何勇静, 等. 天然药物中植物雌激素样化学成分的研究进展[J]. 中国中药杂志, 2014, 39 (23): 4526–4531. |
| [13] | 黄颖, 周艳华, 崔海峰, 等. 雌激素调节作用机制研究进展[J]. 中国医药导报, 2010, 7 (5): 7–8, 11. |
| [14] | 孟庆书, 何平, 朱晓燕, 等. 植物雌激素的作用机制[J]. 生命的化学, 2007, 27 (2): 141–143. |
| [15] | 赵晓民, 徐小明. 雌激素受体及其作用机制[J]. 西北农林科技大学学报(自然科学版), 2004, 32 (12): 154–158. DOI:10.3321/j.issn:1671-9387.2004.12.035 |
| [16] | Anderson GL, Limacher M, Assaf A R, et al. Effects of conjugated equine estrogen in postmenopausal women with hysterectomy:the Women's Health Initiative randomized controlled trial[J]. JAMA-The Journal of the American Medical Association, 2004, 291 (14): 1701–1712. DOI:10.1001/jama.291.14.1701 |
| [17] | Rossouw JE, Anderson GL, Prentice RL, et al. Risks and benefits oestrogen plus progestin in healthy postmenopausal women:principal results From the Women's Health Initiative randomized controlled trial[J]. JAMA-The Journal of the American Medical Association, 2002, 288 (3): 321–333. DOI:10.1001/jama.288.3.321 |
| [18] | Branca F, Lorenzetti S. Health effects of phytoestrogens[J]. Forum Nutr, 2005, 57 (57): 100–111. |
| [19] | Soto AM, Sonnenschein C, Chung KL, et al. The E-screen assay as a tool to identify estrogens:an update on estrogenic environmental pollutants[J]. Environ Health Perspect, 1995, 103 (7): 113. |
| [20] | Mueller SO. Overview of in vitro tools to assess the estrogenic and antiestrogenic activity of phytoestrogens[J]. Chromatography B, 2002, 777 (1-2): 155. DOI:10.1016/S1570-0232(02)00282-9 |
| [21] | Cos P, De Bruyne T, Apers S, et al. Phytoestrogens:recent developments[J]. Planta Medica, 2003, 69 (7): 589–599. DOI:10.1055/s-2003-41122 |
| [22] | Strauss L, Santti R, Saarinen N, et al. Dietary phytoestrogens and their role in hormonally dependent disease[J]. Toxicology Letters, 1998, 102-103 (102/103): 349–354. |
| [23] | Cassidy A, Hanley B, Lamuela-Raventos RM. Isoflavones, lignans and stilbenesorigins, metabolism and potential importance to human health[J]. Journal of the Science of Food and Agriculture, 2000, 80 (7): 1044–1062. DOI:10.1002/(ISSN)1097-0010 |
| [24] | 陈育华, 周克元, 袁汉尧. 山柰酚药效的研究进展[J]. 广东医学, 2010, 31 (8): 1064–1066. |
2. Tianjin Acelbio Biological Technology Co., Ltd., Tianjin 300457, China
 2018, Vol. 35
2018, Vol. 35