文章信息
- 康利, 陈冠, 王梓, 贾淑杰, 王露, 樊威伟
- KANG Li, CHENG Guan, WANG Zi, JIA Shujie, WANG Lu, FAN Weiwei
- 肾衰1号对肾脏缺血再灌注大鼠KIM-1和NGAL蛋白表达的影响
- Effect of Shenshuai No.1 on sensitive proteins KIM-1 and NGAL in kidney ischemia-reperfusion rats
- 天津中医药, 2018, 35(4): 289-292
- Tianjin Journal of Traditional Chinese Medicine, 2018, 35(4): 289-292
- http://dx.doi.org/10.11656/j.issn.1672-1519.2018.04.14
-
文章历史
- 收稿日期: 2017-12-03
2. 天津市海河医院, 天津 300350;
3. 天津医科大学, 天津 300070;
4. 天津市中医药研究院附属医院, 天津 300120
急性肾损伤(AKI)是临床上常见且严重的综合征之一,越来越多的证据显示AKI会引起慢性肾病(CKD)和晚期肾病(ESRD)的发展[2]。因此临床迫切需要针对AKI的治疗药物将肾病控制在初级阶段,防止病情进一步发展成为CKD和ESRD。
肾衰1号是张大宁教授所创,是经大量临床病例证实对肾功能衰竭患者有良好效果的方药[3-5]。该方由黄芪、大黄、大黄炭、丹参、川芎、蒲黄炭等组成[6],黄芪益气扶正,丹参、川芎活血化瘀,大黄及大黄炭利湿泄浊解毒活血。诸药共奏泄浊利湿清热解毒益气活血之功[7]。文章从AKI早期标志物肾损伤因子-1(KIM-1)和中性粒细胞明胶酶相关脂质运载蛋白(NGAL)入手,研究肾衰1号对肾脏缺血再灌注大鼠的干预作用,为中药治疗AKI提供理论发据[8-10]。
1 实验材料 1.1 实验动物SD大鼠,雄性,体质量190~220 g,共120只。购自中国人民解放军军事医学科学院卫生学环境医学研究所,许可证号:SCXK(军)2014-0001。
1.2 实验药物受试药物:根据处方进行制备成含生药2 g/mL的浓缩液,人用剂量每日每剂135 g生药,肾衰1号高剂量15.4生药g/kg,肾衰1号低剂量4.8生药g/kg。阳性药物:尿毒清颗粒,由广州康臣药业有限负责公司生产,规格:5 g/袋,人用剂量每日25 g药粉。批号:20160315,给药量:0.2 mg/kg。
2 实验方法 2.1 动物分组与造模方法根据缺血再灌注时间分成1 d、3 d、7 d组,每个观察时间点将大鼠随机分成假手术组、模型组、阳性药组、肾衰1号高剂量组、肾衰1号低剂量组,每组8只。
SD大鼠适应性喂养1周后,戊巴比妥钠45 mg/kg腹腔注射麻醉,除假手术对照组仅进行皮肤及肌肉切开分离双侧肾动脉外,其余大鼠均暴露双侧肾动脉并同时用动脉夹夹闭双侧肾动脉,30 min后同时松开双侧血管夹,恢复双侧肾组织血供,观察肾组织颜色变化,从紫色变为红色说明造模成功。
2.2 给药方法除假手术、模型组外,各组在造模前预防给药3 d,造模后持续给药直至观察时间点,灌注给药,每日1次。给药体积为10 mL/kg。造模后每日对大鼠进行一般形态观察,大便、毛色及饮食等一般情况。根据再灌注时间,分别在造模后1 d、3 d、7 d进行取材。
2.3 肾脏组织学检查取一侧肾脏置于10%甲醛水溶液中固定,梯度乙醇脱水,二甲苯透明石蜡包埋切片厚度3 μm后,苏木精-伊红(HE)染色。
2.4 肾功能检测用全自动血生化仪测定各组大鼠血尿素氮(BUN)和血肌酐(Scr)。
2.5 肾组织中KIM-1和NGAL表达的测定采用Western Blot法测定肾组织中KIM-1和NGAL的表达。每一样本称取肾组织50 mg,用RIPA裂解液超声匀浆肾组织,4 ℃ 12 000 r/min离心10 min,取上清为样本,考马斯亮蓝法测定蛋白浓度;每孔取45 g总蛋白上样,4%十二烷基硫酸钠一聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶电泳,后转移至聚偏二氟乙烯PVDF膜上,加入5%脱脂奶粉封闭60 min,加入KIM-1(1:300),NGAL(1:300)抗体,4 ℃冰箱孵育过夜,加入辣根过氧化物酶标记的羊抗兔多克隆抗体室温孵育1 h,用曝光法显影,以β-Actin为内参照,用Image J软件对条带进行灰度分析。
2.6 统计学处理采用SPSS 18.5统计软件进行检验,实验数据以均数±标准差(x±s)表示。多组间比较采用单因素方差分析,组间两两比较若方差齐采用LSD检验,若方差不齐采用Dunnett’s T3检验,P < 0.05有统计学意义。
3 结果 3.1 术后一般性观察模型组与假手术组比较,毛发竖立,颤抖及行动迟缓现象,各给药组在每个时期体态特征均优于模型对照组,各给药组之间肉眼观察差异不明显。
3.2 肾功能指标变化模型组与假手术组比较,第1、3、7天的SCr和BUN均显著上升(P < 0.001)。与模型组比较,各给药组BUN和Scr明显下降(P < 0.05,P < 0.001)。肾衰1号高剂量组效果明显,见表 1。
| 组别 | 动物数 | BNU(mmol/L) | Scr(μmol/L) | |||||
| 第1天 | 第3天 | 第7天 | 第1天 | 第3天 | 第7天 | |||
| 假手术组 | 8 | 6.50±0.39 | 6.36±0.82 | 6.26±1.00 | 32.00±1.31 | 33.00±2.00 | 35.88±1.55 | |
| 模型组 | 8 | 22.04±2.52### | 14.31±1.16### | 10.57±2.13### | 119.63±13.04### | 68.00±7.91### | 48.88±5.46### | |
| 肾衰1号高剂量组 | 8 | 15.54±0.69*** | 10.06±1.73*** | 6.46±1.05*** | 76.38±6.48*** | 46.13±5.19*** | 38.13±3.14*** | |
| 肾衰1号低剂量组 | 8 | 14.87±0.77*** | 12.21±1.86** | 7.31±1.05** | 74.75±5.37*** | 53.88±6.79*** | 42.00±3.96** | |
| 阳性药组 | 8 | 16.48±0.73*** | 12.19±1.80** | 8.33±1.59** | 87.13±5.25*** | 52.38±4.75*** | 42.00±4.66** | |
| 注:与模型组比较,**P < 0.01,***P < 0.001;与假手术组比较,###P < 0.001。 | ||||||||
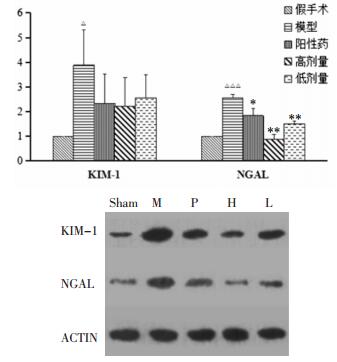
从SCr和BUN数据可以看出,第3天各组的SCr和BUN开始下降,到第7天趋于正常,且在造模后24 h,两蛋白均能达到峰值区间[11-14]。故考察第1天的肾组织做KIM-1和NGAL蛋白表达的比较。与假手术组相比,模型组KIM-1和NGAL蛋白表达均显著升高(P < 0.05,P < 0.001);与模型组相比,给药组NGAL蛋白表达均明显下降(P < 0.05,P < 0.001),见图 1。
|
| 图 1 各组大鼠1天肾组织KIM-1,NGAL蛋白表达比较 Fig. 1 Comparison of expression of proteins KIM-1, NGAL of kidney tissue of each group on 1 day Sham:假手术组,M:模型对照组,P:阳性药组,H:高剂量组,L:低剂量组与假手术对照组比较,△P < 0.05,△△△P < 0.001;与模型组比较,*P < 0.05,**P < 0.001。 |
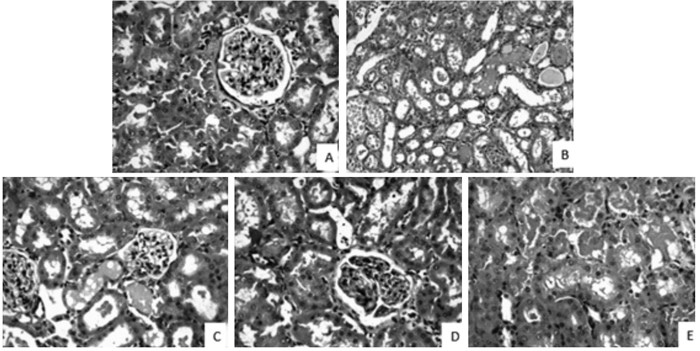
HE病理染色可见假手术组肾小球体积未见缩小或肥大,数目未见减少,各肾小管上皮细胞未见变性、坏死或脱落,管腔中未见管型及结石,肾间质未见炎细胞浸润及纤维组织增生。
模型组第1天可见局部肾间质出血,肾小管上皮细胞脱落,部分形成管型。第3天模型组肾损伤进程已经趋于稳定并表现出较严重的损伤状态,由于肾小管上皮细胞进一步变性坏死脱落,可见大面积的肾小管扩张以及管型,并有周围淋巴细胞侵润。第7天模型组肾损伤进程进入平稳期,上皮细胞脱落减少,肾小管扩张及管型已稳定部分可见淋巴细胞浸润。
受试剂量组及尿毒清颗粒阳性药组在第1天就有不同程度改善,以肾衰1号高剂量组改善较为明显,其表现为肾小管上皮细胞坏死及脱落较模型组减少。第3天各给药组与第1天情况大体一致。第7天给药各组已进入恢复期,肾衰1号高剂量组可见极少坏死脱落细胞,管型相对模型组数量少,且形态小,肾小管形态结构良好。肾衰1号低剂量组及阳性药组管型稍大且多但优于模型组伴有少量淋巴细胞浸润,图 2。
|
| 图 2 肾衰1号对AKI各组大鼠肾组织病理改变情况(HE,×200) Fig. 2 Effect of Shenshuai No.1 on renal tissue pathology(HE, ×200) A假手术组;B模型组;C阳性药组;D高剂量组;E低剂量组 |
中医认为AKI的病因病机是由于正气不足引起的,而虚瘀浊毒是AKI发病的关键病机[15]。肾衰1号其中医理论核心“补肾活血降逆排毒法”,是AKI病因病机对症治疗。
AKI病理生理主要表现为肾脏细胞组织管型及上皮、血管细胞损伤且伴有炎症反应[16]。KIM-1和NGAL是AKI重要生物标志物,两者均可能在AKI早期呈高水平表达,是较传统指标更敏感的AKI生物学指标。KIM-1是一种独特的磷脂酰丝氨酸受体,可赋予肾小管上皮细胞吞噬功能,有利于凋亡坏死细胞的清除,减轻小管梗阻。体外实验还发现KIM-1蛋白近膜区可裂解为可溶性KIM-1,这种裂解已是p38MAPK信号介导的。而p38MAPK在由多种应激刺激原或炎症因子激活的信号通路中扮演重要角色,并介导细胞生理病理改变[17-20]。综上所述可以推测,当AKI发生时,由于肾脏组织受损导致坏死、出血及炎症的发展,这些连锁反应激活了p38MAPK通路,随着通路的激活,驱使细胞多个因子基因表达,KIM-1和NAGL蛋白在这个过程中被分泌出来。机体处于自我保护的应激反应中开始对肾脏进行保护和修复。而肾衰1号的给予可以在这个阶段对肾脏起到保护和清除凋亡细胞的作用,使肾损伤最小化,从而降低KIM-1、NAGL蛋白的产生。
本研究结果表明肾衰1号在AKI初期阶段可降低肾损伤程度,稳定病情其表现为显著降低大鼠的BUN、Scr、KIM-1和NGAL的水平,从病理HE染色也能清晰的看出对比模型组,受试组未见明显炎症及细胞凋亡现象,细胞形态比较正常。在AKI中期阶段,肾衰1号能对损伤细胞的修复、对坏死细胞的重建、改善肾小球血流动力学减少肾小管的梗阻,起到良好的保护及修复作用。肾衰1号临床上不仅可以治疗慢性肾衰,而且对AKI的前中期也有良好的治疗基础,也可避免进一步发展成为CKD和ESRD病。本研究不仅拓展了肾衰1号的临床应用范围,同时也为研发出作用靶点明确、安全有效、具有自主知识产权的AKI中药新药奠定基础。
| [1] | Xiao L, Zhou D, Tan RJ, et al. Sustained activation of Wnt/β-catenin signaling drives AKI to CKD progression[J]. J Am Soc Nephrol, 2016, 27 (6): 1727–1740. DOI:10.1681/ASN.2015040449 |
| [2] | Ainmhire E, Humphreys BD. Fibrotic changes mediating acute kidney injury to chronic kidney disease transition[J]. Nephron, 2017 (137): 264–267. |
| [3] | 张大宁, 张勉之, 陆伟根, 等. "补肾活血降逆排毒法"治疗慢性肾功能衰竭的临床及实验研究[J]. 医学研究杂志, 2005, 34 (9): 34–34. |
| [4] | 张勉之, 段惠军, 张大宁. 补肾活血法中药防治肾间质纤维化作用的实验研究[J]. 中草药, 2004, 35 (3): 302–304. |
| [5] | 张勉之. 补肾活血法治疗糖尿病肾病63例[J]. 天津医药, 2001, 29 (9): 558–560. |
| [6] | 贾淑杰, 康利, 王蕾, 等. 肾衰1号处方的筛选优化研究[J]. 天津药学, 2014, 26 (5): 1–4. |
| [7] | 张勉之, 张大宁. "补肾活血降逆排毒法"治疗慢性肾功能衰竭的临床研究[J]. 中华中医药杂志, 2004, 19 (1): 27–29. |
| [8] | Kaufmann J, Martinka P, Moede O, et al. Noradrenaline enhances angiotensin Ⅱ responses via p38 MAPK activation after hypoxia/re-oxygenation in renal interlobar arteries[J]. Acta Physiol (Oxf), 2015, 213 (4): 920–932. DOI:10.1111/apha.2015.213.issue-4 |
| [9] | Haase-Fielitz A, Haase M, Devarajan P. Neutrophil gelatinase-associated lipocalin as a biomarker of acute kidney injury:a critical evaluation of current status[J]. Ann Clin Biochem, 2014, 51 (3): 3335–3351. |
| [10] | Filiopoulos V, Biblaki D. Vlassopoulos Neutrophil gelatinase-associated lipocalin (NGAL):a promising biomarker of contrast-induced nephropathy after computed tomography[J]. D.Ren Fail, 2014, 36 (6): 979–986. DOI:10.3109/0886022X.2014.900429 |
| [11] | 李香敏, 白光辉, 梅峰, 等. 血清NGAL在大鼠肾脏缺血再灌注损伤不同时段的表达及意义[J]. 现代医学生物进展, 2012, 22 : 4231–4235. |
| [12] | 姜俊, 滕杰, 丁小强, 等. 急性肾损伤患者远期预后的研究进展[J]. 中华医学杂志, 2014, 94 (8): 635–687. |
| [13] | 杨晓梅, 刘岚, 庄亚敏, 等. StanfordA型主动脉夹层术后急性肾损伤行肾脏替代治疗患者的预后[J]. 中华胸心血管外科杂志, 2014, 30 (6): 346–349. |
| [14] | 张燕, 许清玉, 刘向东, 等. NGAL在大鼠肾脏缺血再灌注损伤不同时段中的表达及意义[J]. 临床和实验医学杂志, 2014, 13 (3): 165–168. |
| [15] | 聂卫群, 俞兴群, 林燕林. 从"虚瘀浊毒"论治急性肾损伤初探[J]. 中国中医急症, 2014, 23 (5): 863–865. |
| [16] | Togel FE, Westenfelder C. Kidney protection and regeneration fol-lowing acute injury:progress through stem cell therapy[J]. Am J Kidney Dis, 2012, 60 (6): 1012–1022. DOI:10.1053/j.ajkd.2012.08.034 |
| [17] | No K, Han J. The p38 signal transduction pathway:activation andfunction[J]. Cell Signal, 2000, 12 (1): 1–13. DOI:10.1016/S0898-6568(99)00071-6 |
| [18] | 宋莲莲, 赵军, 于金宇, 等. 环孢素引起肾小管上皮细胞培养液中肾损伤分子-1水平升高的机制[J]. 吉林大学学报(医学版), 2014, 40 (6): 1201–1205. |
| [19] | 张频捷, 朱立新, 耿小平. p38MAPK信号传导通路及其抑制剂的研究现状[J]. 安徽医药, 2010, 14 (5): 596–598. |
| [20] | 加慧卫, 黄晨. P38MAPK信号通路、p-P42/P44MAPK、中性粒细胞明胶酶相关脂质运载蛋白在肾脏纤维化过程中的作用[J]. 中华老年多器官疾病杂志, 2009, 8 (6): 568–571. |
2. Tianjin Haihe Hospital, Tianjin, 300350;
3. Medical University of Tianjin, Tianjin 300070, China;
4. Tianjin Academy of Traditional Chinese Medicine Afficiated Hospital, Tianjin 300120, China
 2018, Vol. 35
2018, Vol. 35