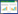文章信息
- 李少金, 方婉仙, 肖水秀, 匡文斌
- LI Shaojin, FANG Wanxian, XIAO Shuixiu, KUANG Wenbin
- 鱼腥草挥发油对小鼠脑缺血再灌注损伤的保护作用及机制研究
- Protective effect and mechanism of volatile oil from Yuxingcao on cerebral ischemia-reperfusion injury in mice
- 天津中医药, 2018, 35(4): 297-301
- Tianjin Journal of Traditional Chinese Medicine, 2018, 35(4): 297-301
- http://dx.doi.org/10.11656/j.issn.1672-1519.2018.04.16
-
文章历史
- 收稿日期: 2017-11-27
2. 广州市达瑞生物技术股份有限公司, 广州 510665
近年来,随着社会经济的高速发展和人民生活水平的提高,脑血管病己经成为中国居民的第一死因。中国平均每年200多万人罹患此病,其中150万以上死亡。脑血管病包括出血性和缺血性脑血管病两大类,其中脑缺血性卒中发病率最高,约占全部卒中的75%[1]。临床上治疗脑缺血性卒中的唯一有效方法为快速恢复再灌注[2],但研究发现再灌注后反而进一步加剧脑损伤即脑缺血再灌注损伤。其机制较为复杂,目前尚没完全阐明,主要是与炎性反应、自由基损伤、细胞毒性、线粒体通透性增加、细胞内钙超载等多种机制有关。研究发现抗炎和抗氧化药物均可以有效地保护脑缺血再灌注损伤[3-4]。目前临床上针对脑缺血再灌注损伤并没有特效药,故研究开发保护缺血性脑损伤的药物具有重要的理论意义和实用价值。近年来研究表明[5]许多中药有效成分在防治脑缺血再灌注损伤方面取得了较好的成效,可为临床上有效药物的开发提供方向。
鱼腥草为三白草科多年生草本植物蕺菜的新鲜全草或干燥地上部分。其主要成分为挥发油,具有抗氧化、抗炎、抗菌、抗病毒、抗肿瘤、增加免疫力等多种功效[6],提示鱼腥草挥发油可能对脑缺血再灌注损伤具有较好的保护作用。目前鱼腥草挥发油对脑缺血再灌注损伤的研究尚未见报道,本研究旨在探讨鱼腥草挥发油对脑缺血再灌注损伤的疗效及作用机制,为临床应用提供理论基础。
1 材料 1.1 动物SPF级C57BL/6小鼠120只,雌雄各半,体质量18~22 g,由山东省实验动物中心提供,动物合格证号:SCXK(鲁)20140006。
1.2 药物与试剂辛伐他汀片:规格20 mg/片,山东鲁抗医药集团赛特有限责任公司;鱼腥草:广东天泰药业有限公司;肿瘤坏死因子-α(TNF-α)、白介素-8(IL-8)ELISA检测试剂盒:博士德生物技术有限公司;超氧化物歧化酶(SOD)、丙二醛(MDA)检测试剂盒:南京建成股份有限公司;氯化三苯四氮唑(TTC):Sigma-Aldrich;栓线:广州佳灵生物技术有限公司。
1.3 仪器550酶标测定仪:日本Bio-red公司;旋转蒸发仪:上海亚荣生化仪器厂;Leica SM2010 R切片机:德国莱卡股份有限公司;体式显微镜:深圳市西派克光学仪器有限公司
1.4 方法 1.4.1 鱼腥草挥发油的提取参照文献[7]的方法提取鱼腥草挥发油,主要工艺条件如下:将干燥鱼腥草粉碎成粗粉,按料液比为1:10加入蒸馏水,于旋转蒸发仪中浸泡10 h,70 ℃加热回流10 h。
1.4.2 分组与给药动物适应性喂养7 d后随机分为假手术组、模型组、辛伐他汀阳性对照组,鱼腥草挥发油低剂量组,鱼腥草挥发油中剂量组,鱼腥草挥发油高剂量组,每组20只。于造模前连续灌胃给药14 d,辛伐他汀阳性对照组灌胃给药20 mg/(kg·d),鱼腥草挥发油低、中、高剂量组分别灌胃给药5、10、20 mg/(kg·d),假手术组、模型组灌胃给予等量生理盐水。
1.4.3 小鼠脑缺血(MCAO)模型的建立各组小鼠连续灌胃给药2周后,末次给药1 h后开始造模,4%异戊巴比妥钠腹腔麻醉小鼠,麻醉后仰卧固定于37 ℃恒温手术台上。按文献方法[8]建立小鼠MCAO模型,主要步骤如下:剃去颈部毛发、碘伏消毒,正中纵向切口长约2 cm,暴露和分离左侧颈总动脉,颈外动脉和颈内动脉,4-0号缝合线结扎颈外动脉,利用体式显微镜于颈总动脉近心端剪一小口,把包被硅胶的9 mm长尼龙线从颈总动脉剪口处插入小口向颈内动脉缓慢送入,略感到阻力后停止推进并固定栓线,即可堵塞大脑中动脉。缺血90 min后,轻轻抽出尼龙线,再灌注24 h,建立小鼠MCAO模型。
1.4.4 行为学评分行为学评分按照Longa等5分制法,于小鼠再灌注24 h后进行行为评分。主要评分方法如下:无精神损伤症状为0分; 不能完全伸展对侧前爪为1分;向对侧转圈为2分;向对侧倾倒为3分;不能自发行走,意识丧失为4分。
1.4.5 取材小鼠摘眼球取血,常温静置1 h后,3 000 r/min离心15 min,分离血清,-20 ℃保存,待测。小心取脑,于-20 ℃冰冻30 min,从额极向枕极作厚度为2 mm的冠状切片5片,置于1%TTC染色液中,37 ℃避光孵育30 min并扫描,应用Image-Pro Plus图像分析处理软件计算小鼠脑梗死率,梗死率=梗死面积/总面积×100%。10%中性甲醛固定脑组织,石蜡切片,苏木精-伊红(HE)染色,观察脑海马齿状回的形态学变化。称取脑组织湿质量,将脑组织放入恒温干燥箱(105 ℃)烤72 h,称取脑组织干质量,计算脑含水量,脑含水量(%)=(湿质量-干质量)/湿质量×100%。
1.4.6 生化指标检测采用ELISA双抗体夹心法检测血浆中TNF-α、IL-8含量;WST-1法检测SOD活性,TBA法检测MDA含量。实验操作均按照试剂盒说明书进行。
1.4.7 统计学方法采用SPSS 16.0软件进行统计学分析。计量资料用均数±标准差(x±s)表示,多组间均数比较采用单因素方差分析(one way ANOVA),组间两两比较若方差齐采用LSD检验,以P<0.05为差异有统计学意义。
2 结果 2.1 鱼腥草挥发油对小鼠MCAO行为学评分的影响见表 1。
| 分 | ||
| 组别 | 动物数 | 行为学评分 |
| 假手术组 | 10 | 0.00±0.00 |
| 模型组 | 10 | 3.42±0.54** |
| 辛伐他汀阳性对照组 | 10 | 2.72±0.75**# |
| 鱼腥草挥发油低剂量组 | 10 | 2.83±0.42**# |
| 鱼腥草挥发油中剂量组 | 10 | 2.28±0.25*## |
| 鱼腥草挥发油高剂量组 | 10 | 2.12±0.22*##△▲ |
| 注:与假手术组比较,*P < 0.05,**P < 0.01;与模型组比较,#P < 0.05,##P < 0.01;与辛伐他汀阳性对照组比较,△P < 0.05;与鱼腥草挥发油低剂量组比较,▲P < 0.05。 | ||
从表 1结果可见,与假手术组比较,各组小鼠行为学分数均显著升高(P < 0.05)。与模型组比较,辛伐他汀组、鱼腥草挥发油低、中、高剂量组行为学分数均显著降低(P < 0.05)。与辛伐他汀组比较,鱼腥草挥发油高剂量组小鼠行为学分数显著降低(P < 0.05)。与鱼腥草挥发油低剂量组比较,鱼腥草挥发油高剂量组小鼠行为学分数显著降低(P < 0.05)。
2.2 鱼腥草挥发油对小鼠MCAO梗死率的影响从图 1和图 2结果可见,与假手术组比较,各组小鼠脑梗死率均明显升高(P < 0.01)。与模型组比较,辛伐他汀组、鱼腥草挥发油低、中、高剂量组小鼠脑梗死率均显著降低(P < 0.01)。与辛伐他汀组比较,鱼腥草挥发油高剂量组小鼠脑梗死率显著降低(P < 0.05)。与鱼腥草挥发油低剂量组比较,鱼腥草挥发油高剂量组小鼠脑梗死率显著降低(P < 0.05)。
|
| 图 1 各组小鼠脑梗死面积观察 Fig. 1 Observation of cerebral infarction area in various groups |
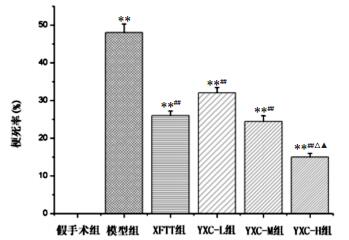
|
| 图 2 各组小鼠脑梗死率观察 Fig. 2 Observation of cerebral infarction rate in various groups XFTT组:辛伐他汀阳性对照组,YXC-L组:鱼腥草挥发油低剂量组,YXC-M组:鱼腥草挥发油中剂量组,YXC-H组:鱼腥草挥发油高剂量组。与假手术组比较,**P < 0.01;与模型组比较,##P < 0.01;与辛伐他汀阳性对照组比较,△P < 0.05;与鱼腥草挥发油低剂量组比较,▲P < 0.05。 |
从图 3结果可见,假手术组小鼠海马齿状回神经元细胞层数多,饱满,胞核为圆形或椭圆形,核浆比值大,可见深染的核仁。模型组小鼠海马齿状回神经元细胞层次明显减少,胞体缩小,胞浆浓缩,核仁着色不明显。与模型组比较,辛伐他汀组和鱼腥草给药组神经细胞排列较紧密,着色较均匀,胞质浓染神经元明显减少,而且鱼腥草给药组药效具有剂量依赖性。

|
| 图 3 各组小鼠脑海马齿状回观察 Fig. 3 Observation of hippocampal dentate gyrus in various groups 其中A为假手术组,B为模型组,C为辛伐他汀阳性对照组,D为鱼腥草挥发油低剂量组,E为鱼腥草挥发油中剂量组,F为鱼腥草挥发油高剂量组,HE染色,×20 |
从图 4结果可见,与假手术组比较,各组小鼠脑含水量均明显升高(P < 0.01)。与模型组比较,辛伐他汀阳性对照组、鱼腥草挥发油低、中、高剂量组小鼠脑含水量均显著降低(P < 0.01)。与辛伐他汀阳性对照组比较,鱼腥草挥发油高剂量组小鼠脑含水量显著降低(P < 0.01)。与鱼腥草挥发油低剂量组比较,鱼腥草挥发油高剂量组小鼠脑含水量显著降低(P < 0.01)。
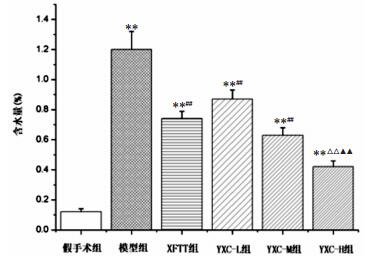
|
| 图 4 各组小鼠脑含水量观察 Fig. 4 Observation of cerebral water content in various groups XFTT组:辛伐他汀阳性对照组,YXC-L组:鱼腥草挥发油低剂量组,YXC-M组:鱼腥草挥发油中剂量组,YXC-H组:鱼腥草挥发油高剂量组。与假手术组比较,**P < 0.01;与模型组比较,##P < 0.01;与辛伐他汀阳性对照组比较,△△P < 0.01;与鱼腥草挥发油低剂量组比较,▲▲P < 0.01。 |
从表 2结果可见,与假手术组比较,模型组、辛伐他汀阳性对照组、鱼腥草挥发油低、中剂量组小鼠血清TNF-α和IL-8含量均明显升高(P < 0.01)。与模型组比较,辛伐他汀阳性对照组、鱼腥草挥发油低、中、高剂量组小鼠血清TNF-α和IL-8含量均显著降低(P < 0.05)。与辛伐他汀阳性对照组比较,鱼腥草挥发油高剂量组小鼠血清TNF-α和IL-8含量均显著降低(P < 0.01)。与鱼腥草挥发油低剂量组比较,鱼腥草挥发油高剂量组小鼠血浆TNF-α和IL-8含量均显著降低(P < 0.01)。
| pg/mL | |||
| 组别 | 动物数 | TNF-α | IL-8 |
| 假手术组 | 10 | 5.52±0.23 | 6.28±0.69 |
| 模型组 | 10 | 19.28±1.71** | 22.23±1.45** |
| 辛伐他汀阳性对照组 | 10 | 13.84±1.39**# | 14.45±1.41**# |
| 鱼腥草挥发油低剂量组 | 10 | 15.24±1.56**# | 19.22±1.31**## |
| 鱼腥草挥发油中剂量组 | 10 | 12.31±1.74**## | 14.80±1.52**# |
| 鱼腥草挥发油高剂量组 | 10 | 9.32±1.33##△△▲▲ | 9.99±1.25##△△▲▲ |
| 注:与假手术组比较,*P < 0.05,**P < 0.01;与模型组比较,#P < 0.05,##P < 0.01;与辛伐他汀阳性对照组比较,△△P < 0.01;与鱼腥草挥发油低剂量组比较,▲P < 0.05,▲▲P < 0.01。 | |||
从表 3结果可见,与假手术组比较,模型组、辛伐他汀阳性对照组、鱼腥草挥发油低、中剂量组小鼠血清SOD活性显著降低(P < 0.01),MDA含量显著升高(P < 0.01)。与模型组比较,辛伐他汀阳性对照组、鱼腥草挥发油低、中、高剂量组小鼠血清SOD活性显著升高(P < 0.05),MDA含量显著降低(P < 0.05)。与辛伐他汀阳性对照组比较,鱼腥草挥发油高剂量组小鼠血清SOD活性显著升高(P < 0.01),MDA含量显著降低(P < 0.01)。与鱼腥草挥发油低剂量组比较,鱼腥草挥发油高剂量组小鼠血清SOD活性显著升高(P < 0.01),MDA含量显著降低(P < 0.01)。
| 组别 | 动物数 | SOD(U/mL) | MDA (μmol/L) |
| 假手术组 | 10 | 175.22±5.77 | 8.84±1.32 |
| 模型组 | 10 | 82.20±4.78** | 22.18±3.74** |
| 辛伐他汀阳性对照组 | 10 | 104.84±5.97**# | 17.24±1.53**# |
| 鱼腥草挥发油低剂量组 | 10 | 99.75±5.36**# | 19.25±1.22**# |
| 鱼腥草挥发油中剂量组 | 10 | 135.26±3.76**## | 15.12±1.78**## |
| 鱼腥草挥发油高剂量组 | 10 | 156.94±3.78##△△▲▲ | 12.36±1.37##△△▲▲ |
| 注:与假手术组比较,**P < 0.01;与模型组比较,#P < 0.05,##P < 0.01;与辛伐他汀阳性对照组比较,△△P < 0.01;与鱼腥草挥发油低剂量组比较,▲▲P < 0.01。 | |||
缺血性脑卒中是一类由脑血流供应障碍导致的脑组织缺血、缺氧,继而引发局灶性脑组织缺血性损伤或坏死的多发中枢神经系统病变。而目前临床上治疗缺血性脑卒中的唯一有效方法为快速恢复血流[2],但再灌注后反而进一步加剧脑损伤即脑缺血再灌注损伤。其致病机制较为复杂,目前尚没完全阐明,其中炎症和氧化损伤是造成脑缺血再灌注损害的重要机制[3-4]。辛伐他汀为半合成他汀类药物,近年来研究发现[9]辛伐他汀除调血脂作用外,还具有其他方面的作用,如抗炎、抗氧化等作用。在缺血性卒中、多发性硬化、Alzheimer病等神经系统疾病中有广泛神经保护作用[10]。而且通过对多种他汀类药物的比较发现,辛伐他汀脂溶性较高,易穿过血-脑屏障且对脑缺血损伤的保护作用最好[11],故本研究以辛伐他汀作为阳性对照药。
本研究发现与假手术组比较,模型组小鼠行为学评分和脑梗死率明显升高(P < 0.01),表明模型组脑缺血再灌注损伤严重,提示造模成功。鱼腥草挥发油低、中、高剂量组小鼠行为学评分和脑梗死率明显降低(P < 0.05),表明鱼腥草挥发油低、中、高剂量组可有效改善行为学和脑神经细胞坏死,从而减轻脑缺血再灌注损伤。辛伐他汀阳性对照组小鼠也可降低行为学评分和脑梗死率(P < 0.05),但效果不及鱼腥草挥发油高剂量组。病理组织学结果也显示鱼腥草挥发油能明显改善脑脑海马齿状回神经元结构的形态学变化,与上述指标相一致。脑水含量是衡量脑缺血再灌注损伤进程中的脑水肿严重程度的一个指标,也是评价抗缺血性脑损伤药物的重要指标之一[12]。本研究法发现鱼腥草给药组小鼠明显减轻脑水肿程度(P < 0.01),且呈剂量依赖性。而辛伐他汀阳性对照组也明显减轻脑水肿程度(P < 0.01)。TNF-α与IL-8具有多种生物效应的细胞炎症因子,参与多种组织再灌注损伤,两者含量高低可反映炎症严重程度。本研究发现与假手术组比较,模型组小鼠TNF-α和IL-8含量显著升高(P < 0.01),而给予鱼腥草挥发油可显著降低血清TNF-α和IL-8含量(P < 0.05),且呈剂量依赖性,表明鱼腥草挥发油低、中、高剂量组可明显减轻脑缺血再灌注损伤所致的炎症。辛伐他汀阳性对照组也可降低血清TNF-α和IL-8含量(P < 0.05),但效果不及鱼腥草挥发油高剂量组。而SOD与MDA是反映机体自由基的清除能力及氧化应激的损伤程度的重要指标。本研究发现与假手术组比较,模型组小鼠血清SOD活性显著升高(P < 0.01),MDA含量显著降低(P < 0.01),给予鱼腥草挥发油可显著升高血清SOD活性(P < 0.05),降低MDA含量(P < 0.05),且呈剂量依赖性,表明鱼腥草挥发油低、中、高剂量组可明显减轻氧化应激损伤。辛伐他汀阳性对照组也可升高血清SOD活性(P < 0.05),降低MDA含量(P < 0.05),但效果不及鱼腥草挥发油高剂量组。
综上所述,鱼腥草挥发油对脑缺血再灌注损伤具有较好的保护作用,其作用机制可能是通过减轻炎症和抗过氧化损伤而改善症状,其可为临床抗脑缺血再灌注损伤新药研究开发提供部分实验依据。
| [1] | 中华医学会神经病学分会脑血管病学组急性缺血性脑卒中诊治指南撰写组. 中国急性缺血性脑卒中诊治指南2010[J]. 中国临床医生, 2011, 39 (3): 67–73. |
| [2] | Maria-Giulia Perrelli, Francesca Tullio, Carmelina Angotti, et al. Catestatin reduces myocard ial ischaemia/reperfusion injury:involvement of PI3K/Akt, PKCs, mitochondria l KATP channels and ROS signalling[J]. Pflugers Arch, 2013, 465 (7): 1031–1040. DOI:10.1007/s00424-013-1217-0 |
| [3] | Kang C, Cho W, Park M, et al. H2O2-triggered bubble generating antioxidant polymeric nanoparticles as ischemia/reperfusion targeted nanotheranostics[J]. Biomaterials, 2016, 85 (2016): 195–203. |
| [4] | Surapaneni S, Prakash T, Ansari M, et al. Study on cerebroprotective actions of Clerodendron glandulosumleaves extract against long term bilateral common carotid artery occlusion in rats[J]. Biomed Pharmacother, 2016, 80 (2016): 87–94. |
| [5] | 李路迢, 刘旺华. 中医药治疗脑缺血再灌注损伤的研究进展[J]. 湖南中医杂志, 2016, 32 (10): 193–196. |
| [6] | 孙谦, 胡中海, 孙志高, 等. 鱼腥草的生物活性及其机理研究进展[J]. 食品科学, 2014, 35 (23): 354–358. DOI:10.7506/spkx1002-6630-201423068 |
| [7] | 张壮丽, 赵宁, 赵志鸿, 等. 鱼腥草挥发油提取工艺优化[J]. 中国医药科学, 2015, 5 (1): 82–85. |
| [8] | Arjun Sapkota1, Bhakta Prasad Gaire1, Kyu Suk Cho, et al. Eupatilin exerts neuroprotective effects in mice with transient focal cerebral ischemia by reducing microglial activation[J]. PLOS ONE, 2017, 12 (2): e0171479. DOI:10.1371/journal.pone.0171479 |
| [9] | 陈冠容. 辛伐他汀的药理作用及临床新用途[J]. 老药新用, 2007, 23 (4): 20–21. |
| [10] | 王柏欣, 王昕, 邱洪斌, 等. 辛伐他汀对大鼠脑缺血再灌注损伤细胞凋亡的影响[J]. 中国老年学杂志, 2011, 31 (10): 1826–1829. DOI:10.3969/j.issn.1005-9202.2011.10.050 |
| [11] | Sierra S, Ramos MC, Molina P, et al. Statins as neuroprotectants:a comparative in vitro study of lipophilicity, blood-brain-barrier penetration, lowering of brain cholesterol, and decrease of neuron cell death[J]. J Alzheimers Dis, 2011, 23 (2): 307–318. |
| [12] | Huang P, Zhou CM, Hu Q, et al. Cerebral care Granule attenuates blood-brain barrier disruption after middle cerebral artery occlusion in rats[J]. Exp Neurol, 2012, 237 (2012): 453–463. |
2. Guangzhou Darui Biotechnology Co., Ltd., Guangzhou 510665, China
 2018, Vol. 35
2018, Vol. 35