文章信息
- 朱瑞超, 逯彬, 罗蓉, 李晋, 何俊, 王涛, 李转爱, 常艳旭
- ZHU Ruichao, LU Bin, LUO rong, LI Jin, HE Jun, WANG Tao, LI Zhuan'ai, CHANG Yanxu
- 桑叶7种黄酮类成分同时测定及其抑制α-糖苷酶活性的研究
- Study on relation of seven flavonoids from mulberry leafs and their inhibition of α-glucosidase activities
- 天津中医药, 2018, 35(4): 302-306
- Tianjin Journal of Traditional Chinese Medicine, 2018, 35(4): 302-306
- http://dx.doi.org/10.11656/j.issn.1672-1519.2018.04.17
-
文章历史
- 收稿日期: 2017-11-25
2. 天津中医药大学中药学院, 天津 300193
桑叶为桑科植物(Morus alba L.)的干燥叶,具有疏散风热,清肺润燥,清肝明目的功效。现代药理研究表明,桑叶具有明显的降血糖功效[1]。研究表明桑叶中的降糖活性成分主要有生物碱、多糖、黄酮类成分,其中DNJ(1-脱氧野尻霉素)是其主要降糖活性成分[2-4],但其中的黄酮类成分也具有较好的降糖活性。有研究表明芦丁[5-8]、槲皮素等具有潜在的抑制α-糖苷酶活性[9-10]。
就桑叶而言,采收期不同,药材各组分含量差异也较大[11-13]。自古以来桑叶的采集时间习惯在秋季霜降后采收,历来多认为桑叶以老而经霜者为佳,故入药用多为冬桑叶,亦称“霜桑叶”或“经霜桑叶”。因此,本文在此基础上,将α-糖苷酶抑制活性与其总指标成分含量相衔接,设计了基于α-糖苷酶抑制活性对桑叶中7种黄酮类成分的含量测定,并基于桑叶经霜采收的临床习惯对不同产地及不同采收期的桑叶进行含量测定与活性的对比研究,拟为桑叶“经霜为上”的科学内涵的阐明,桑叶临床用药提供依据。
1 仪器与材料Agilent 1200高效液相色谱系统(美国Agilent公司);超纯水器(Millipore公司,Mill-QⅡ型);万分之一天平(德国Sartorius公司,AX205);旋涡混合器(上海沪西分析仪器厂,XW-80A);离心机(Sigma 3k15);多功能微孔读板机(Molecular Devices);孵育箱(Shel lab Model 1012 hybrdization oven);pH计(FiveEasyTM,Mettler Toledo);96孔酶标板(Corning)。
色谱纯乙腈购于Merck公司(德国);色谱纯甲醇购于Fisher公司(美国);色谱纯甲酸购于Tedia公司(美国);实验用水为Milli-Q超纯水;分析纯甲醇购于天津市康科德科技有限公司;分析纯磷酸二氢钠、磷酸氢二钠皆购于天津光复精选化工研究所。
芦丁对照品、山奈酚对照品、紫云英苷对照品、异槲皮苷对照品、隐绿原酸对照品、桑皮苷A对照品均购于成都曼斯特生物科技有限公司;槲皮素对照品和阿卡波糖购于中国药品生物制品检定所;对硝基苯-α-D-吡喃半乳糖购于美国sigma-Alorich公司;各对照品纯度均大于98%。α-糖苷酶:EC:3.2.1.20,规格:50.95 U/mg,购于上海亿欣生物技术有限公司。采集10批不同产地相同采收期霜桑叶100 g;不同采收时期的桑叶为采自天津中医药大学校园同一棵树的不同日期的树叶,每次采集100 g,经常艳旭研究员鉴定为桑科植物桑Morus alba L.的叶,常温阴干后粉碎过100目筛、备用。
2 方法 2.1 色谱条件色谱柱为WELCH Ultimate XB-C18柱(4.6 mm×250 mm,5 μm);流动相为0.1%甲酸水溶液(A)-乙腈(B);梯度洗脱条件为0~5 min,95%~88%A;5~11min,88%~87%A;11~21,87%~85%A;21~22 min,85%A;22~32 min,85%~84%A;32~39 min,84%A;39~41 min,84%~83%A;41~50 min,83%A;50~51 min,83%~82%A;51~61 min,82%A;61~69 min,82%~79%A;69~73 min,79%A;73~77 min,79%~78%A;77~78 min,78%A;78~86 min,78%~72%A;86~88 min,72%~68%A;88~92 min,68%~65% A;92~102 min,65%~62% A;流速为1 mL/min;检测波长:365 nm;柱温:30 ℃;进样量:15 μL。
2.2 对照品溶液的制备精密称取隐绿原酸、芦丁、槲皮素、山奈酚、异槲皮苷、紫云英苷、桑皮苷A对照品各适量,加纯甲醇溶解,配制成浓度为1 mg/mL的对照品溶液。
2.3 供试品溶液的制备精密称取0.500 g桑叶粉末,加80%的甲醇于10 mL容量瓶中(料液比1:20),于37 ℃超声30 min,静置放冷,加80%甲醇补足至刻度,摇匀,14 000 rpm离心10 min,过滤,取上清液作为样品溶液,置4 ℃冰箱中保存备用。
2.4 α-糖苷酶抑制活性测定采用文献报道[14]的方法配置底物溶液和酶溶液,检测不同产地、不同生长期样品供试液及各单体化合物对α-糖苷酶活性的影响。本实验在96孔板上进行,设4个组,每个组3个复孔,分别为样品空白组(Asb)、空白对照组(As)、样品测定组(Acb)、对照组(Ac)。在样品测定组中,先加入20 μL缓冲溶液和20 μL样品溶液,再加入20 μL底物溶液,混匀后,加入20 μL酶溶液,振摇1 min,37 ℃下孵育15 min,加入0.2M碳酸钠溶液终止酶反应,在酶标仪检测波长405 nm下,测定吸光度值。样品对α-糖苷酶抑制率按下公式计算:抑制率=[(Ac-Acb)-(As-Asb)]/(Ac-Acb)×100%,计算IC50。
3 结果与讨论 3.1 桑叶提取方法的优化本研究首先采用单因素分析方法,考察了提取溶剂(40%、60%、80%、100%甲醇),超声时间(10、20、30、40 min),物料比(1:5、1:10、1:15、1:20)对7种黄酮成分的提取的影响,确定提取溶剂为60%甲醇,超声40 min、物料比为1:20时最好。在此基础上设计了提取溶剂(60%、70%、80%);超声时间(20、30、40 min);物料比(1:10、1:15、1:20)的三因素三水平正交实验,以7种黄酮成分的总量为指标,并根据正交设计软件采用L9(34)正交表设计正交实验。结果显示,方差分析F检验中3个因素时总量的影响都不显著,因而采用直观分析确定最佳条件,确定最佳的提取条件为:提取溶剂80%,超声时间30 min,物料比1:10。见表 1。
| 因素 | 提取溶剂(%) | 超声时间(min) | 物料比(g/mL) | 总含量(%) |
| 实验1 | 60 | 20 | 1:10 | 0.106 |
| 实验2 | 60 | 30 | 1:15 | 0.106 |
| 实验3 | 60 | 40 | 1 :20 | 0.127 |
| 实验4 | 70 | 20 | 1 :20 | 0.153 |
| 实验5 | 70 | 30 | 1:10 | 0.063 |
| 实验6 | 70 | 40 | 1:15 | 0.117 |
| 实验7 | 80 | 20 | 1:15 | 0.083 |
| 实验8 | 80 | 30 | 1 :20 | 0.196 |
| 实验9 | 80 | 40 | 1:10 | 0.063 |
| 均值1 | 0.113 | 0.114 | 0.140 | |
| 均值2 | 0.111 | 0.122 | 0.107 | |
| 均值3 | 0.114 | 0.102 | 0.091 | |
| 极差 | 0.003 | 0.020 | 0.049 |
方差分析结果显示物料比、超声时间及提取溶剂对本实验评价指标无显著性差异。物料比1:20时提取相对完全,故本实验采用提取溶剂80%,超声时间30 min和物料比为1:20进行样品制备。见表 2。
| 因素 | 偏差平方和 | 自由度 | F比 | F临界值 | 显著性 |
| 提取溶剂 | 0.000 | 2 | 0.000 | 19 | 1.000 |
| 超声时间 | 0.001 | 2 | 0.100 | 19 | 1.000 |
| 物料比 | 0.004 | 2 | 0.400 | 19 | 1.000 |
| 误差 | 0.01 | 2 |
将上述对照品储备液以甲醇稀释,得浓度分别为芦丁500 μg/mL,槲皮素10 μg/mL,山奈酚10 μg/mL,紫云英苷300 μg/mL;异槲皮苷500 μg/mL;桑皮苷A 100 μg/mL;隐绿原酸200 μg/mL的混合对照品溶液,并将混合对照品液稀释至不同浓度,注入色谱仪,记录峰面积,以混合对照品液中各成分浓度为横坐标(X)、峰面积为纵坐标(Y),绘制标准曲线,求得线性回归方程及线性范围,见表 3。结果表明各对照品在各自的浓度范围内线性关系良好。
| 成分 | 标准曲线 | 线性范围(μg/mL) | R2 |
| 桑皮苷A | 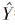 =3.7708X-6.6381 =3.7708X-6.6381 |
0.8~50 | 0.998 8 |
| 隐绿原酸 | 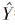 =12.368X-52.329 =12.368X-52.329 |
1.6~100 | 0.998 9 |
| 芦丁 | 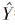 =77.718X-591.91 =77.718X-591.91 |
4~250 | 0.998 1 |
| 异槲皮苷 | 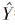 =87.406X-833.33 =87.406X-833.33 |
10~250 | 0.998 9 |
| 紫云英苷 | 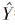 =54.939X-252.03 =54.939X-252.03 |
2.4~150 | 0.998 2 |
| 槲皮素 | 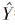 =272.34X-61.304 =272.34X-61.304 |
0.2~5 | 0.999 0 |
| 山奈酚 | 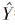 =97.026X-19.504 =97.026X-19.504 |
0.16~5 | 0.999 0 |
同一供试品溶液,连续进样6次,以对照品峰面积进行计算,桑皮苷A,隐绿原酸,芦丁,异槲皮苷,紫云英苷,槲皮素,山奈酚峰面积的RSD值分别为1.11%,2.32%,0.48%,0.8%,2.17%,0.66%和1.12%,结果表明精密度较好。
3.2.3 重复性制备6份同一批次桑叶样品供试品溶液,进样分析,记录峰面积,计算峰7个化合物峰面积的RSD值,结果表明桑皮苷A,隐绿原酸,芦丁,异槲皮苷,紫云英苷,槲皮素,山奈酚峰面积的RSD值分别为2.27%,0.35%,0.12%,1.84%,0.85%,0.57%,0.76%,表明所建立的分析方法重复性较好。
3.2.4 稳定性取同一批次的桑叶供试品溶液分别在0、2、4、6、8、12、24 h进样分析,记录峰面积,计算峰面积的RSD值。桑皮苷A,隐绿原酸,芦丁,异槲皮苷,紫云英苷,槲皮素,山奈酚峰面积的RSD分别为1.22%,0.4%,0.51%,0.76%,1.2%,0.29%,1.51%,表明样品溶液在24 h内稳定性良好。
3.2.5 加样回收率精称取已知含量的桑叶药材0.25 g,分别精密加入等质量的7种标准品,按照样品制备方法制备,计算方法提取回收率。桑皮苷A,隐绿原酸,芦丁,异槲皮苷,紫云英苷,槲皮素,山奈酚的平均回收率分别为99.3%,91.0%,91.1%,90.8%,100%,102%,100%。RSD值分别为2.55%,3.25%,0.730%,0.950%,2.62%,2.36%,0.950%。上述结果表明,该方法可用于桑叶中7种化合物的提取。
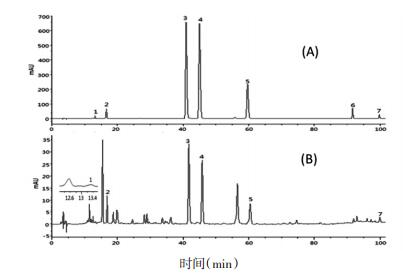
3.3 样品含量及抑制α-糖苷酶测定精密称取不同产地、物候期桑叶样品,制备供试品溶液,利用所建立的分析方法对桑叶样品进行了分析,测定桑叶中桑皮苷、隐绿原酸、芦丁、异槲皮苷、紫云英苷、槲皮素和山奈酚含量,结果见表 4和表 5。典型7种混合标准品和桑叶样品色谱图如图 1所示。
| 产地 | 桑皮苷A(%) | 隐绿原酸(%) | 芦丁(%) | 异槲皮苷(%) | 紫云英苷(%) | 槲皮素(%) | 山奈酚(%) | 总含量(%) | 1/IC50(mL/g) |
| 四川 | 0.008 56 | 0.017 5 | 0.025 1 | 0.039 2 | 0.023 7 | 0.000 520 | 0.000 480 | 0.115 | 439.75 |
| 安徽 | 0.005 38 | 0.035 2 | 0.021 7 | 0.021 6 | 0.011 9 | 0.000 540 | 0.000 580 | 0.097 0 | 397.61 |
| 福建 | 0.005 32 | 0.019 4 | 0.022 7 | 0.034 0 | 0.017 8 | 0.000 720 | 0.000 440 | 0.100 | 446.63 |
| 云南 | 0.017 20 | 0.020 2 | 0.038 4 | 0.078 9 | 0.036 4 | 0.000 540 | 0.001 34 | 0.193 | 884.17 |
| 和州 | 0.004 52 | 0.009 54 | 0.015 9 | 0.020 4 | 0.0101 | 0.000 900 | 0.000 580 | 0.061 9 | 137.78 |
| 广东 | 0.004 74 | 0.048 3 | 0.039 2 | 0.034 4 | 0.019 1 | 0.000 600 | 0.001 06 | 0.147 | 639.39 |
| 贵州 | 0.011 30 | 0.014 6 | 0.024 2 | 0.041 4 | 0.023 1 | 0.000 780 | 0.001 16 | 0.117 | 574.05 |
| 山东 | 0.004 36 | 0.008 80 | 0.015 4 | 0.020 3 | 0.0101 | 0.000 480 | 0.000 520 | 0.059 9 | 196.54 |
| 河北 | 0.009 46 | 0.017 1 | 0.028 4 | 0.049 5 | 0.026 1 | 0.000 620 | 0.000 860 | 0.132 | 363.24 |
| 湖北 | 0.006 06 | 0.009 02 | 0.0165 | 0.024 6 | 0.012 9 | 0.000 480 | 0.000 500 | 0.070 1 | 241.14 |
| 日期 | 桑皮苷A(%) | 隐绿原酸(%) | 芦丁(%) | 异槲皮苷(%) | 紫云英苷(%) | 槲皮素(%) | 山奈酚(%) | 总含量(%) | 1/IC50(mL/g) |
| 4.10 | 0.008 14 | 0.068 9 | 0.0695 | 0.088 4 | 0.023 4 | 0.000 560 | 0.000 640 | 0.260 | 449.24 |
| 4.19 | 0.006 86 | 0.088 2 | 0.0491 | 0.060 3 | 0.026 2 | 0.000 500 | 0.000 640 | 0.232 | 754.72 |
| 4.25 | 0.008 30 | 0.156 0 | 0.0455 | 0.044 8 | 0.025 6 | 0.000 600 | 0.001 080 | 0.282 | 2664.5 |
| 4.30 | 0.005 00 | 0.047 9 | 0.0234 | 0.027 8 | 0.0142 | 0.000 520 | 0.000 720 | 0.120 | 577.03 |
| 5.06 | 0.007 12 | 0.137 0 | 0.0389 | 0.039 9 | 0.022 6 | 0.000 700 | 0.001 100 | 0.248 | 2931.7 |
| 5.13 | 0.005 38 | 0.132 0 | 0.0289 | 0.024 7 | 0.019 8 | 0.000 580 | 0.000 940 | 0.212 | 2324.0 |
| 5.25 | 0.004 90 | 0.093 8 | 0.0256 | 0.023 3 | 0.0167 | 0.000 600 | 0.000 900 | 0.166 | 661.81 |
| 6.26 | 0.008 40 | 0.112 0 | 0.0251 | 0.025 5 | 0.019 1 | 0.000 760 | 0.001 200 | 0.192 | 1588.8 |
| 7.25 | 0.007 56 | 0.058 1 | 0.0201 | 0.022 5 | 0.013 0 | 0.000 480 | 0.000 680 | 0.122 | 421.94 |
| 8.25 | 0.0102 | 0.062 0 | 0.0233 | 0.036 6 | 0.018 3 | 0.000 500 | 0.000 680 | 0.152 | 159.90 |
| 9.25 | 0.0125 | 0.047 4 | 0.0218 | 0.048 4 | 0.027 7 | 0.000 580 | 0.000 500 | 0.159 | 338.29 |
| 10.11 | 0.023 7 | 0.033 9 | 0.0275 | 0.107 0 | 0.065 0 | 0.000 560 | 0.000 480 | 0.258 | 528.82 |
| 10.17 | 0.022 0 | 0.035 4 | 0.0259 | 0.111 0 | 0.069 8 | 0.000 580 | 0.000 520 | 0.265 | 142.33 |
| 10.28 | 0.015 8 | 0.020 5 | 0.0204 | 0.068 6 | 0.042 5 | 0.000 540 | 0.000 700 | 0.169 | 112.17 |
| 11.01 | 0.011 6 | 0.036 5 | 0.0211 | 0.062 6 | 0.036 0 | 0.000 580 | 0.000 720 | 0.169 | 136.24 |
| 11.04 | 0.011 4 | 0.032 6 | 0.0211 | 0.048 0 | 0.028 4 | 0.000 560 | 0.000 500 | 0.143 | 208.03 |
| 11.07 | 0.008 46 | 0.025 1 | 0.0199 | 0.055 2 | 0.031 4 | 0.000 560 | 0.000 500 | 0.141 | 144.45 |
| 11.01 | 0.013 4 | 0.022 0 | 0.0217 | 0.057 2 | 0.036 4 | 0.000 460 | 0.000 540 | 0.152 | 140.53 |
| 11.13 | 0.011 4 | 0.037 0 | 0.0192 | 0.030 4 | 0.0161 | 0.001 200 | 0.000 520 | 0.116 | 133.46 |
| 11.02 | 0.009 62 | 0.021 1 | 0.0177 | 0.025 6 | 0.0126 | 0.000 480 | 0.000 520 | 0.0876 | 218.48 |
| 11.23 | 0.008 24 | 0.023 2 | 0.0188 | 0.027 5 | 0.013 5 | 0.000 480 | 0.000 480 | 0.0922 | 121.62 |
|
| 图 1 混合对照品色谱图(A)和样品色谱图(B) Fig. 1 HPLC chromatograms of mixed reference substances (A) and samples (B) 1.桑皮苷A; 2.隐绿原酸; 3.芦丁; 4.异槲皮苷; 5.紫云英苷; 6.槲皮素; 7.山奈酚 |
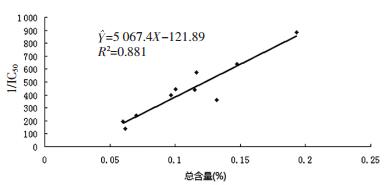
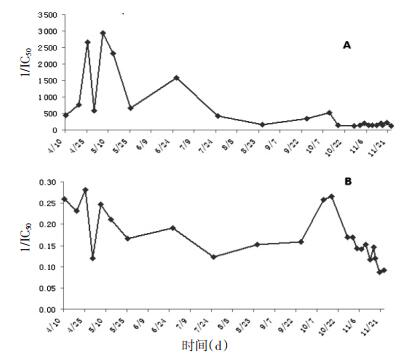
从表 4和表 5可知,不同采收期及不同产地样品间7种成分含量有较大差异。其中,云南产地的桑叶样品7种成分总含量较高。不同产地桑叶样品7种黄酮类成分总含量与其α-糖苷酶抑制活性基本呈正相关关系(图 2),提示可以采用7种黄酮类成分作为桑叶降糖活性的评价指标,其总含量越高,α-糖苷酶抑制活性越强;研究结果表明不同采收时期的桑叶样品中7种黄酮类成分与α-糖苷酶抑制活性相关性较差,可能与不同时期的桑叶中化学成分组成变化有关。结合天津市气候特点,可以把所采集的样品分为3个时期,10.11-10.28为霜降期,而4.10-10.11为霜降前期、10.28-11.23为霜降后期。发现桑叶7种黄酮类成分总含量及α-糖苷酶抑制活性在霜降前期和后期均呈现下降的趋势,不同采收期桑叶的7种黄酮类成分总含量变化规律为霜降>霜前>霜后(图 3B);α-糖苷酶抑制活性变化规律为霜前>霜降>霜后(图 3A)。从表 5可知,尽管在4月份桑叶其7种黄酮类成分高于霜降时期,但其桑叶产量较低,而霜降期桑叶产量较高,推测可能是古人选择了霜降为桑叶最佳采收期的原因。本研究为初步探索桑叶“经霜者为佳”科学内涵、资源开发利用、质量标准的建立提供科学依据。
|
| 图 2 不同产地桑叶样品α-糖苷酶抑制活性与7种黄酮类成分总含量 Fig. 2 Relation of α-glucosidase inhibitory activity (1/IC50) and total content of 7 flavonoids of mulberry leaf from different areas |
|
| 图 3 不同采收期桑叶样品α-糖苷酶抑制活性及7种黄酮类成分总含量变化规律 Fig. 3 Change of α-glucosidase inhibitory activity and total content of 7 flavonoids of mulberry leaf from different collected times A.不同采收期桑叶样品α-糖苷酶抑制活性(1/IC50);B.不同采收期桑叶样品7种黄酮类成分总含量(%) |
本研究建立了桑叶中桑皮苷A、隐绿原酸、芦丁、异槲皮苷、紫云英苷、槲皮素和山奈酚7种黄酮类成分同时测定HPLC方法,发现不同产地桑叶7种黄酮类成分总含量与其α-糖苷酶抑制活性呈正相关关系;通过不同物候期的桑叶化学成分及降糖活性研究,发现7种黄酮类成分总含量及α-糖苷酶抑制活性在霜降前期和后期均呈现下降的趋势,而在霜降时期桑叶化学成分及降糖活性均较高,从化学成分和活性两个角度为初步阐释桑叶“经霜为上”的科学内涵、桑叶的临床应用、质量控制及桑叶资源的二次开发提供参考。
| [1] | 国家药典委员会编. 中华人民共和国药典(第一部)[S]. 北京: 中国医药科技出版社, 2015: 297-298. |
| [2] | Mathieu B, Willy S. The antiglycogenolytic action of 1-deoxynojirimycin results from a specific inhibition of the α-l, 6-glucosidase activity of the debranching enzyme[J]. Eur J Biochem, 1989, 181 : 775–780. DOI:10.1111/ejb.1989.181.issue-3 |
| [3] | Do HJ, Chung JH, Hwang JW, et al. 1-Deoxynojirimycin isolated from Bacillus subtilis improves hepatic lipid metabolism and mitochondrial function in high-fat-fed mice[J]. Food Chem Toxicol, 2015 (75): 1–7. |
| [4] | Zhang YL, Gao HL, Liu RJ, et al. Quinazoline-1-deoxynojirimycin hybrids as high active dual inhibitors of EGFR and α-glucosidase[J]. Bioorg Med Chem Lett, 2017 (27): 4309–4313. |
| [5] | Jadhav R, Puchchakayala G. Hypoglycemic and antidiabetic activity of flavonoids:boswellic acid, ellagic acid, quercetin, rutin on streptozotocin-nicotinamide induced type 2 diabetic rats[J]. Int J Pharm Pharm Sci, 2012, 4 (2): 251–256. |
| [6] | Ahmed OM, Moneim AA, Yazid IA, et al. Antihyperglycemic, antihyperlipidemic and antioxidant effects and the probable mechanisms of action of Ruta graveolens infusion and rutin in nicotinamide-streptozotocin-induced diabetic rats[J]. Diabetol Croat, 2010, 39 (1): 15–35. |
| [7] | Li YQ, Zhou FC, Gao F, et al. Comparative evaluation of quercetin, isoquercetin and rutin as inhibitors of α-glucosidase[J]. J Agric Food Chem, 2009, 57 (24): 11463–11468. DOI:10.1021/jf903083h |
| [8] | Bais S, Shrirao S, Jiddewar A, et al. Evaluation of effect of rutin in diabetes rat gastropathy[J]. Int J Pharm Phytopharmacol Res, 2017, 1 (6): 363–366. |
| [9] | Srinivasan P, Subramaniyan V, Kothandaraman S, et al. Anti-diabetic activity of quercetin extracted from Phyllanthus emblica L. fruit:In silico and in vivo approaches[J]. J Pharm Anal, 2017 : 10. |
| [10] | Dechandt CRP, Siqueira JT, Souza DLPD, et al. Combretum lanceolatum flowers extract shows antidiabetic activity through activation of AMPK by quercetin[J]. Rev Bras Farmacog, 2013, 23 (2): 291–300. DOI:10.1590/S0102-695X2012005000140 |
| [11] | 王芳, 乔璐, 淡小艳, 等. 桑叶黄酮的提取及抗氧化研究[J]. 广东农业科学, 2011, 47 (15): 76–79. DOI:10.3969/j.issn.1004-874X.2011.15.029 |
| [12] | 徐健飞, 义祥辉, 陈全斌. 桑叶生长周期黄酮含量变化的研究[J]. 食品科技, 2009, 35 (2): 66–70. |
| [13] | 李瑞雪, 王钰婷, 胡飞, 等. 桑树总黄酮含量变化规律分析[J]. 中国蚕业, 2015, 36 (4): 30–34. |
2. College of Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China
 2018, Vol. 35
2018, Vol. 35