文章信息
- 陈兆斌, 张博, 刘秀敏, 黄树明
- CHEN Zhaobin, ZHANG Bo, LIU Xiumin, HUANG Shuming
- 焦虑症发病机制的研究进展
- Research progress on the pathogenesis of anxiety
- 天津中医药, 2018, 35(4): 316-320
- Tianjin Journal of Traditional Chinese Medicine, 2018, 35(4): 316-320
- http://dx.doi.org/10.11656/j.issn.1672-1519.2018.04.21
-
文章历史
- 收稿日期: 2017-10-20
焦虑症(AD)是一种精神性疾病,临床常见的有广泛性焦虑(GAD)和惊恐障碍(PD)两种形式。广泛性焦虑是以持续的紧张不安,伴有自主神经功能紊乱和过分警觉为特征的一种慢性心理疾病。惊恐障碍是以反复出现的心悸、出汗、震颤等自主神经症状,并伴有莫名的担心产生不幸后果的惊恐为特征的一种急性焦虑障碍。流行病学研究显示焦虑症的发生与遗传有关,焦虑症患者的家族中其发病率高达15%,为普通人的3倍[1]。焦虑症的发病机制尚未明了,涉及多系统功能的调节紊乱。现代医学研究中,比较被认可的有神经递质假说、内分泌功能紊乱假说以及免疫功能紊乱假说,文章就中医以及现代医学假说分别对焦虑症的发病机制研究进展进行综述。
1 中医对广泛性焦虑症的认识 1.1 病因病机广泛性焦虑障碍属于中医学情志范畴,因此与中医的七情密切相关。通过总结各医家的观点,通常认为本病的基本病机为情志失调、肝郁化火并伴脾虚,不外虚、实以及虚实夹杂3个方面,虚证多为心气不足、心阳虚损、心神失养,或惊恐伤肾,肾之阴不能上达于心而致心肾不交;实证则由情志不畅导致少阳枢机不利,肝气郁结,气滞则血运不畅、心脉瘀阻、心失所养;或因阳虚不能化水,水湿内停,上凌于心而发,属虚实夹杂之证。从中医“心藏神、肝藏魄、肾藏志”的理论出发,本病与心、肝、肾三脏功能失调密切相关。正如《素问·灵兰秘典论》所云:“心者,君主之官也,神明出焉。”心藏神,主司意识、思维、情志等精神活动,统帅全身脏腑、经络、形体、官窍的生理活动。《灵枢·本神》又云:“所以任物者谓之心也”。情志所伤,首伤心神。所以《灵枢·邪气脏腑病形》说:“愁忧恐惧则伤心。”
1.2 治则治法各医家从不同的病因病机为出发点,对本病进行临床辨证论治。通过聚类分析焦虑症的临床证型总结为肝郁气滞型、肝郁脾虚型、肝肾阴虚夹痰型、心脾两虚型、阴虚火旺型5种证型组合。石向东[2]根据患者症状辨证施治,将本病分为:1)心脾两虚型,方用归脾汤加减。2)肝阳上亢型,方用杞菊地黄丸加味。3)肝气郁结型,方用柴胡疏肝散加减。4)心肾两虚型,方用六味地黄丸加减。经临床验证,治疗效果显著。周德生[3]将本病分为气阴两虚、燥热扰神证,阳虚不固、神不守舍证,痰热瘀滞证和瘀血内结证4型,分别予自拟龙齿雪莲汤,鹿自拟角巴戟煎,温胆汤,血府逐淤汤加减,取得了良好的疗效。除此之外,许多非药物疗法包括针灸、推拿等疗法亦占据重要地位,但临床仍处于试探性阶段,现代医学机制尚不清楚。陈铮等[4]以养血安神镇静法治疗焦虑症,舒肝养血安神法的作用比单纯应用西药黛力新效果好,有着不良反应少、起效快,病情复发率低的特点。姚晓燕等[5]以针刺神门、内关、足三里、天枢、太冲、肾俞、命门、曲池等,并辅以艾条悬灸针刺的穴位,治疗焦虑性神经症取得一定疗效。而孙庆等[6]则采用推拿中脘、关元、气海、心俞、胃俞、肝俞、脾俞、阳陵泉、足三里等穴位,治疗广泛性焦虑症患者的躯体症状和情绪的改善效果显著。
广泛性焦虑症其病位涉及心、肝、胆、肾、脾等脏腑,病机以气郁、痰浊、阴虚等居多,治法则主要以养心安神、疏肝解郁、补益心脾、交通心肾、养阴清热等为主,方药以经方加减较多,同时也有现代研发的中成药为焦虑症的治疗提供了更多选择。
2 现代医学对广泛性焦虑症的认识 2.1 脑内神经递质的改变对焦虑的影响中枢神经系统(CNS)是以突触的形式进行信息传递,其中最主要的是化学性突触传递。现代医学认为,焦虑症的发病与突触间隙单胺类神经递质浓度的改变密切相关,单胺类神经递质神经元分布于脑的许多不同区域及核团,参与情绪的调节。当各种原因导致的神经突触间隙单胺类神经递浓度异常时,个体会表现出焦虑[7-9]。而对突触间隙焦虑相关神经递质浓度的调节被认为是焦虑治疗研究的重要切入点。
2.1.1 5-羟色胺5-羟色胺(5-HT)是一种单胺类神经递质[10],5-HT神经元和其受体大量分布于与焦虑相关的脑区,如大脑边缘系统、海马、中缝核以及隔核等,参与个体情绪的调节过程。有研究表明,受体亚型5-HT1AR激动剂注射于海马及杏仁核部位后,可通过激动脊核突触前受体而起到抗焦虑作用[11-12];而该激动剂注射于中缝背核,则会激动突触后受体而产生致焦虑作用[13]。可见5-HT1AR存在部位的不同所产生的效应也不同。谢正研究发现,将小鼠脑内的5-HT1AR基因敲除后,小鼠表现出焦虑样的行为[13]。在海马和纹状体组织特异性表达5-HT1AR可以治疗小鼠5-HT1AR敲除导致的焦虑[14]。剌激边缘系统突触后膜5-HT2R也引起回避行为和焦虑[13]。5-HTR中6个亚型5-HT1R、5-HT1AR、5-HT1BR、5-HT2BR、5-HT2CR和5-HT3R可介导焦虑情绪的产生。有研究资料表明,将小鼠的5-HT1A和5-HT1B这两种受体敲除之后,小鼠表现的更加焦虑[15]。若敲除全部脑区的5-HT1AR,中缝核神经元活性提高,锥体细胞上的5-HT2AR激活,导致焦虑症状加重[16]。此外,5-HT还通过改变其他神经递质系统功能,如去甲肾上腺素能和多巴胺能神经,起到抗焦虑的作用[17-18]。
2.1.2 多巴胺多巴胺(DA)在认知、情绪调节中具有重要作用,近年来许多研究证实多巴胺能系统参与焦虑情绪的调节。脑中杏仁核被认为是脑内处理情感刺激最重要的部位,焦虑症、孤独症、应激和恐惧症等都与杏仁核功能异常有关。杏仁核中分布有多巴胺受体D1R和D2R,多巴胺可通过激动这些受体,抑制腺苷酸环化酶活性,引起环磷酸腺苷(Camp)减少,继而抑制蛋白激酶A和环磷腺苷效应元件结合蛋白(CREB)活性,引起生物效应而发挥对情绪的调节作用。研究发现,多巴胺D2R的拮抗剂舒必利对焦虑症模型动物具有抗焦虑作用[19-21]。β-乳铁蛋白为具有抗焦虑样活性的神经降压肽(NTS)NTS2受体激动剂,有研究表明,多巴胺D1R的拮抗剂可以阻断β-乳铁蛋白的抗焦虑样活性。提示β-乳铁蛋白可能通过NTS2R,进而通过多巴胺D1R表现出抗焦虑活性[22]。有报道,新生SD大鼠缺氧缺血性脑损伤(HIBD)所引起的成熟期焦虑样异常行为是由于HIBD导致脑内多巴胺神经元损伤所致,而在HIBD幼鼠出生时使用DAR拮抗剂后,可缓解HIBD对DA能神经元的损伤作用,从而改善SD大鼠青春期焦虑样行为[23]。
2.1.3 去甲肾上腺素参与情绪调节的去甲肾上腺素(NE)能神经元主要分布在脑干的蓝斑核团,有神经纤维投射到海马,杏仁核,边缘叶和额叶皮质,参与情绪的调节。动物实验发现,电刺激蓝斑区域使其兴奋时会增加NE的释放,可产生明显的恐惧和焦虑症状[24]。在上行网状激活系统中,激活NEα1受体可以引起焦虑的症状,而许多抗精神药物,如氯丙嗪、阿米替林等就是通过阻断α1受体来发挥镇静和抗焦虑的作用。Gresack等[25]研究发现,给予动物惊恐刺激时,脑内促肾上腺皮质激素释放因子(CRF)释放增加并诱导NE的释放,而NE对CRF具有负反馈调节作用,两者相互作用、共同调控情绪。
2.1.4 γ-氨基丁酸γ-氨基丁酸(GABA)是存在于中枢神经系统中的抑制性神经递质[26],在中枢神经系统内的GABAAR通过与苯二氮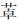
神经肽Y(NPY)是一种由36个氨基酸所组成的肽,广泛分布于中枢和外周神经系统,NPY具有抗癫痫、抗焦虑等作用。NPY通过与其受体相结合而发挥作用,其受体主要有Y1至Y6 6种类型,均为G蛋白耦联受体,其中具体那种受体与焦虑发生相关尚不完全清楚。其中Y1R主要分布在大脑皮质、丘脑及杏仁核。Li等[30]研究证实,NPY可以通过Y1R发挥抗焦虑的作用。Herman等[31]研究提出,当Y2R敲除后可以减少小鼠大脑某些区域神经元的兴奋性,从而降低焦虑行为的发生。而在Enman等[32-33]的研究中也印证了该说法,在敲除小鼠Y2R后,提高了机体对应激状况的应对能力,与对照组小鼠相比,在应激环境中表现出相对轻微的焦虑行为。Painsipp等[34]实验则表明,当小鼠Y4R的基因缺失时,也会减少与焦虑和抑郁相关的行为的发生。另有Farzi等[35]研究表明,在小鼠的Y2R和Y4R同时被敲除后则表现出更强的抗焦虑作用。上述研究分别提示Y1受体兴奋可以产生抗焦虑效应,而Y2,Y4受体兴奋则产生致焦虑效应。
2.2 内分泌功能的紊乱与焦虑症内分泌功能的紊乱会引起的心理或行为方面的改变,焦虑的发生通常源于外界刺激产生的应激反应,而这种应激反应会引起人体内的内分泌系统的改变。
2.2.1 下丘脑-垂体-肾上腺轴应激反应是机体对环境刺激做出的反应,而该反应可刺激下丘脑-垂体-肾上腺(HPA)轴,引起促肾上腺皮质激素(ACTH)和皮质醇(CS)释放增加。在应激状态时下丘脑通过释放CRF刺激垂体前叶分泌ACTH,进而刺激肾上腺皮质释放CS,而CS又会负反馈调节CRF和ACTH。Musselman等[36]研究发现,焦虑症患者血浆中ACTH水平较健康人高,当HPA轴功能异常亢进时,患者则会表现为垂体和肾上腺体积增大,脑脊液中的促肾上腺皮质素释放因子浓度增高等。
2.2.2 下丘脑-垂体-甲状腺轴有研究表明,在患有焦虑症的病人体内可以观察到下丘脑-垂体-甲状腺(HPT)轴上发生的改变,甲状腺功能异常会诱发情绪反应[37]。许多研究均表明,甲状腺功能减退会引起焦虑[38-40]。Montero-Pedrazuela[41]等研究发现,甲状腺功能减退的大鼠表现出相对较强的焦虑样行为,并提示成年人由甲状腺机能衰退所引起的情绪障碍可能是神经受损所致。Richard等[42]发现,患者在焦虑状态下血清中甲状腺激素浓度,包括游离甲状腺素(FT4)、游离三碘甲状腺原氨酸(FT3)、甲状腺素(T4)和反向三碘甲状腺原氨酸(rT3)与健康受试者相比,均显著降低。肖迎光等[43]研究也发现,焦虑患者血清中FT3和FT4的含量呈现下降的趋势。此外,甲状腺激素的合成和分泌主要是受下丘脑-垂体-甲状腺轴来调节,当血清中FT3、FT4水平降低时会触发机体的负反馈调节,引起下丘脑释放促甲状腺激素释放激素(TRH)以及垂体前叶分泌促甲状腺激素(TSH)。
2.2.3 下丘脑-垂体-性腺轴下丘脑-垂体-性腺(HPG)轴调控人体性激素的分泌。心理及躯体应激会损害HPG轴,从而影响性激素释放的调节[44]。近年来研究发现,更年期群体更容易产生焦虑或抑郁等症状,其原因可能是性激素水平降低所导致的。Nú?觡ez-Pizarro等[45-46]的研究表明,在更年期妇女由于雌激素含量降低,使得HPG轴失调,从表现出焦虑、抑郁以及认知障碍等症状。生长激素(GH)在调节动物生长发育过程中发挥重要作用,Bot M, Elbornsson等[47-48]研究证实,GH通过刺激肝、肾和肌肉组织产生胰岛素样生长因子(IGFs),IGFs家族中包括两种低分子多肽(IGF-Ⅰ、IGF-Ⅱ),而GH主要通过IGF-Ⅰ来提高更年期男性的雄性激素水平。由此推测,GH可能参与到焦虑情绪的调节过程。此外,Arranz等[49]通过对比焦虑症患者与正常人体内释放的GH含量变化,证实焦虑症患者体内GH水平降低,表明GH可能通过影响HPG轴参与到焦虑情绪的调控过程。
2.3 免疫功能紊乱与焦虑症临床研究发现,焦虑患者多伴有免疫功能紊乱的现象[50-51]。Grosse等[52]实验发现,焦虑患者的免疫功能紊乱多表现在T细胞功能的异常,将GAD患者与健康正常人比较,体外细胞培养中前者T细胞的活化减少,而肿瘤坏死因子(TNF)-α和白细胞介素-17(IL-17)的水平显著升高。Kim等[53]研究表明,单胺类递质的活性也会受到分布在神经中枢的IL-1β、IL-2和TNF-α所影响,其中IL-1β和TNF-α水平上升会产生明显的病理性焦虑。田玮等[54]研究表明,伴有焦虑情绪的哮喘患儿细胞免疫功能明显降低。Herkenham等[55]研究发现,将慢性心理应激组与其对应的非应激对照组比较,前者胸腺指数和淋巴细胞转化率均明显下降,同时出现胸腺细胞凋亡率升高和胸腺组织病理损伤加重。
3 结语综上所述,焦虑症的发病机制十分复杂,从中医角度来说,其病机为肝气郁结、郁而化热、心神失养所致,而从现代医学角度来看,其发病涉及到突触间隙单胺类神经递质浓度的改变、内分泌系统及免疫功能紊乱等。焦虑症为常见疾病,由于其发病机制不清,临床治疗上只能以缓解症状为主。随着以后研究的不断深入,相信焦虑症的发病机制终将被阐明,并可为寻找根治焦虑的药物奠定理论基础。
| [1] | Pigott TA. Gender differences in the epidemiology and treatment of anxiety disorders[J]. J Clin Psychiatry, 1999, 60 Suppl 18 : 4–15. |
| [2] | 王清任. 《医林改错》[M]. 北京: 人民卫生出版社, 2005: 25-28. |
| [3] | 李贤炜, 谭子虎. 中医药治疗广泛性焦虑症临床研究进展[J]. 湖北中医杂志, 2015, 37 (11): 80–82. |
| [4] | 陈铮, 杜立建. 逍遥散加减治疗焦虑症临床观察[J]. 山西中医, 2016, 32 (12): 6–9. DOI:10.3969/j.issn.1000-7156.2016.12.003 |
| [5] | 姚晓燕, 刘军, 李珊珊, 等. 针刺治疗广泛性焦虑症取穴规律研究[J]. 中国中医药信息杂志, 2017, 24 (7): 94–97. |
| [6] | 孙庆, 徐昭. 腹部推拿治疗广泛性焦虑症的临床研究[J]. 天津中医药, 2007, 24 (3): 215–217. |
| [7] | 韩玲娜, 王春雷, 张莉. 外侧缰核中5-HT (2C)受体在帕金森病模型大鼠焦虑行为中的调节作用及其机制[J]. 吉林大学学报(医学版), 2016, 42 (3): 473–480. |
| [8] | Ren Y, Zhou L, Wu H, et al. Research Progress of the Antidepressants Targeting the Monomine Receptors and Glutamate System[J]. 2016, 25(3): 102-104. http://www.researchgate.net/publication/303553340_Research_Progress_of_the_Antidepressants_Targeting_the_Monomine_Receptors_and_Glutamate_System |
| [9] | 宋灵云, 李苗苗, 于海玲. 芥酸酰胺对小鼠的抗焦虑样作用[J]. 沈阳药科大学学报, 2017, 34 (4): 333–337. |
| [10] | Stahl SM. Modes and nodes explain the mechanism of action of vortioxetine, a multimodal agent (MMA):enhancing serotonin release by combining serotonin (5HT) transporter inhibition with actions at 5HT receptors (5HT1A, 5HT1B, 5HT1D, 5HT7 receptors)[J]. CNS Spectr, 2015, 20 (2): 93–97. DOI:10.1017/S1092852915000139 |
| [11] | Kumar JR, Rajkumar R, Lee LC, et al. Nucleus incertus contributes to an anxiogenic effect of buspirone in rats:Involvement of 5-HT 1A receptors[J]. Neuropharmacology, 2016, 110 : 1–14. DOI:10.1016/j.neuropharm.2016.07.019 |
| [12] | 谢正, 王娜, 李恒芬, 等. 5-羟色胺1A受体基因10196295单核苷酸多态性与中国汉族人群焦虑障碍的关联分析鄢[J]. 中国现代医学杂志, 2016, 26 (11): 29–33. DOI:10.3969/j.issn.1005-8982.2016.11.006 |
| [13] | Kumar JR, Rajkumar R, Lee LC, et al. Nucleus incertus contributes to an anxiogenic effect of buspirone in rats:Involvement of 5-HT1A receptors[J]. Neuropharmacology, 2016, 110 (Pt A): 1–14. |
| [14] | Ramboz S, Oosting R, Amara DA, et al. Serotonin receptor 1A knockout:an animal model of anxiety-related disorder[J]. Proc Natl Acad Sci U S A, 1998, 95 (24): 14476–14481. DOI:10.1073/pnas.95.24.14476 |
| [15] | Guilloux JP, David DJ, Xia L, et al. Characterization of 5-HT(1A/1B)-/-mice:an animal model sensitive to anxiolytic treatments[J]. Neuropharmacology, 2011, 61 (3): 478–488. DOI:10.1016/j.neuropharm.2011.02.009 |
| [16] | Albert PR, Vahid-Ansari F, Luckhart C. Serotonin-prefrontal cortical circuitry in anxiety and depression phenotypes:pivotal role of pre-and post-synaptic 5-HT1A receptor expression[J]. Front Behav Neurosci, 2014, 8 : 199. |
| [17] | 苏晖, 施慎逊. 5-HT_(1A)受体对抑郁焦虑行为的调节作用及其机制[J]. 上海交通大学学报(医学版), 2015, 35 (9): 1403–1406. |
| [18] | 刘椰, 姜依凡, 刘鑫, 等. 背侧海马齿状回5-HT 1A受体在帕金森病大鼠焦虑行为中的作用[J]. Journal of Xi'an Jiaotong University (Medical Sciences), 2017, 38 (3): 78–79. |
| [19] | 刘昀, 陈金兰. 204例住院患者精神药物一日处方分析[J]. 中国药物警戒, 2017, 14 (1): 45–48. |
| [20] | 毛丽娜, 朱清, 李俊旭. 牡荆素的神经保护作用及机制研究进展[J]. 中国药理学通报, 2016, 32 (10): 1353–1356. DOI:10.3969/j.issn.1001-1978.2016.10.006 |
| [21] | 罗旭艳, 欧灿纯, 龚俊, 等. 南宁市第五人民医院2012-2014年度抗精神病药物使用情况分析[J]. 医药导报, 2016, 35 (增刊): 142–144. |
| [22] | Hou IC, Suzuki C, Kanegawa N, et al. beta-Lactotensin derived from bovine beta-lactoglobulin exhibits anxiolytic-like activity as an agonist for neurotensin NTS(2) receptor via activation of dopamine D(1) receptor in mice[J]. J Neurochem, 2011, 119 (4): 785–790. DOI:10.1111/jnc.2011.119.issue-4 |
| [23] | 陶惠康, 汤琴, 戴津津, 等. 多巴胺受体调节对新生大鼠缺氧缺血性脑损伤后焦虑样行为的影响[J]. 中国当代儿科杂志, 2014 (10): 1045–1050. DOI:10.7499/j.issn.1008-8830.2014.10.018 |
| [24] | Lapierre YD. Handbook of depression and anxiety:A biological approach[J]. Journal of Psychosomatic Research, 1996, 41 (3): 289–290. |
| [25] | Gresack JE, Risbrough VB. Corticotropin-releasing factor and noradrenergic signalling exert reciprocal control over startle reactivity[J]. Int J Neuropsychopharmacol, 2011, 14 (9): 1179–1194. DOI:10.1017/S1461145710001409 |
| [26] | Egerton A, Modinos G, Ferrera D, et al. Neuroimaging studies of GABA in schizophrenia:a systematic review with meta-analysis[J]. Transl Psychiatry, 2017, 7 (6): e1147. DOI:10.1038/tp.2017.124 |
| [27] | 刘倩佟, 刘洁, 郭建友, 等. 合欢花总黄酮抗焦虑作用研究[J]. 现代中药研究与实践, 2015, 29 (2): 33–35. |
| [28] | Murrough JW, Yaqubi S, Sayed S, et al. Emerging drugs for the treatment of anxiety[J]. Expert opinion on emerging drugs, 2015, 20 (3): 393–406. DOI:10.1517/14728214.2015.1049996 |
| [29] | 胡江平, 张蕴琨. GABA与GABA受体及其在运动中变化的研究现状[J]. 南京体育学院学报(自然科学版), 2004, 3 (3): 4–8. |
| [30] | Li Q, Bartley AF, Dobrunz LE. Endogenously Released Neuropeptide Y Suppresses Hippocampal Short-term Facilitation and Is Impaired by Stress-Induced Anxiety[J]. Journal of Neuroscience, 2017, 37 (1): 23–37. DOI:10.1523/JNEUROSCI.2599-16.2016 |
| [31] | Herman MA, Roberto M. The addicted brain:understanding the neurophysiological mechanisms of addictive disorders[J]. Frontiers in integrative neuroscience, 2015 : 9. |
| [32] | Enman NM, Sabban EL, Mcgonigle P, et al. Targeting the neuropeptide Y system in stress-related psychiatric disorders[J]. Neurobiology of Stress, 2015 (1): 33–43. |
| [33] | Verma D, Wood J, Lach G, et al. NPY Y2 receptors in the central amygdala reduce cued but not contextual fear[J]. Neuropharmacology, 2015 (99): 665–674. |
| [34] | Painsipp E, Wultsch T, Edelsbrunner ME, et al. Reduced anxiety-like and depression-related behavior in neuropeptide Y Y4 receptor knockout mice[J]. Genes Brain Behav, 2008, 7 (5): 532–542. DOI:10.1111/gbb.2008.7.issue-5 |
| [35] | Farzi A, Reichmann F, Holzer P. The homeostatic role of neuropeptide Y in immune function and its impact on mood and behaviour[J]. Acta Physiologica, 2015, 213 (3): 603–627. DOI:10.1111/apha.12445 |
| [36] | Musselman DL, Nemeroff CB. Depression and endocrine disorders:focus on the thyroid and adrenal system[J]. Br J Psychiatry Suppl, 1996 (30): 123–128. |
| [37] | 金睿, 徐理, 杨玥, 等. 焦虑与抑郁障碍共病患者症状与血清甲状腺激素水平的相关分析[J]. 四川精神卫生, 2016, 29 (4): 323–326. |
| [38] | Bathla M, Singh M, Relan P. Prevalence of anxiety and depressive symptoms among patients with hypothyroidism[J]. Indian journal of endocrinology and metabolism, 2016, 20 (4): 468. DOI:10.4103/2230-8210.183476 |
| [39] | Stohn JP, Martinez ME, Hernandez A. Decreased anxiety-and depression-like behaviors and hyperactivity in a type 3 deiodinase-deficient mouse showing brain thyrotoxicosis and peripheral hypothyroidism[J]. Psychoneuroendocrinology, 2016, 74 : 46–56. DOI:10.1016/j.psyneuen.2016.08.021 |
| [40] | Ge J, Xu Y, Qin G, et al. Resveratrol ameliorates the anxiety-and depression-like behavior of subclinical hypothyroidism rat:possible involvement of the HPT axis, HPA axis, and Wnt/β-catenin pathway[J]. Frontiers in endocrinology, 2016 : 7. |
| [41] | Montero-Pedrazuela A, Venero C, Lavado-Autric R, et al. Modulation of adult hippocampal neurogenesis by thyroid hormones:implications in depressive-like behavior[J]. Mol Psychiatry, 2006, 11 (4): 361–371. DOI:10.1038/sj.mp.4001802 |
| [42] | Richard S, Aguilera N, Thévenet M, et al. Neuronal expression of a thyroid hormone receptor α mutation alters mouse behaviour[J]. Behavioural brain research, 2017, 321 : 18–27. DOI:10.1016/j.bbr.2016.12.025 |
| [43] | 肖迎光, 杜惠兰, 谈金莲, 等. 焦虑症患者的COR、甲状腺激素及自主神经的功能特点及神经内分泌、自主神经功能影响因素分析[J]. 国际精神病学杂志, 2015, 42 (4): 36–39. |
| [44] | Camille ML, Maguire J. GABAergic regulation of the HPA and HPG axes and the impact of stress on reproductive function[J]. J Steroid Biochem Mol Biol, 2016, 160 : 196–203. DOI:10.1016/j.jsbmb.2015.11.019 |
| [45] | Núez-Pizarro J L, González-Luna A, Mezones-Holguín E, et al. Association between anxiety and severe quality-of-life impairment in postmenopausal women:analysis of a multicenter Latin American cross-sectional study[J]. Menopause, 2017, 24 (6): 645–652. DOI:10.1097/GME.0000000000000813 |
| [46] | Schoenrock SA, Oreper D, Young N, et al. Ovariectomy results in inbred strain-specific increases in anxiety-like behavior in mice[J]. Physiology & behavior, 2016, 167 : 404–412. |
| [47] | Bot M, Milaneschi Y, Penninx BW, et al. Plasma insulin-like growth factor Ⅰ levels are higher in depressive and anxiety disorders, but lower in antidepressant medication users[J]. Psychoneuroendocrinology, 2016, 68 : 148–155. DOI:10.1016/j.psyneuen.2016.02.028 |
| [48] | Elbornsson M, Horvath A, Götherström G, et al. Seven years of growth hormone (GH) replacement improves quality of life in hypopituitary patients with adult-onset GH deficiency[J]. European journal of endocrinology, 2017, 176 (2): 99–109. DOI:10.1530/EJE-16-0875 |
| [49] | Owashi T, Otsubo T, Oshima A, et al. Longitudinal neuroendocrine changes assessed by dexamethasone/CRH and growth hormone releasing hormone tests in psychotic depression[J]. Psychoneuroendocrinology, 2008, 33 (2): 152–161. DOI:10.1016/j.psyneuen.2007.10.011 |
| [50] | Hou R, Garner M, Holmes C, et al. Peripheral inflammatory cytokines and immune balance in generalised anxiety disorder:case-controlled study[J]. Brain, Behavior, and Immunity, 2017, 62 : 212–218. DOI:10.1016/j.bbi.2017.01.021 |
| [51] | Hou R, Holmes C, Garner M, et al. How is the immune balance affected in patients with generalised anxiety disorder?[J]. Brain, Behavior, and Immunity, 2016, 57 : e43. |
| [52] | Grosse L, Carvalho LA, Birkenhager TK, et al. Circulating cytotoxic T cells and natural killer cells as potential predictors for antidepressant response in melancholic depression. Restoration of T regulatory cell populations after antidepressant therapy[J]. Psychopharmacology, 2016, 233 (9): 1679–1688. DOI:10.1007/s00213-015-3943-9 |
| [53] | Kim HY, Jeong HJ, Kim HM. Antidepressant-like effect of Ikwitang involves modulation of monoaminergic systems[J]. Molecular medicine reports, 2016, 13 (3): 2815–2820. DOI:10.3892/mmr.2016.4809 |
| [54] | 田玮, 李鸣杲. 哮喘患儿焦虑情绪与细胞免疫功能的测定[J]. 中国临床心理学杂志, 1997, 5 (3): 52–53. |
| [55] | Herkenham M, Kigar SL. Contributions of the adaptive immune system to mood regulation:Mechanisms and pathways of neuroimmune interactions[J]. Progress in Neuro-Psychopharmacology and Biological Psychiatry, 2017, 79 : 49–57. DOI:10.1016/j.pnpbp.2016.09.003 |
 2018, Vol. 35
2018, Vol. 35