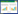文章信息
- 钟成梁, 胡思源, 郭圣璇, 李新民, 韩选明, 谢晓丽, 潘树强, 徐桂萍, 湛治萍, 全惜春, 苏保玲, 杜永刚, 刘玉凤, 马斯风, 洪丽军, 邵荣昌, 王爱珍, 李学明
- ZHONG Chengliang, HU Siyuan, GUO Shengxuan, LI Xinmin, HAN Xuanming, XIE Xiaoli, PAN Shuqiang, XU Guiping, ZHAN Zhiping, QUAN Xichun, SU Baoling, DU Yonggang, LIU Yufeng, MA Sifeng, HONG Lijun, SHAO Rongchang, WANG Aizhen, LI Xueming
- 宝儿康散剂量加倍治疗小儿慢性迁延性腹泻病脾虚湿困证评价其有效性和安全性的随机双盲、阳性药和原剂量平行对照、多中心临床试验
- Efficacy and safety of double dose Baoerkang powder in children with chronic persistent diarrhea disease of damp retention due to spleen deficiency: A block randomized, double-blind, positive-controlled, parallel to the original dose, multi-center clinical trials
- 天津中医药, 2018, 35(5): 324-328
- Tianjin Journal of Traditional Chinese Medicine, 2018, 35(5): 324-328
- http://dx.doi.org/10.11656/j.issn.1672-1519.2018.05.02
-
文章历史
- 收稿日期: 2017-12-28
2. 天津中医药大学, 天津 300193;
3. 陕西中医药大学第二附属医院, 咸阳 712000;
4. 成都市妇女儿童中心医院, 成都 610000;
5. 钦州市妇幼保健院, 钦州 535000;
6. 惠州市中医医院, 惠州 516000;
7. 贵州省黔南布衣族苗族自治州中医医院, 黔南州 558000;
8. 南阳市中医院, 南阳 473000;
9. 长治医学院附属和济医院, 长治 046000;
10. 长治市人民医院, 长治 046000;
11. 辽宁中医药大学附属第四医院, 沈阳 110000;
12. 大庆市中医医院, 大庆 163000;
13. 牡丹江市中医医院, 牡丹江 157000;
14. 鄂州市中心医院, 鄂州 436000;
15. 泰州市中医院, 泰州 225300;
16. 邯郸市中医院, 邯郸 056000
小儿腹泻病是一组由多病原、多因素引起的、以大便次数增多和大便性状改变为特点的临床常见综合征,其病程在2周~2个月为迁延性腹泻,2个月以上为慢性腹泻[1]。本病高发于6个月~2岁婴幼儿,1岁以内约占半数,是造成小儿营养不良、生长发育障碍和死亡的主要原因之一。据统计,发展中国家每年约有450万5岁以下的儿童死于腹泻病,其中一半是死于迁延性、慢性腹泻及其合并症[2]。宝儿康散是广东宏兴集团股份有限公司宏兴制药厂生产的用于治疗小儿腹泻脾虚湿困证的中成药,为探索本品加倍剂量治疗小儿慢性迁延性腹泻病脾虚湿困证的有效性和安全性,以天津中医药大学第一附属医院为临床研究负责单位的15家医疗机构于2014年8月—2015年12月,对该药进行了上市后再评价临床研究。在临床研究开始之前,本试验方案获得了临床研究负责单位天津中医药大学第一附属医院医学伦理委员会的批准(TYLL2013[Y]字023)。
1 资料和方法 1.1 一般资料采用区组随机、双盲双模拟、阳性药和原剂量平行对照、多中心临床研究的方法。所选病证为小儿慢性迁延性腹泻病脾虚湿困证。所有病例分别由天津中医药大学第一附属医院、陕西中医药大学第二附属医院、成都市妇女儿童中心医院、钦州市妇幼保健院、惠州市中医医院、贵州省黔南布衣族苗族自治州中医医院、南阳市中医院、长治医学院附属和济医院、长治市人民医院、辽宁中医药大学附属第四医院、大庆市中医医院、牡丹江市中医医院、鄂州市中心医院、泰州市中医院、邯郸市中医院15家临床研究中心共同承担。运用SAS统计软件,以临床研究中心为分层因素,按照1:1:1的比例,生成随机数字分组表,采用二级设盲,对医生、患者和统计分析人员实施盲法。
本研究计划和实际纳入患儿168例,其中,脱落9例(加倍剂量组3例,原剂量组3例,阳性药对照组3例),剔除3例(原剂量组)。166例进入全分析数据(FAS)集,156例进入符合方案数据(PPS)集,168例进入安全数据(SS)。进入FAS集者中,加倍剂量组56例,原剂量组55例,阳性药对照组55例。3组基线的人口学特征(性别、年龄、身高、体质量),病程和病情及基线疗效指标的组间比较,差异均无统计学意义(P>0.05)。见表 1。
小儿腹泻病的诊断及其病程分期、病情分型标准,参照1998年《中国腹泻病诊断治疗方案》[3]以及2009年发布的《儿童腹泻病诊断治疗原则的专家共识》[4]制定。
脾虚湿困证中医辨证标准:参照汪受传主编新世纪(第2版)全国高等中医药院校规划教材《中医儿科学》[5]制定。主症:1)大便稀溏;2)便次增多(每日3次及以上)。次症:1)肢体困倦;2)神疲;3)食欲不振;4)面色少华。舌苔脉象:舌淡,苔白腻,脉无力或濡,指纹淡。主症必备,次症中具备≥2项,参照舌脉即可诊断。
1.3 受试者选择与退出 1.3.1 纳入标准1)符合小儿慢性或迁延性腹泻诊断标准者。2)符合腹泻脾虚湿困证中医辨证标准。3)年龄在6个月~12岁。4)签署知情同意书。
1.3.2 排除标准1)细菌、寄生虫、真菌所致的慢性肠炎或痢疾患儿。2)有脓血便或粪便镜检脓细胞、白细胞或红细胞超出参考值范围者。3)原发性吸收不良性腹泻病、过敏性慢性腹泻病或炎症性肠病患儿。4)重型腹泻患儿。5)消化系统外科手术后引起的腹泻。6)合并严重心、肺、肝、肾、消化、造血等系统严重疾病,以及重度营养不良或免疫缺陷患儿。7)对试验用药过敏或过敏体质患儿。8)研究者认为存在任何不适合入选或存在影响参与或完成研究因素者。
1.3.3 脱落标准研究者决定退出:1)出现过敏反应或严重不良事件,根据医生判断应停止试验者。2)试验过程中,患儿病情加重,或发生其他疾病,影响疗效和安全性判断者。3)受试者依从性差(试验用药依从性<80%或>120%),或自动中途换药。4)各种原因的中途破盲病例。5)严重违反纳入或排除标准,本不应随机化者。6)随机化后未曾用药者。
受试者自行退出:1)无论何种原因,患者不愿意或不可能继续进行临床试验,向主管医生提出退出试验要求而中止试验者。2)受试者虽未明确提出退出试验,但不再接受用药及检测而失访者。
1.4 试验用药物规格、批号按照双盲双模拟要求,宝儿康散1、宝儿康散2(生产批号:130706, 140401)及其模拟剂1、模拟剂2(生产批号:B140301),规格均为每瓶1 g;止泻灵颗粒(生产批号:20131101,20131214,20140309),及其模拟剂3(生产批号:B140401),规格均为每袋6 g。所有药物均由广东宏兴集团有限公司宏兴制药厂提供。
1.5 用药方法加倍剂量组使用宝儿康散1、宝儿康散2和模拟剂3;原剂量组使用宝儿康散1、模拟剂2和模拟剂3;对照组使用模拟剂1、模拟剂2和止泻灵颗粒。宝儿康散及其模拟剂,开水冲服,6个月至1岁每次0.25 g,2~3岁每次0.5 g,4~6岁每次1 g,7~12岁每次1.5 g,每日2次。止泻灵颗粒及其模拟剂,口服,6个月~1岁每次3 g,2~3岁每次4 g,4~6岁每次6 g,7~12岁每次12 g,每日3次。疗程均为5 d。根据病情需要,3组均可以应用静脉或口服液体疗法预防或纠正脱水。试验过程中禁用抗病毒、抗生素、微生态调节剂、肠黏膜保护剂以及其他有止泻作用的中西药物。
1.6 有效性评价 1.6.1 有效性评价指标1)腹泻症状疗效。2)止泻时间。3)中医证候疗效。4)中医单项症状疗效。以腹泻症状疗效的总有效率为主要评价指标。
1.6.2 症状分级量化标准分为正常、轻、中、重4个等级。主症分别赋0、2、4、6分,次症分别赋0、1、2、3分。分级表现:1)大便稀溏。轻,指溏便;中,指稀水便;重,指水样便。2)便次增多。轻,指每日3~5次;中,指每日6~10次;重,指每日>10次。3)肢体困倦。轻,指肢体稍倦,可坚持轻体力活动;中,指四肢乏力,勉强坚持日常活动;重,指全身无力,终日不愿活动。4)神疲。轻,指精神不振,可坚持学习、生活;中,指精神疲乏,勉强支持学习、生活;重,指精神萎靡,难以坚持学习、生活。5)食欲不振。轻,指不思进食;中,指厌恶进食;重,指拒食。6)面色少华。轻,指面色少华。无中、重分级。
1.6.3 疗效评价标准1)腹泻症状疗效评价标准。显效,治疗5 d内粪便性状及次数恢复正常,全身症状消失;有效,治疗5 d内粪便性状及次数明显好转(治疗后,性状为溏便、软便或干便;次数,每日5次或以下),全身症状明显改善;无效,治疗5 d内粪便性状、次数及全身症状均无好转甚至恶化。2)中医证候疗效评价标准。临床痊愈,中医临床症状、体征消失或基本消失,证候积分减少≥95%;显效,中医临床症状、体征明显改善,证候积分减少≥70%,<95%;有效,中医临床症状、体征均有好转,证候积分减少≥30%,<70%;无效,中医临床症状、体征均无明显改善,甚或加重,证候积分减少不足30%。注:疗效指数(n)=[(治疗前总积分-治疗后总积分)/治疗前总积分]×100%。3)止泻,定义为连续2次出现成形便或连续24 h未排便。4)中医单项症状疗效评定标准。症状消失,积分降至0分;显效,症状明显改善,积分降低2个等级;有效,症状有所改善,积分降低1个等级;无效,症状无改善或加重,积分未减少或有所增加。总有效率=症状消失率+显效率+有效率[6-8]。
1.7 安全性评价安全性指标包括:1)可能发生的不良事件及不良反应。2)生命体征。体温、静息心率、呼吸、休息10 min后的血压(收缩压、舒张压)。3)血常规、尿常规、大便常规、心电图和肝功能[丙氨酸氨基转移酶(ALT)、门冬氨酸氨基转移酶(AST)、总胆红素(TBIL)、γ-谷氨酰转移酶(γ-GGT)、碱性磷酸酶(ALP)]、肾功能[血尿素氮(BUN)、肌酐(Cr)]。治疗前正常治疗后异常者,应定期复查至随访终点。以不良反应发生率为主要安全性评价指标。
1.8 统计学方法所有统计计算均用SAS v9.2统计分析软件进行。定量数据采用均数±标准差(x±s),组间比较采用方差分析或Kruskal-Wallis H检验,定性数据用构成比/率表示,组间比较采用χ2检验,考虑到中心或其他因素的影响采用CMH卡方检验。时序资料,描述其中位生存时间并采用Log-rank检验。主要指标的两两比较,采用置信区间法(计算双侧95%CI)。全部的假设检验均采用双侧检验,取α=0.05。
2 结果 2.1 腹泻症状疗效治疗5 d,3组腹泻症状疗效的总有效率,考虑中心效应后,经CMH卡方检验,组间比较差异有统计学意义。其总有效率组间差值的95%CI,加倍剂量组-原剂量组为20.20%(5.54%,34.85%),加倍剂量组-对照组为23.84%(8.88%,38.78%),原剂量组-对照组为3.64%(-13.89%,21.16%),提示加倍剂量组疗效优于原剂量组和对照组。见表 2。
治疗5 d,加倍剂量组中位止泻时间为4 d,原剂量组为5 d,对照组未观察到中位止泻时间。3组中位止泻时间的组间比较,差异有统计学意义,加倍剂量组疗效优于原剂量组和对照组。见表 3。

|
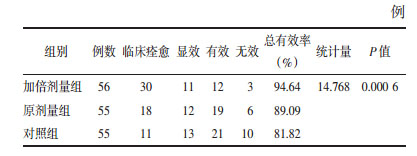
治疗5 d,3组腹泻症状疗效总有效率,考虑中心效应后,经CMH卡方检验,组间比较差异有统计学意义。其总有效率组间差值的95%CI,加倍剂量组-原剂量组为5.55%(-4.61%,15.71%),加倍剂量组-对照组为12.82%(0.68%,24.78%),原剂量组-对照组为7.27%(-5.91%,20.45%),提示加倍剂量组疗效优于对照组。见表 4。
|
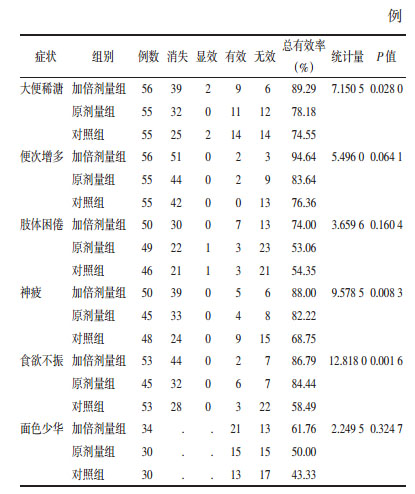
治疗5 d在大便稀溏、神疲、食欲不振方面,考虑中心效应后,经CMH卡方检验,3组间比较,差异有统计学意义,加倍剂量组疗效优于原剂量组和/或对照组。见表 5。
|
本试验,仅原剂量组发生1例不良事件,表现为“尿白细胞与尿葡萄糖升高”,研究者均判断“不可能与试验药物有关”,发生率为1.79%。3组生命体征(心率、呼吸、体温、收缩压、舒张压)及实验室检查(血尿便常规、肝肾功能、心电图)治疗前后的异常变化情况的3组间比较,差异均无统计学意义(P>0.05)。
3 讨论小儿腹泻病属于中医的“泄泻”范畴,其病因系婴幼儿脾常不足,加之感受外邪、伤于乳食,或脾肾气阳亏虚,临床上,脾虚湿困证常见[9-10]。
宝儿康散主要由太子参、芡实、薏苡仁、茯苓、白扁豆(炒)、甘草(炙)、白术(炒)、麦芽(炒)、山楂、北沙参、山药、陈皮、石菖蒲、莲子等14味中药组成。功能主治为补气健脾,开胃消食,渗湿,止泻。用于小儿脾胃虚弱,消化不良,食欲不振,大便稀溏,精神困倦。药理研究结果表明,本品具有很好的止泻、促进消化、解痉作用以及提高机体的非特异性免疫机能,临床治疗小儿腹泻有效[11-13]。止泻灵颗粒是由参苓白术散化裁而来,其主要组成是党参、白术(炒)、陈皮、白扁豆(炒)、甘草、薏苡仁(炒)、山药、莲子、泽泻、茯苓,全方补脾益气,渗湿止泻,是临床常用的上市中成药,与宝儿康散同类可比,故以之为对照。
试验结果显示,以宝儿康散加倍剂量(说明书用量的两倍)治疗小儿慢性迁延性腹泻病脾虚湿困证,其腹泻症状疗效的总有效率和中位止泻时间,均优于对照药止泻灵颗粒和原剂量宝儿康散(说明书用量);其中医证候疗效总有效率,均优于对照药止泻灵颗粒。试验中,仅发生1例不良事件,经研究者判断为“不可能与试验药物有关”,不认为是药物的不良反应。上述结果,提示宝儿康散加倍剂量应用治疗小儿迁延性和慢性腹泻病脾虚湿困证,同时具有改善腹泻症状、缩短腹泻病程和改善中医证候作用,且安全性好,因此,推荐宝儿康散临床加倍剂量使用。
| [1] | 丁杨, 朱萱萱, 管恩泽. 中医药治疗小儿迁延性腹泻的研究进展[J]. 中华中医药学刊, 2008, 26 (11): 2430–2432. |
| [2] | 方鹤松. 小儿腹泻病学[M]. 北京: 人民卫生出版社, 2009. |
| [3] | 方鹤松, 段恕诚, 董宗祈, 等. 中国腹泻病诊断治疗方案[J]. 中国实用儿科杂志, 1998, 13 (6): 381–384. |
| [4] | 中华医学会儿科学分会消化学组, 中华医学会儿科学分会感染学组, 《中华儿科杂志》编辑委员会. 儿童腹泻病诊断治疗原则的专家共识[J]. 中华儿科杂志, 2009, 47 (8): 634–636. |
| [5] | 汪受传. 中医药学高级丛书·中医儿科学[M]. 第2版. 北京: 人民卫生出版社, 2011. |
| [6] | 98全国腹泻病防治学术研讨会组委会. 98全国腹泻病防治学术研讨会会议纪要[J]. 中华儿科杂志, 1999, 37 (4): 27–28. |
| [7] | 方鹤松, 段恕诚, 董宗祈, 等. 腹泻病疗效判断标准的补充建议[J]. 中国实用儿科杂志, 1998, 12 (6): 64. |
| [8] | 江载芳, 申昆玲, 沈颖. 诸福棠实用儿科学[M]. 第8版. 北京: 人民卫生出版社, 2015. |
| [9] | 方鹤松. 小儿迁延性腹泻与慢性腹泻的诊断与治疗[J]. 中国乡村医药, 2008, 1 (11): 6–8. DOI:10.3969/j.issn.1006-5180.2008.11.003 |
| [10] | 郁晓维, 王丽慧, 王明明. 迁延性腹泻中医证型探讨[J]. 时珍国医国药, 2007, 18 (4): 968–969. |
| [11] | 吴玉燕, 张伟. 宝儿康散治疗小儿急性腹泻病的疗效观察[J]. 中国社区医师(医学专业), 2012, 14 (3): 197. |
| [12] | 汪秀云, 甄党霞. 中药宝儿康散治疗秋季小儿腹泻120例疗效观察[J]. 内蒙古中医药, 2011, 30 (15): 52–53. |
| [13] | 红霞, 李喆. 宝儿康散与思连康联用治疗婴幼儿非感染性腹泻158例报告[J]. 中国实用医药, 2006, 1 (6): 60–61. |
2. Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China;
3. The Second Hospital Affiliated of Shanxi University of Traditional Chinese Medicine, Xianyang 712000, China;
4. Chengdu Women and Children Center Hospital, Chengdu 610000, China;
5. Qinzhou City Maternal and Child Health Care, Qinzhou 535000, China;
6. Huizhou Traditional Chinese Medicine Hospital, Huizhou 516000, China;
7. Guizhou Province Qiannan Buyi and Miao Autonomous Prefecture Chinese Medicine Hospital, Guizhou 558000, China;
8. Nanyang Traditional Chinese Medicine Hospital, Nanyang 473000, China;
9. Heji Affiliated Hospital of Changzhi Medical College, Changzhi 046000, China;
10. Changzhi People's Hospital, Changzhi 046000, China;
11. The Fourth Hospital Affiliated of Liaoning University of Traditional Chinese Medicine, Shenyang 110000, China;
12. Daqing Chinese Medicine Hospital, Daqing 163000, China;
13. Mudanjiang Chinese Medicine Hospital, Mudanjiang 157000, China;
14. Ezhou Central Hospital, Ezhou 436000, China;
15. Taizhou Traditional Chinese Medicine Hospital, Taizhou 225300, China;
16. HandanTraditional Chinese Medicine Hospital, Handan 056000, China
 2018, Vol. 35
2018, Vol. 35