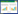文章信息
- 唐阁, 杨洪涛, 范淑芳, 郭淑婷
- TANG Ge, YANG Hongtao, FAN Shufang, GUO Shuting
- 尿毒症性心肌病相关危险因素的临床调查研究
- Clinical investigation of risk factors associated with uremic cardiomyopathy
- 天津中医药, 2018, 35(5): 332-335
- Tianjin Journal of Traditional Chinese Medicine, 2018, 35(5): 332-335
- http://dx.doi.org/10.11656/j.issn.1672-1519.2018.05.04
-
文章历史
- 收稿日期: 2018-01-14
2. 天津中医药大学研究生院, 天津 300193
心血管疾病(CVD)是所有终末期肾病的常见并发症之一,是导致慢性肾功能衰竭患者死亡的首位原因,而以心肌肥厚、心肌间质纤维化为主要病理改变的尿毒症性心肌病又是其中的最重要组成部分[1],极易发生充血性心力衰竭、心律失常、心肌缺血等临床症状,很大程度上增加了患者的死亡风险,其中有研究表明其2年生存率(约33%~67%)及透析后平均存活期(约44个月)均低于未诊断者(分别为80%~90%和55个月)。因此明确尿毒症性心肌病危险因素对减少发病率、改善患者生存质量有重要意义,本研究通过病例对照研究分析尿毒症性心肌病的相关危险因素。
1 材料与方法 1.1 研究对象随机选取本院门诊或住院部2013年6月-2017年6月的尿毒症患者135例,其中男74例(54.5%),女61例(45.5%),年龄17~90岁,平均58.04岁,原发病为慢性肾小球肾炎77例,糖尿病肾病34例,慢性感染性间质性肾病15例,多囊肾5例,药物性肾损害4例,分为尿毒症性心肌病组(88例)、无尿毒症性心肌病组(47例)。
1.2 诊断依据关于尿毒症性心肌病的诊断目前尚无统一的标准,一般在明确患者慢性肾功能衰竭的基础上,结合患者症状、体征及实验室和影像学检查作出诊断,其中心脏彩超有左房、左室增大,室间隔、左室后壁增厚,以舒张功能减退为主,病变晚期可出现收缩功能异常[2-3],心电图检查方面,可表现为左心室的高电压、肥大及导联中ST-T段改变及多种类型的心律失常。
1.3 纳入标准符合上述尿毒症性心肌病诊断标准的患者均可纳入。
1.4 排除标准1)高血压肾损害所致慢性肾功能衰竭患者或高血压所致左心结构功能改变者。2)原有缺血性心肌病,或扩张性、肥厚性心肌病,且已有明显心脏结构与功能异常者。3)系统性疾病所致的继发性肾损害,包括过敏性紫殿、系统性红斑狼疮、系统性血管炎等。4)近3个月存在心肌梗死、心力衰竭、呼吸衰竭及急性脑血管疾病等合并症。5)近1个月合并电解质紊乱、严重代谢性酸中毒等并发症。
1.5 研究内容收集所有入选病例性别、年龄、原发病等基本情况,并检测尿素氮(BUN)、肌酐(Scr)、尿酸(UA)、总蛋白(TP)、白蛋白(ALB)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、总胆固醇(TC)、甘油三酯(TG)、血钙(Ca)、血磷(P)等实验室指标,采用日本产伪彩Aloka SSD-280LS型多功能超声诊断系统及VGR-23 Doppler Unit (连续多普勒、脉冲多普勒)检测,行二维-M型-多普勒超声心动图(D-M-PDE)检测相关左心功能指标,主要包括射血分数(EF)、左心房内径(LAD)、左心室舒张末内径(LVD)、室间隔厚度(IVS)。
1.6 统计学处理采用SPSS20.0进行统计学分析,符合正态分布的计量资料采用均数±标准差(x±s)表示,2组间比较采用t检验,不符合正态分布的采用中位数(四分位数间距)[M(P25~P75)]表示,2组间比较采用Mann-Whitney U检验,计数资料2组间比较采用χ2检验,多因素分析:应用二分类Logistic回归模型分析独立的影响因素。P<0.05为差异有统计学意义。
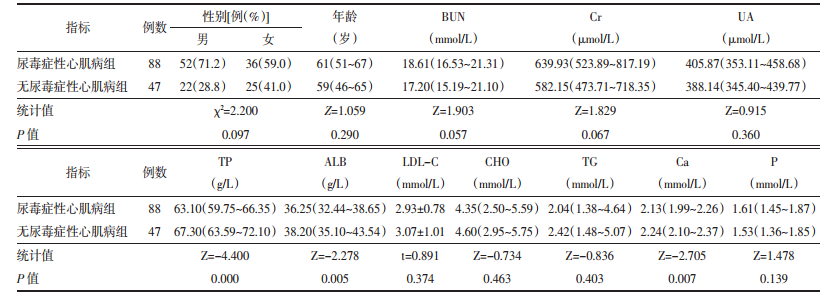
2 结果 2.1 尿毒症性心肌病与无尿毒症性心肌病单因素分析单因素分析中尿毒症性心肌病组总蛋白、白蛋白、血钙浓度均显著低于对照组(P<0.05),而血肌酐、尿素氮、血磷水平虽明显高于对照组,但统计学差异无统计学意义(P>0.05),血脂四项在两组间差异无统计学意义。见表 1
|
将单因素分析P<0.2的参数进行二分类Logistic回归,结果显示血肌酐水平升高是尿毒症性心肌病的危险因素,而总蛋白升高是其保护性因素(P<0.05)。见表 2。
尿毒症性心肌病是以急慢性肾功能衰竭为病理基础,由复杂机体内环境导致的心肌肥厚、心肌间质纤维化为主要病理改变的一组综合征,患者常表现为心悸、胸闷、心前区不适、颈静脉怒张、肺水肿等,重者出现充血性心力衰竭,甚至猝死,严重威胁着患者的生命健康。有研究表明3期及以上慢性肾脏病(CKD)患者普遍存在尿毒症心肌病的表现[4],其中北京大学第一附属医院肾内科统计过慢性肾病合并心肌病者占40.3%。对于该病的研究,早在1975年Prosser就提出“尿毒症毒素所致特异心肌功能障碍即为尿毒症心肌病”的概念,其后随着现代医学的发展,尿毒症性心肌病的发病机制、治疗及诊断等方面均得到了长足的发展,但尿毒症性心肌病发病机制复杂多样,涉及多系统、多器官功能损害,且缺乏特效的治疗手段,因此其临床病死率仍居高不下,故明确尿毒症性心肌病发病危险因素,从而延缓其进一步发展,对减少发病率、改善患者生存质量有重要意义。
首先本研究结果显示在单因素分析中,虽然血肌酐、尿素氮浓度两组间比较无统计学差异,但总体水平明显高于对照组,且在二分类Logistic回归分析中进一步提示血肌酐水平升高为尿毒症性心肌病的独立危险因素,与相关国内外报道[5]基本一致,即以血肌酐及尿素氮为代表的尿毒症毒素主要通过促进氧化应激反应、参与内皮细胞损伤及促进细胞凋亡等途径抑制心肌细胞收缩、影响细胞能量代谢,进而产生心血管毒性。国内学者刘春燕等[6]将尿毒症患者血清中提取的肌酐、尿素配置成不同浓度的溶液,用于培养SD大鼠心肌细胞,发现尿毒症血清显著影响心肌组织的收缩节律,并通过升高心肌组织内cAMP和心肌酶浓度影响细胞的能量代谢,导致心肌细胞受损,且与毒素浓度呈正相关。另外与蛋白质结合的尿毒症毒素,如硫酸吲哚酯和对甲酚硫酸盐可通过ROS、ERK或p38MAPK依赖性途径刺激血管平滑肌细胞的增殖,进而促进冠状动脉粥样硬化的发展[7],综上所述,尿毒症毒素的蓄积是导致心肌损害的重要因素,促进了尿毒症心肌病的发生和发展。
尿毒症毒素除了作用于心血管系统,亦常作用于胃肠道,可引起长期的食欲不振、恶心呕吐等消化系统并发症,加之尿毒症患者以促氧化过程为特征的全身性慢性炎症状态的病理基础,极易导致低蛋白血症及营养不良,而两者已经被证实是尿毒症患者死亡的重要危险因素和预测因子[8],并且可能是以心血管系统为靶点威胁尿毒症患者生存,其作用机制一方面通过激活肾素-血管紧张素-醛固酮系统(RASS)活性、提高交感神经反应性进而加重心肌负荷[9],另外可通过炎症反应状态促进冠状动脉粥样硬化的发展[10],因此低蛋白血症与尿毒症性心肌病的发生亦密切相关,正如本试验结果所示,白蛋白、总蛋白在病例及对照组有统计学意义,其中总蛋白升高是尿毒症性心肌病的保护性因素。但有学者提出低蛋白血症与炎症反应对尿毒症性心肌病的影响不能截然分清,甚至有些试验结果提示了炎性反应的贡献度似乎更大,由于本试验所收集临床指标内容有限,未包括C反应蛋白等相关炎症因子,尚不能针对氧化应激对尿毒症性心肌病的发病影响得出明确结论,仍有待于大量临床研究的证明。
钙磷代谢紊乱是尿毒症患者的常见并发症之一,主要表现为低钙高磷,其发病过程与小肠钙吸收减少,同时肾脏1-α羟化酶缺乏导致活性维生素D合成减少相关,后随着肾小球滤过率的下降,血磷浓度逐渐升高,并形成磷酸钙沉积于软组织导致异位钙化,使血钙进一步降低,另一方面可通过刺激甲状旁腺激素的分泌介导激活成纤维细胞,启动心肌间质的纤维化,引起血压升高、心肌缺血及心血管钙化等改变[11],最终导致慢性肾功能衰竭患者心血管疾病特别是尿毒症性心肌病的发生。本组资料显示,病例组血钙浓度显著低于对照组(P<0.05),血磷整体水平高于对照组,且多因素分析中OR值明显大于1,说明是高磷血症的暴露与尿毒症性心肌病的发病存在相关性,但其水平无统计学差异,考虑一方面可能与患者磷结合剂的使用相关,另一方面可能由样本量相对不足所致,需进一步扩大样本量进而深入研究。
另外作为心血管疾病传统危险因素的低密度脂蛋白、甘油三酯、胆固醇等,对尿毒症性心肌病发病过程中的作用在本次试验统计数据方面未能得到统计学差异。高脂血症是引起动脉粥样硬化导致缺血性心脏病的主要因素,而是否以心肌肥厚为主要病理基础的尿毒症性心肌病的独立危险因素,目前相关大样本临床研究结果相对缺乏,故尚不能完全除外脂代谢异常对尿毒症性心肌病发病的影响作用。
本试验为单中心小样本研究,纳入临床指标内容有限,且回顾性研究中遗漏的信息无法弥补,均可导致分析误差发生,尽管如此,结合既往大量临床研究,毒素蓄积、低蛋白血症、钙磷代谢紊乱等危险因素仍提示尿毒症性心肌病高风险。因此明确并积极防治UCM的危险因素,对延缓尿毒症性心肌病的发生发展,最终提高患者生存质量、减少病死率有重要意义。
| [1] | Semple D, Smith K, Bhandari S, et al. Uremic cardiomyopathy and insulin resistance:a critical role for akt[J]. J Am Soc Nephrol, 2011, 22 (2): 207–215. DOI:10.1681/ASN.2009090900 |
| [2] | 肖芳, 杨新萍, 宋苏云, 等. 彩色多普勒超声心动图在尿毒症心肌病诊断中的应用[J]. 医学临床研究, 2007, 24 (11): 1967–1968. DOI:10.3969/j.issn.1671-7171.2007.11.058 |
| [3] | 李爱莉, 柯元南, 曾玉杰, 等. 尿毒症维持性血液透析患者左心室构型和功能的超声心动图研究[J]. 中华心血管病杂志, 2009, 37 (10): 913–916. DOI:10.3760/cma.j.issn.0253-3758.2009.10.013 |
| [4] | Peterson GE, De Backer T, Contreras G, et al. Relationship of left ventricular hypertrophy and diastolic function with cardiovascular and renal outcomes in African Americans with hypertensive chronic kidney disease[J]. Hypertension, 2013, 62 (3): 518–525. DOI:10.1161/HYPERTENSIONAHA.111.00904 |
| [5] | 杨可, 赵景宏. 尿毒症心肌病的研究进展[J]. 局解手术学杂志, 2013, 22 (6): 656–658, 662. DOI:10.11659/jjssx.1672-5042.201306032 |
| [6] | 刘春艳, 贾长绪. 尿毒症血清对大鼠心肌损害的研究[J]. 中华肾脏病杂志, 1999, 15 (2): 49–50. |
| [7] | Shunsuke I, Masayuki Y. Protein-bound uremic toxins:new culprits of cardiovascular events in chronic kidney disease patients[J]. Toxins (Basel), 2014, 6 (2): 665–678. DOI:10.3390/toxins6020665 |
| [8] | 刘淑娟. 尿毒症心肌病回顾性分析及毒乃清防治尿毒症心肌病大鼠实验研究[D]. 广州: 广州中医药大学, 2005. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y737859 |
| [9] | Silva Fernanda C, de Menezes Rodrigo C, Deoclécio A, Chianca Jr, et al. The implication of protein malnutrition on cardiovascular control systems in rats[J]. Front Physiol, 2015, 6 : 246. |
| [10] | 杜春荔, 杨秉潜. 尿毒症微炎症状态与营养不良心血管并发症的影响因素分析[J]. 中西医结合心脑血管病杂志, 2017, 15 (20): 2618–2620. DOI:10.3969/j.issn.1672-1349.2017.20.035 |
| [11] | 麻鹏磊, 王祥, 李冰, 等. 尿毒症心肌病的研究及临床治疗进展[J]. 中国老年学杂志, 2016, 36 (9): 2294–2297. |
2. Graduate School of Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China
 2018, Vol. 35
2018, Vol. 35