1. 北京中医药大学中医学院, 北京 100029;
2. 天津国际生物医药联合研究院, 天津 300457;
3. 北京中医药大学东直门医院, 北京 100700;
4. 北京中医药大学东方医院, 北京 100078
收稿日期:2017-12-16
基金项目:北京中医药大学基本科研业务费自主选题项目(在读研究生项目,2017-JYB-XS011)
作者简介:刘群英(1992-), 男, 硕士研究生在读, 从事中西医结合肿瘤治疗研究。
恶性淋巴瘤(ML)原发于淋巴结或结外淋巴组织,分为霍奇金淋巴瘤(HL)和非霍奇金淋巴瘤(NHL)两大类。临床常见浅表淋巴结弹性肿大,常与皮肤不粘连,可累及多处淋巴结,一般无痛性,临床上出现的少数疼痛,多是由于压迫神经引起。20世纪,欧美以及中国等国家的淋巴瘤病死率已经进入癌症病死率前10位,近年来其发病率有上升趋势[1]。目前主要有化疗、放疗、手术以及造血干细胞移植等临床手段治疗淋巴瘤,对各种生物靶向制剂和化疗药物的耐药性使得淋巴瘤的治疗过程中副反应明显,容易复发而且病死率高[2-3]。针对淋巴瘤的一些西药的疗效并不明显,治疗过程中常表现为易复发,化疗敏感性差,预后不良[4-5]。既往认为外周T细胞性淋巴瘤的标准治疗方案是CHOP方案(环磷酰胺+多柔比星+长春新碱+泼尼松)或者是CHOP类化疗方案,这种方案除了对间变性大细胞淋巴瘤(淋巴瘤激酶阳性)疗效突出外,对其他外周T细胞性淋巴瘤的疗效并不突出,应用此方案治疗的淋巴瘤患者,其3 a总生存期率仅为52%[6]。不理想的治疗效果使得医学工作者加强基础研究,积极探寻淋巴瘤的病因和机制,但其机制至今都未完全阐明。在淋巴瘤分子生物学机制研究进展中,经典Wnt/β-catenin信号通路、程序性死亡因子(PD-1)/程序性死亡因子配体1(PD-L1)信号通路、cAMP信号通路、Notch信号通路等等,与淋巴瘤发病机制密切相关,其中PD-1/PD-L1信号通路尤为引人关注[7]。
古方消瘰丸,源于《医学心悟》,由贝母、牡蛎、玄参三味药1:1:1组成,是中医基于消瘰散结法治疗恶性淋巴瘤的常用方。有学者在对中医药治疗淋巴瘤常用方剂的整理研究中发现,消瘰丸在中医治疗淋巴瘤常用方剂中使用率居首位[8]。同时在临床中发现,消瘰丸对淋巴瘤确实具有比较积极的疗效[9-10]。但该方究竟对T/B细胞免疫调节中哪些环节起作用以及其作用机制尚不明确。本实验初步探究消瘰丸治疗淋巴瘤T细胞在PD-1/PD-L1信号通路上的调控机制。
1 材料与方法
1.1 材料
1.1.1 细胞
正常人淋巴细胞外周血由北京红十字会血站提供,淋巴瘤患者外周血来自北京中医药大学东直门医院淋巴瘤患者。正常人和淋巴瘤患者淋巴细胞外周血用Fico/Lite LymphoH淋巴细胞分离液得到外周血单个核细胞(PBMC),然后调整成细胞数为5×106/mL的细胞悬液。
1.1.2 主要试剂与仪器
消瘰丸制剂(北京中医药大学东直门医院加工制备为细胞培养用制剂)、细胞培养液(10 000 U/mL青链霉素双抗0.1%、L-谷氨酰胺1%、RPMI-1640培养基89.9%、胎牛血清10%)、Fico/Lite LymphoH淋巴细胞分离液、CCK8检测试剂盒(日本同仁化学研究所)、Cell Trace CFSE细胞增殖试剂盒(Invitrogen公司)、PE-PD-1(e Bioscience公司)、Fitc-PD-L1(e Bioscience公司)、Fitc-CD4(e Bioscience公司)、Fitc-CD8(e Bioscience公司)、APC-CD69(e Bioscience公司)、APC-CD20(e Bioscience公司)、APC标记的鼠抗人Isotype(e Bioscience公司)、T/B生长刺激剂、1640培养基(Invitrogen公司)、流式细胞仪(Becton Dickinson公司,FACS Calibur)。其他为常用试剂。
1.2 方法
1.2.1 分离淋巴细胞
健康人与淋巴瘤患者外周血收集后,经肝素抗凝,用Fico/Lite LymphoH淋巴细胞分离液得到外周血单个核细胞(PBMC),用1640细胞培养液调整成细胞悬液,细胞数为5×106/mL。
1.2.2 CCK8检测细胞活性
接种的细胞悬液(每孔100 μL)于96孔板中,将培养板放在37 ℃、5%CO2孵育箱中预培养4 h,分别加入消瘰丸溶液不同梯度浓度,在其他条件相同的情况下培养36 h,然后培养板每孔加入20 μL CCK8再次培育1 h后,用酶标仪测定其吸光度,观察细胞增殖情况,计算OD值。根据OD值来选择最适浓度。为保证实验的可靠性,重复至少3次实验。
1.2.3 CFSE标记
将2 μL 5 mmol/L Cell Trace CFSE溶于18 μL二甲基亚砜DMSO,制成2.5 mmol/L CFSE储存液。向1 mL健康人和淋巴瘤患者的PBMC细胞悬液中分别加入2 μL CFSE储存液,37 ℃、5%CO2孵育箱染色10 min,用RPMI-1640培养基洗2次,弃尽液体,然后用800 μL细胞培养液制成细胞悬液,接种于96孔板中,每孔200 μL,每例各两孔。
1.2.4 细胞刺激、培养与标记
向每例两孔中的一孔中加入2 μL消瘰丸(0.01 g/L),另一孔中加入10 μL PD-L1抗体,各孔中加入PHA刺激。在37 ℃,体积分数为5%CO2培养箱中培养72 h,磷酸盐缓冲液(PBS)洗涤1次,用100 μL PBS混悬细胞。将细胞悬液接种于96孔板中,每孔100 μL,加入5 μL不同细胞表面活性抗体(CD4、CD8、CD69、Isotye、CD20),用PBS洗涤2次。
1.2.5 流式细胞仪(FCM)测定
以APC标记的鼠抗人Isotype标记的细胞为阴性对照,在流式细胞仪上以488 nm为第一激光、633 nm为第二激光激发荧光,在513 nm带通滤镜进行FITC标记的测定,在575 nm带通滤镜进行PE标记的测定,在660 nm带通滤镜进行APC标记的测定。通过BD Cell Quest Pro软件分析数据,以APC-CD20阳性细胞设定门,选定T细胞作为检测细胞,以CFSE通道的组合观察CD4+ T细胞、CD8+ T细胞增殖情况,及消瘰丸干预后CD4+ T细胞、CD8+ T细胞增殖的变化。
2 结果
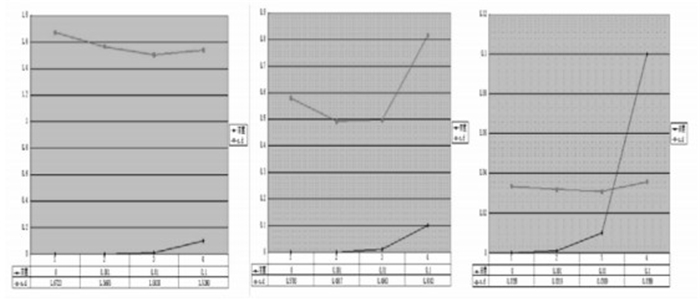
2.1 消瘰丸对淋巴细胞的作用以及最适浓度
已知CCK8检测原理,OD值越大,细胞数目越多,故浓度和OD值成负相关。如图 1所示消瘰丸药物干预淋巴细胞,抑制细胞的活性,其最适浓度约为0.01 g/L。
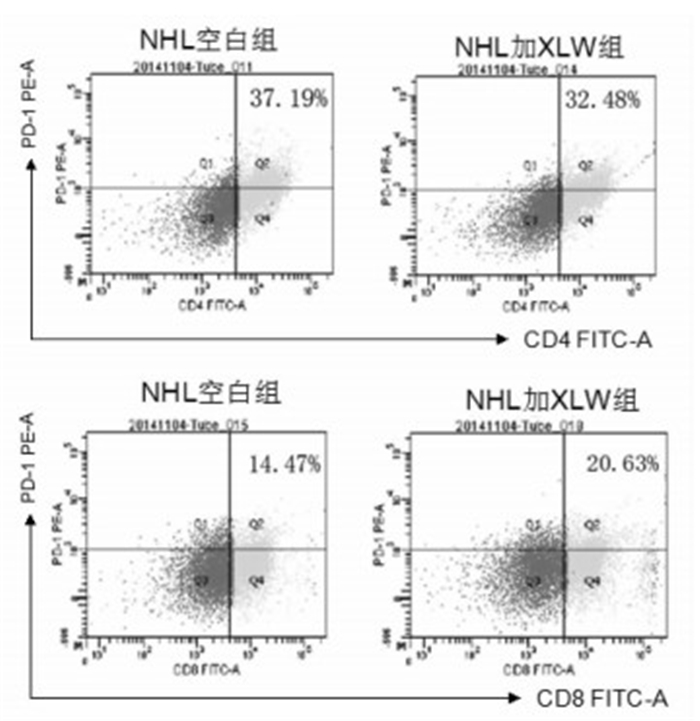
2.2 消瘰丸干预T细胞淋巴瘤CD4+细胞与CD8+细胞PD-1表达变化
如图 2所示,T淋巴瘤细胞在消瘰丸干预下,CD4+ T细胞PD-1(+)表达下降而CD8+ T细胞PD-1(+)表达升高,由于CD8+ T细胞是具有细胞毒性的淋巴细胞,说明消瘰丸对T淋巴瘤细胞大量异常增殖的T细胞中PD-1/PD-L1信号通路存在影响,可以抑制CD4+ T细胞膜表面PD-1(+)的高表达,并提高CD8+ T细胞膜表面PD-1(+)的表达。
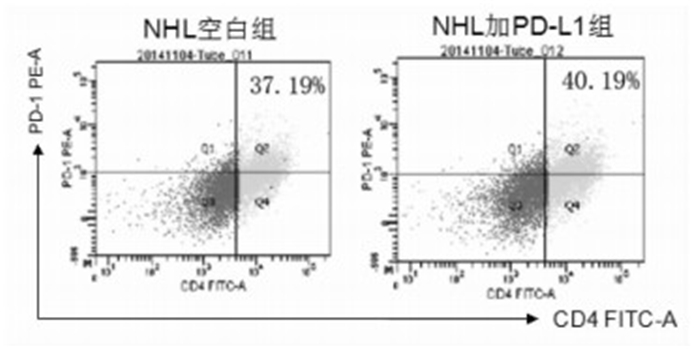
2.3 T细胞淋巴瘤淋巴细胞阻断成功检验
加入PD-1配体阻断剂后,CD4+ T细胞PD-1表达增高,说明CD4+ T细胞中,与PD-L1结合的PD-1位点更多地暴露出来,故PD-1(+)表达增加,说明阻断剂有效,阻断成功,如图 3所示。
2.4 消瘰丸干预T细胞淋巴瘤CD4+和CD8+细胞活性变化
CD69可产生细胞内信号传导及多种免疫反应,是一种Ⅱ型跨膜糖蛋白,在激活的淋巴细胞上表达,是淋巴细胞活化的细胞表面标志物。
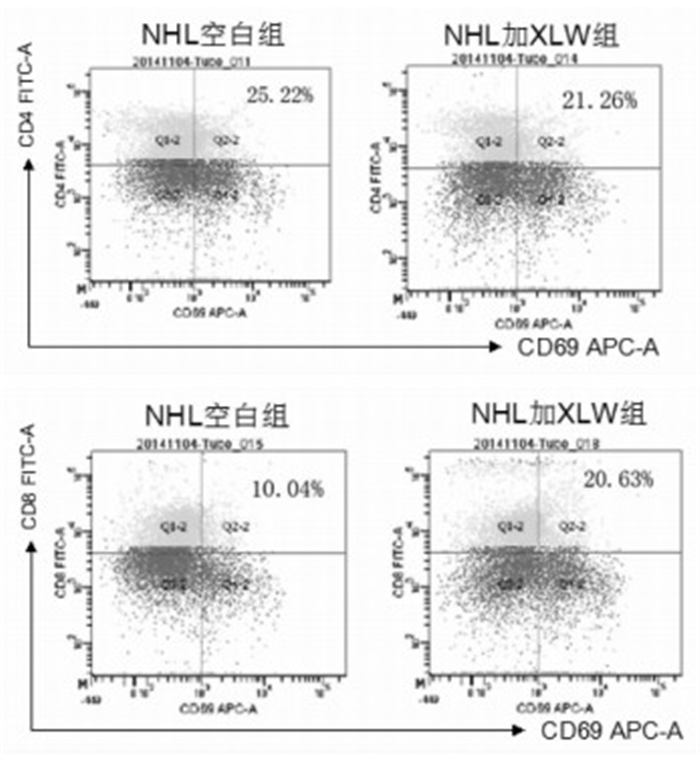
2.4.1 消瘰丸干预T细胞淋巴瘤CD4+和CD8+细胞活性作用
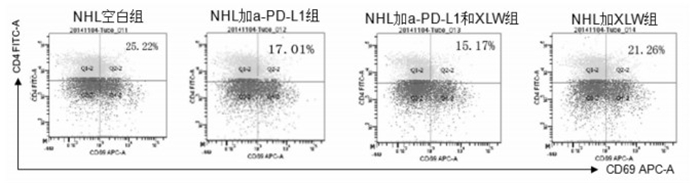
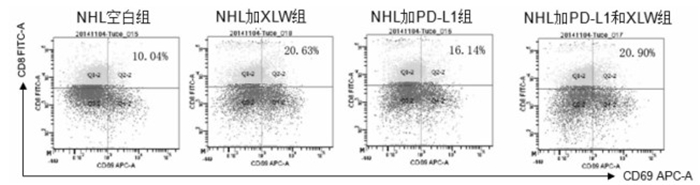
如图 4所示,加入消瘰丸后T淋巴瘤细胞中CD4+ T淋巴细胞CD69表达降低,而CD8+T淋巴细胞CD69表达升高。由于CD69是T细胞表面活性的标记,CD69表达降低,说明消瘰丸对T细胞淋巴瘤大量异常增殖的T淋巴细胞中CD4+细胞活性有抑制作用而对有细胞毒作用的CD8+细胞活性有增强作用。
2.4.2 消瘰丸对T细胞淋巴瘤CD4+细胞活性干预作用与PD-1/PD-L1通路相关性
阻断PD-1配体同时加入消瘰丸,对比单纯阻断PD-1配体和单纯加入消瘰丸,T淋巴瘤细胞中CD4+ T淋巴细胞CD69表达降低的更为明显,实验结果显示阻断PD-1配体,大量PD-1受体暴露后,加入消瘰丸对T细胞淋巴瘤大量异常增殖的T淋巴细胞中CD4+细胞CD69抑制作用比单纯阻断PD-1配体和单纯加入消瘰丸都明显。说明消瘰丸对T细胞淋巴瘤大量异常增殖的T淋巴细胞中CD4+细胞活性的抑制作用可以通过PD-1/PD-L1起作用,结果如图 5所示。
2.4.3 消瘰丸对T细胞淋巴瘤CD8+细胞活性干预作用与PD-1/PD-L1通路相关性
具有细胞毒作用的CD8+ T细胞,加入阻断剂或者加入消瘰丸后其活性增加,加入消瘰丸的作用更为明显,而同时加入两者,与单独加入消瘰丸组相比,增加并不明显。说明消瘰丸可以通过调节CD8+亚群的活性,但不能认为对于CD8+亚群所有细胞活性的调节与PD-1/PD-L1通路相关。见图 6。
2.5 消瘰丸干预T细胞淋巴瘤PD-1(+)淋巴细胞活性变化
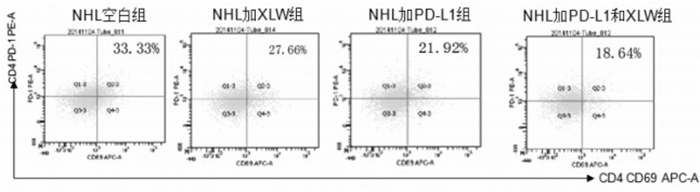
2.5.1 消瘰丸干预对CD4+ PD-1(+)细胞活性的变化
CD4+ PD-1(+)细胞是CD4+细胞中启动了死亡程序的异常细胞,这部分细胞的活性降低意味着其对于T细胞淋巴瘤患者机体负面影响的减弱。如图 7所示,单独加入消瘰丸或者PD-L1阻断剂可以降低CD4+ PD-1(+)细胞活性(CD69表达),而同时加入两者,其活性下降更为明显,说明消瘰丸与PD-L1阻断剂两者对于CD4+ PD-1(+)细胞活性(CD69表达)有协同降低的作用,消瘰丸降低CD4+ PD-1(+)细胞活性的作用除了PD-1/PD-L1通路外还有其他通路的参与。
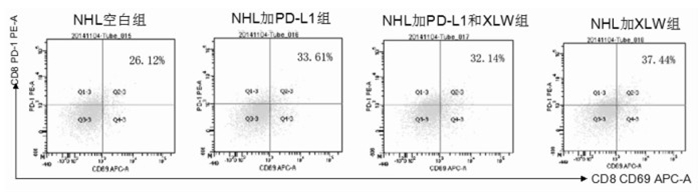
2.5.2 消瘰丸干预对CD8+ PD-1(+)细胞活性的变化
CD8+具有细胞毒作用,能够有效地清除与抗原相关的目标细胞,在T细胞淋巴瘤的免疫调控中具有积极意义。CD8+ PD-1(+)细胞是CD8+细胞中启动了死亡程序、状态不佳的细胞,这类细胞活性的增强能够更有效的清除异常细胞。实验结果如图 8所示,单独加入消瘰丸或者PD-L1阻断剂可以增加CD8+ PD-1(+)细胞活性(CD69表达),而二者联合使用后,其活性增加较单独加入消瘰丸或者PD-L1阻断剂都低,说明消瘰丸对于CD8+ PD-1(+)细胞活性(CD69表达)的增加与PD-1/PD-L1通路相关,并且与PD-1的配体PD-L1有依赖作用。
2.5.3 消瘰丸对T细胞淋巴瘤CD4+/CD8+比值的影响
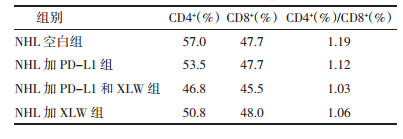
CD4+/CD8+比值的下降,说明CD4+ T淋巴细胞减少的同时CD8+ T淋巴细胞增多,这是消瘰丸药物干预的主要调节作用,而其中的主要信号通路是通过PD-1/PD-L1来实现的。见表 1。
表 1 消瘰丸干预T细胞淋巴瘤CD4+/CD8+比值
Tab. 1 The CD4+/CD8+ ratio of lymphoma T cells investigated by Xiaoluo pill
3 结论
PD-1/PD-L1信号通路在淋巴瘤的机制中发挥着重要作用。PD-1在维持T、B细胞稳态方面有关键性作用,其在淋巴细胞中持续表达,产生的信号抑制T细胞活化和诱导淋巴细胞凋亡,从而使免疫反应下调[11]。研究发现PD-1是相关性T细胞和血管免疫母细胞性T细胞淋巴瘤的标志之一[12],后来陆续有研究表明T细胞淋巴瘤组织中PD-1和PD-L1的表达增高[13-14],而且与患者生存期短、化疗疗效差有关,是T细胞淋巴瘤患者化疗疗效差及预后不良的指标[15-16]。PD-1/PD-L1信号通路与T细胞功能损伤有关[17],在多数血液肿瘤中如B细胞淋巴瘤、伯基特淋巴瘤、结外NK/T细胞淋巴瘤等中存在PD-1/PD-L1信号通路异常活化[18]。2014年1月,有学者提出应用PD-1抗体来治疗淋巴瘤[19],但PD-1抗体作为单一靶点治疗的安全性和有效性尚待进一步评估。
目前治疗ML多采用联合化疗,部分Ⅰ、Ⅱ期患者化疗、放疗结合使用,Ⅲ、Ⅳ期以化疗为主,这种疗法可使部分恶性淋巴瘤患者存活较长,但对中、高度恶性非霍奇金淋巴瘤患者的疗效并不明显。疗效差的原因可能与T淋巴瘤细胞高表达免疫抑制分子,从而逃避机体的杀伤有关。那么,对中医药在恶性淋巴瘤治疗中的研究就显得势在必行。
消瘰丸为消瘰散结法的代表方剂,是中医治疗肿瘤的常用方剂之一,在以免疫功能障碍为主要特征的淋巴瘤免疫治疗中发挥着重要作用。免疫治疗的目的之一是激活特异性T细胞的杀伤潜力,PD-1和PD-L1均为免疫负调控因子,前者表达于T细胞表面,后者表达于肿瘤细胞表面,两者结合后可抑制肿瘤特异性T细胞的激活。笔者研究发现,消瘰丸对T淋巴瘤细胞大量异常增殖T细胞中PD-1/PD-L1通路存在影响,对于大量异常增殖CD4+ T细胞可以抑制活性,抑制PD-1(+)表达,消瘰丸与PD-L1阻断剂两者对于CD4+ PD-1(+)细胞活性(CD69表达)有协同降低的作用,说明消瘰丸降低CD4+ PD-1(+)细胞活性的作用有PD-1/PD-L1通路的参与,同时还有其他通路的参与。消瘰丸对于有细胞毒作用的CD8+ T细胞活性有增强作用,可以促进PD-1(+)的表达。消瘰丸对于CD8+ PD-1(+)细胞亚群活性(CD69表达)的增加与PD-1/PD-L1通路相关,并且与PD-1的配体PD-L1有依赖作用。
通过此次研究,课题组初步认为消瘰丸对淋巴瘤的免疫调节紊乱具有积极的调控作用。这为中医药消瘰散结法对于免疫相关肿瘤的治疗具有初步的示范探索意义。
Mechanism research on the treatment of lymphoma with Xiaoluo pill based on PD-1/PD-L1 signaling pathway
1. Beijing University of Chinese Medicine, Beijing 100029, China;
2. Tianjin International Joint Academy of Biomedicine, Tianjin 300457, China;
3. Dongzhimen Hospital of Beijing University of Traditional Chinese Medicine, Beijin 100700, China;
4. Dongfang Hospital of Beijing University of Traditional Chinese Medicine, Beijin 100078, China
 2018, Vol. 35
2018, Vol. 35