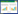文章信息
- 赵福成, 韩艳茹, 贾奎, 刘彩莉, 刘振洲
- ZHAO Fucheng, HAN Yanru, JIA Kui, LIU Caili, LIU Zhenzhou
- 青蒿素联合厄洛替尼对肺癌细胞生物学行为的影响
- Effects of artemisinin combined with erlotinib on lung cancer cells
- 天津中医药, 2018, 35(5): 392-396
- Tianjin Journal of Traditional Chinese Medicine, 2018, 35(5): 392-396
- http://dx.doi.org/10.11656/j.issn.1672-1519.2018.05.17
-
文章历史
- 收稿日期: 2017-12-18
肺癌是全球癌症相关死亡的最常见原因。每年约有1 800万人被诊断患有肺癌,约有1 600人死于该疾病[1]。根据其癌症分级和发病地区的不同,肺癌总体的5年生存率约为4%~17%[2]。肺癌的治疗方式主要包括手术、放疗、化疗、经皮消融和姑息治疗等[3]。它是一类异质性极高的恶性肿瘤[4],根据其组织病理学的差异,目前肺癌的分类分型已超过50种[5]。由于不同类型的肺癌具有不同的遗传,生物和临床特征,对不同治疗的反应性也不尽相同,所以对肺癌的分类治疗是很有必要的,以确保肺癌患者获得最佳的治疗方式[6]。
近年来,为了治疗晚期肺癌,学者们已经研发了多种分子靶向疗法。例如吉非替尼(Iressa),其靶点为表皮生长因子受体(EGFR)的酪氨酸激酶结构域,它在许多非小细胞肺癌中都有表达[7]。埃罗替尼(Tarceva)是另一种EGFR酪氨酸激酶抑制剂,2004年被美国食品和药品管理局(FDA)批准用于晚期非小细胞肺癌的二线治疗,与吉非替尼类似,它似乎在女性、亚洲人、非吸烟者和支气管肺泡癌患者中效果更好,特别是对于EGFR有特异突变的患者[8]。
厄洛替尼也是一种用于治疗非小细胞肺癌(NSCLC)的靶向药物。它是作用于表皮生长因子受体(EGFR)的酪氨酸激酶抑制剂。FDA批准厄洛替尼用于治疗局部晚期或转移性非小细胞肺癌。无论肺癌患者是否有EGFR突变,厄洛替尼均能改善其生存时间,但在EGFR突变患者中效果更好,无进展生存期和5年生存率与标准二线治疗(多西他赛或培美曲塞)相似,总体反应率较标准二线化疗提高了约50%[9]。与其他ATP竞争性小分子酪氨酸激酶抑制剂(如CML中的伊马替尼)一样,使用厄洛替尼的患者在治疗开始8~12个月内会迅速发展抗药性。超过50%的抗药性是由EGFR激酶区域的ATP结合区的突变引起的,主要是由于非极性甲硫氨酸残基(T790M)取代极性苏氨酸残基所致。虽然“守门人”突变假说的支持者表明这种突变阻止厄洛替尼通过空间位阻的结合,但研究表明T790M赋予ATP结合亲和力的增加,从而降低厄洛替尼的抑制功效[10-11]。
青蒿素是从黄花蒿中提取出来的一种晶状体,青蒿素及其半合成衍生物是治疗疟疾的首选药物[12]。青蒿素及其衍生物已被证明具有一定的抗肿瘤效应,它能参与细胞一系列的生理生化过程,能抑制肿瘤细胞的增殖,促进细胞凋亡,诱导氧化应激和抗血管生成作用[13]。
本研究使用A549细胞株进行青蒿素和厄洛替尼联合应用,通过检测A549细胞活力和凋亡情况,以及药物对小鼠成瘤的影响,探究蒿素联合厄洛替尼对NSCLC的治疗的潜在可能。
1 方法 1.1 细胞系和试剂人肺癌细胞株A549由上海细胞生物研究所提供。RPMI-1640培养液、10%新生小牛血清、含100 μg/mL青霉素和100 μg/mL链霉素的0.25%胰酶溶液购自Gibco公司,分析纯二甲基亚砜(DMSO)购自Sigma公司。细胞在含有10%FBS、100 μg/mL青霉素和100 μg/mL链霉素的培养基中,37 ℃环境下在5%CO2培养箱中培养,生长至80%左右浓度时进行传代和冻存,用于后续的实验。细胞培养瓶和96孔板购自杭州四季庆生物工程材料有限公司。
1.2 药物和试剂青蒿素购自Sigma公司。厄洛替尼购自罗氏公司。将厄洛替尼溶解于DMSO,配置为终浓度为2.5×104μmol/L的溶液,分装保存于-20 ℃冰箱备用,加药时用PBS溶液(pH7.2)稀释至目标浓度。CCK-8试剂盒购于日本同仁研究所。Annexin V-FITC/PI双染法细胞凋亡检测试剂盒购于上海美季生物技术有限公司。
1.3 细胞活性的测定使用CCK-8试剂盒测定细胞的活性。将A549细胞接种在96孔板中,每孔1×104个细胞。在37 ℃、5%CO2的培养箱中孵育24 h。更换新培养基,将样品置入处理组和对照组中。处理组中的细胞用0.5、1、2.5、5、10或20 μg/mL青蒿素和/或厄洛替尼处理24 h。处理后,将96孔板中的培养基用新鲜培养基替换。然后加入20 μL的CCK-8溶液,并在37 ℃下孵育4 h。使用酶标仪板在490 nm波长下测量不同组的OD值。
1.4 细胞凋亡实验检测A549细胞的凋亡流式细胞术FITC-Annexin V/PI双染色被认为是理想的定量测定细胞凋亡的方法。将A549细胞以2×106的密度接种在6孔板中细胞/孔并生长24 h。然后单独用青蒿素处理(10 μg/mL),单独用厄洛替尼(10 μg/mL)或青蒿素(10 μg/mL)+厄洛替尼(10 μg/mL)处理24 h。加入100 μL细胞悬液5 μL Annexin V-FITC和10 μL PI,并将细胞在黑暗中孵育30 min。PI(5 μL,浓度为10 μg/mL)加入细胞,在黑暗中再次孵育10 min。通过流式细胞术评估细胞以识别细胞周期的变化。细胞增殖指数按照下列公式计算:PI%=(S+G2/M)/(G0/G1+S+G2/M)。
1.5 体内动物实验通过A549细胞建立小鼠成瘤模型来研究青蒿素和厄洛替尼在体内是否有抑癌的作用。总共选取了35只雄性BALB/c裸鼠(年龄6~8周;体质量约等于25 g),小鼠喂养在25℃和70%相对湿度的环境下,同时给予12 h光照/黑暗循环。所有小鼠的饮水及饲料都经过高温高压处理。首先建立小鼠成瘤模型。将含有2×106 A549细胞的100 μL PBS溶液皮下注射到每只老鼠的背部,每两天测量一次肿瘤的体积,测量公式如下:肿瘤体积=0.5×长轴×短轴2。同时每两天测量1次小鼠的质量。当肿瘤体积达到约100 mm3时,将小鼠分为5组(每组7只)进行不同处理,分组如下:1)对照组(无注射)。2)生理盐水组,每只小鼠用100 μL的生理盐水进行肿瘤内注射。3)青蒿素组,每只小鼠接受15 mg/kg青蒿素的肿瘤内注射。4)厄洛替尼组,每只小鼠接受15 mg/kg厄洛替尼的肿瘤内注射。5)联合治疗组,每只小鼠接受15 mg/kg青蒿素+15 mg/kg厄洛替尼的肿瘤内注射。
1.6 统计分析统计学处理采用SPSS 19.0统计学软件进行统计分析,实验数据以均数±标准差(x±s)表示,组间比较采用单因素方差分析,组间两两比较采用LSD法,重复测量资料采取重复测量方差分析,以P<0.05为差异有统计学意义。
2 结果 2.1 青蒿素和厄洛替尼对A549细胞活性的影响CCK-8是常用的检测细胞活力的方法。如表 1所示,随着青蒿素和厄洛替尼浓度的升高,A549的细胞活性随之下降。用不同浓度的青蒿素(DHA)单独处理细胞24 h后,细胞活性在45%~95%之间;用不同浓度的厄洛替尼(DOX)单独处理细胞24 h后,细胞活性在42%~94%之间。使用青蒿素和厄洛替尼联合治疗后,细胞活力降低达到91%。当10 μg/mL青蒿素和10 μg/mL厄洛替尼的组合处理细胞时,在细胞活力下降了89%,与5 μg/mL青蒿素+5 μg/mL厄洛替尼的组合有统计学差异(P<0.05),而20 μg/mL青蒿素+20 μg/mL厄洛替尼的组合无统计学差异(P>0.05)。因此,将10 μg/mL青蒿素加10 μg/mL厄洛替尼作为最佳的浓度。
|
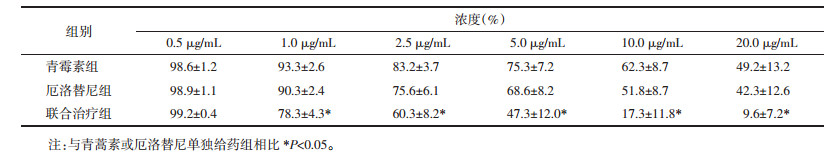
为了进一步验证青蒿素和厄洛替尼所诱导的细胞死亡形式是凋亡,选择使用流式细胞术检测的annexin V-FITC/PI双标记法。如图 1所示,各组的凋亡率分别为3.1%±1.9%、50.2%±4.6%、41.2%±3.5%、28.7%±5.5%、90.2%±2.5%。在用青蒿素+厄洛替尼对A549细胞处理后,凋亡细胞的百分比从3%(对照)增加到90%(24 h),但坏死细胞的增加并不明显。阳性对照组(STS)显示Q2+Q4代表了细胞凋亡。在使用青蒿素或厄洛替尼单独处理的细胞中,也存在细胞凋亡,但联合用药组的凋亡率高于单独用药组(P < 0.01)。
|
| 图 1 青蒿素和厄洛替尼对细胞凋亡的影响。 Fig. 1 Effects of artemisinin and erlotinib on cell apoptosis. |
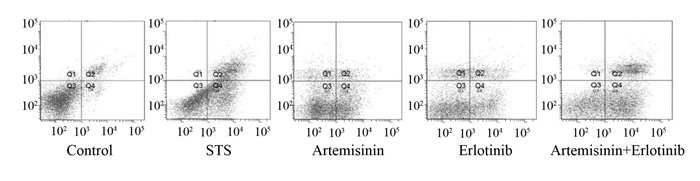
本研究对小鼠体内肿瘤注射不同的药物,通过评估肿瘤体积的改变来评估药物对肿瘤的治疗效果。在接种细胞4~7 d后,肿瘤开始形成,所有小鼠均成功成瘤。肿瘤形成的早期小鼠一般情况无明显差异,体质量、精神、摄食等未将显著变化。随着肿瘤的增大,小鼠的精神和活动逐渐变差,各组间无明显的差异,整个实验过程中,小鼠无死亡。联合治疗组在使用青蒿素+厄洛替尼处理小鼠后各时点均对肿瘤有显著的抑制增长作用,与对照组和生理盐水组比较差异具有统计学意义(P<0.01)。见表 2。
|
药物的体内毒性一直是临床关注的问题。通过监测给药后小鼠体质量的变化来判断药物的毒性作用。如表 3所示,与对照组相比,小鼠的体质量均缓慢上升,无论是单独用药还是联合用药,均无统计学差异。结果说明药物对小鼠无明显毒性作用。
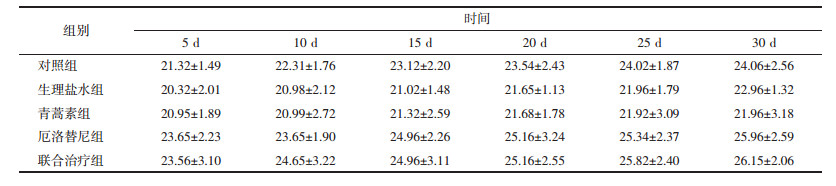
|
青蒿素及其衍生物,作为一种从中草药中提取的物质,在具有强大抗疟功效的同时也被证实有一定的改善免疫系统的作用和抗肿瘤作用[14-16]。抗肿瘤作用包括增强药物的选择性,扭转多重耐药性,对放化疗的增敏作用等。许多的青蒿素衍生物都被合成用来治疗多种肿瘤,包括乳腺癌、前列腺癌、卵巢癌、头颈部肿瘤、肺癌、胃癌、肝细胞肝癌、胰腺癌、肾癌、骨肉瘤、胶质细胞瘤和白血病。这些衍生物的作用在体内外实验中得到了相应证实[17]。Park等发现青蒿素对乳腺癌细胞有一定细胞毒性作用,但却不杀伤正常的乳腺细胞[18]。最初的研究者认为青蒿素产生抗肿瘤作用主要是因为产生了活性氧类(ROS)。随着研究的深入,学者们发现还存在着其他与活性氧类无直接联系的抗肿瘤机制,例如它能诱导凋亡与自噬,使细胞周期停滞和细胞增殖的减少,改变的肿瘤相关基因表达,抑制肿瘤血管生成等[13]。
酪氨酸激酶受体(RTKs)在肺癌中起到关键的作用。通过使用小分子酪氨酸激酶抑制剂(TKIs)吉非替尼和厄洛替尼,治疗晚期非小细胞肺癌(NSCLC)。厄洛替尼特异性针对表皮生长因子受体(EGFR)酪氨酸激酶,这种酶在多种肿瘤及其突变体中高度表达。它可以以可逆的方式与磷酸三腺苷(ATP)的结合位点结合。对于信号的传导,需要由两个EGFR分子聚集在一起形成同型二聚体,然后使ATP分子在产生的磷酸酪氨酸残基上发生互相磷酸化,将磷酸酪氨酸结合蛋白募集到EGFR上,组装后将信号级联传递到到细胞核上或激活其他细胞生化过程。当厄洛替尼与EGFR结合时,EGFR与磷酸酪氨酸残基的形成被阻断,从而不启动级联信号的传递[19]。
对于EGFR激酶结构域突变(通常为L858R)和外显子19缺失的患者,他们对吉非替尼/厄洛替尼的反应性较好。尽管一项大型的Ⅲ期的临床试验(NCIC-BR.21)证实[20],厄洛替尼可以延长肺癌患者的生存期,但大多数未经过基因筛选的肺癌患者仍然对厄洛替尼敏感性较差。基因型为野生型EGFR的肺癌患者往往从一开始就对厄洛替尼无反应,突变型EGFR的初始应答者也有可能发展为二次药物抵抗。所以对于厄洛替尼无效或效果不佳的肺癌患者,需要寻找一种新的途径来解决问题[9]。
在实验设计中,首先通过使用不同浓度的青蒿素和厄洛替尼对A549细胞的作用,来筛选抑制该细胞活性的最佳浓度组合,最终发现联合使用青蒿素和厄洛替尼,比单独使用这两种之一能更有效抑制细胞的活性,对细胞的杀伤作用更强。凋亡在肿瘤的发展和进展具有重要的生物学意义。众多化疗药物通过诱导产生肿瘤细胞凋亡以达到抗肿瘤作用。既往的研究发现,青蒿素可以通过内源性途径诱导细胞凋亡[21]。本实验的第2个实验探究青蒿素和厄洛替尼是否能诱导细胞凋亡中使用流式细胞术来确定细胞死亡的模式。最终结果表明,在青蒿素+厄洛替尼处理后,A549细胞的凋亡率达到90%。这证明了青蒿素和厄洛替尼能协同促进A549细胞凋亡。
在体内实验中,研究了青蒿素和厄洛替尼对小鼠体内肿瘤的治疗效果。肿瘤内注射越来越多地被应用于治疗肿瘤[22]。在本研究中,笔者使用肿瘤内注射治疗荷瘤小鼠,并观察到青蒿素和厄洛替尼联合用药对肿瘤的抑制作用显著。
综上所述,青蒿素和厄洛替尼对A549细胞的抑制上表现出协同性。同时青蒿素和厄洛替尼通过诱导肿瘤细胞凋亡来达到对肿瘤的抑制作用。体内实验中,联合使用青蒿素和厄洛替尼对肿瘤的抑制有显著的效果。这项研究的结果对肺癌的治疗方案提供了一种新的思路。
| [1] | Torre LA, Siegel RL, Ward EM, et al. Global cancer incidence and mortality rates and trends-an update[J]. Cancer Epidemiology and Prevention Biomarkers, 2016, 25 (1): 16–27. DOI:10.1158/1055-9965.EPI-15-0578 |
| [2] | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015[J]. Cancer Journal for Clinicians, 2015, 65 (1): 5–29. DOI:10.3322/caac.21254 |
| [3] | 白玉梅, 卢保华. 非小细胞肺癌治疗进展[J]. 山西医药杂志, 2013, 42 (7): 767–768. |
| [4] | Fisher R, Pusztai L, Swanton C. Cancer heterogeneity:implications for targeted therapeutics[J]. British Journal of Cancer, 2013, 108 (3): 479. DOI:10.1038/bjc.2012.581 |
| [5] | Travis WD, Asamura H, Bankier AA, et al. The IASLC Lung Cancer Staging Project:proposals for coding T categories for subsolid nodules and assessment of tumor size in part-solid tumors in the forthcoming eighth edition of the TNM classification of lung cancer[J]. Journal of Thoracic Oncology, 2016, 11 (8): 1204–1223. DOI:10.1016/j.jtho.2016.03.025 |
| [6] | Janakiram M, Pareek V, Cheng H, et al. Immune checkpoint blockade in human cancer therapy:lung cancer and hematologic malignancies[J]. Immunotherapy, 2016, 8 (7): 809–819. DOI:10.2217/imt-2016-0001 |
| [7] | Kazandjian D, Blumenthal GM, Yuan W, et al. FDA approval of gefitinib for the treatment of patients with metastatic EGFR mutation-positive non-small cell lung cancer[J]. Clinical Cancer Research, 2016, 22 (6): 1307–1312. DOI:10.1158/1078-0432.CCR-15-2266 |
| [8] | Cook JR, O'Brien ME, Siddique M, et al. Non-small cell lung cancer treated with erlotinib:heterogeneity of 18F-FDG uptake at PET-association with treatment response and prognosis[J]. Radiology, 2015, 276 (3): 883–893. DOI:10.1148/radiol.2015141309 |
| [9] | Trusolino L. Oncogenic MET as an effective therapeutic target in non-small cell lung cancer resistant to EGFR Inhibitors:The Rise of the Phoenix[J]. Cancer discovery, 2016, 6 (12): 1306–1308. DOI:10.1158/2159-8290.CD-16-1181 |
| [10] | Johnson ML, Yu HA, Hart EM, et al. Phase I/Ⅱ study of HSP90 inhibitor AUY922 and erlotinib for EGFR-mutant lung cancer with acquired resistance to epidermal growth factor receptor tyrosine kinase inhibitors[J]. Journal of Clinical Oncology, 2015, 33 (15): 1666–1673. DOI:10.1200/JCO.2014.59.7328 |
| [11] | Balak MN, Gong Y, Riely GJ, et al. Novel D761Y and common secondary T790M mutations in epidermal growth factor receptor-mutant lung adenocarcinomas with acquired resistance to kinase inhibitors[J]. Clinical Cancer Research, 2006, 12 (21): 6494–6501. DOI:10.1158/1078-0432.CCR-06-1570 |
| [12] | 郑全芳, 杨志刚, 孙红祥. 青蒿素及其衍生物药理作用研究进展[J]. 中国畜牧兽医文摘, 2013, 29 (5): 71–71. |
| [13] | 黄相丽, 姚云峰. 青蒿素抗肿瘤作用机制研究进展[J]. 山东医药, 2015, 55 (30): 97–98. DOI:10.3969/j.issn.1002-266X.2015.30.043 |
| [14] | Houh YK, Kim KE, Park S, et al. The effects of artemisinin on the cytolytic activity of natural killer (NK) cells[J]. International journal of molecular sciences, 2017, 18 (7): 1600. DOI:10.3390/ijms18071600 |
| [15] | Sun Q, Teong B, Chen IF, et al. Enhanced apoptotic effects of dihydroartemisinin-aggregated gelatin and hyaluronan nanoparticles on human lung cancer cells[J]. Journal of Biomedical Materials Research Part B:Applied Biomaterials, 2014, 102 (3): 455–462. DOI:10.1002/jbm.b.v102.3 |
| [16] | Posobiec LM, Clark RL, Bushdid PB, et al. Dihydroartemisinin (DHA) treatment causes an arrest of cell division and apoptosis in rat embryonic erythroblasts in whole embryo culture[J]. Birth Defects Research Part B:Developmental and Reproductive Toxicology, 2013, 98 (6): 445–458. DOI:10.1002/bdrb.2013.98.issue-6 |
| [17] | Das AK. Anticancer effect of antimalarial artemisinin compounds[J]. Annals of Medical and Health Sciences Research, 2015, 5 (2): 93–102. DOI:10.4103/2141-9248.153609 |
| [18] | Posobiec LM, Clark RL, Bushdid PB, et al. Dihydroartemisinin (DHA) treatment causes an arrest of cell division and apoptosis in rat embryonic erythroblasts in whole embryo culture[J]. Birth Defects Research Part B:Developmental and Reproductive Toxicology, 2013, 98 (6): 445–458. DOI:10.1002/bdrb.2013.98.issue-6 |
| [19] | Raymond E, Faivre S, Armand JP. Epidermal growth factor receptor tyrosine kinase as a target for anticancer therapy[J]. Drugs, 2000, 60 (1): 15–23. |
| [20] | Gregorc V, Novello S, Lazzari C, et al. Predictive value of a proteomic signature in patients with non-small-cell lung cancer treated with second-line erlotinib or chemotherapy (PROSE):a biomarker-stratified, randomised phase 3 trial[J]. The Lancet Oncology, 2014, 15 (7): 713–721. DOI:10.1016/S1470-2045(14)70162-7 |
| [21] | Li-Weber M. Targeting apoptosis pathways in cancer by Chinese medicine[J]. Cancer Letters, 2013, 332 (2): 304–312. DOI:10.1016/j.canlet.2010.07.015 |
| [22] | Mehta HJ, Begnaud A, Penley AM, et al. Treatment of isolated mediastinal and hilar recurrence of lung cancer with bronchoscopic endobronchial ultrasound guided intratumoral injection of chemotherapy with cisplatin[J]. Lung Cancer, 2015, 90 (3): 542–547. DOI:10.1016/j.lungcan.2015.10.009 |
 2018, Vol. 35
2018, Vol. 35