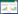文章信息
- 廉富, 苏景深, 刘恩顺, 郑莉, 赵鑫民, 陈善夫
- LIAN Fu, SU Jingshen, LIU Enshun, ZHENG Li, ZHAO Xinmin, CHEN Shanfu
- 通腑泻肺方对ALI/ARDS大鼠AQP1/a-ENaC表达的影响
- Effect of Tongfu Xiefei recipe on the expression of AQP1/a-ENaC in ALI/ARDS rats
- 天津中医药, 2018, 35(6): 442-444
- Tianjin Journal of Traditional Chinese Medicine, 2018, 35(6): 442-444
- http://dx.doi.org/10.11656/j.issn.1672-1519.2018.06.12
-
文章历史
- 收稿日期: 2018-05-02
2. 天津市津南区咸水沽医院, 天津 300073;
3. 天津中医药大学, 天津 300193
急性肺损伤(ALI)和急性呼吸窘迫综合征(ARDS)是一种炎症反应, 多种炎症介质和细胞因子参与发病, 失控的炎症反应损伤肺泡毛细血管内皮细胞和肺泡上皮细胞, 导致肺水清除能力下降, 肺含水量增加, 形成肺水肿, 气体交换障碍, 从而导致严重低氧血症[1]。水通道蛋白(AQPs)是一组在哺乳动物体内表达的水选择通道的分子家族, 可以增强浆膜面水通透力的功能, 因而可以提供快速液体转运的通路[2]。肺上皮细胞钠通道(ENaC)由α、β和γ 3个亚型组成, 广泛分布于肺Ⅰ型[3]和Ⅱ型[4]上皮细胞, 是肺泡腔水肿液清除(AFC)的关键作用环节。本研究探讨了内毒素(LPS)诱导的急性肺损伤大鼠模型中AQP1和a-ENaC蛋白的表达调节及通腑泻肺中药干预的作用。
1 材料 1.1 动物健康SD大鼠27只, 雄性, 体质量(200±20) g, 购自北京维通利华实验动物技术有限公司(许可证号:SCXX(京)2012-0001), 购入后置天津工程所实验中心常规饲养。
1.2 药物及试剂通腑泻肺方(葶苈子、桑白皮、大黄、枳实、厚朴)中药颗粒剂, 购自天津中医药大学第二附属医院药房。大肠杆菌内毒素脂多糖购自Sigma公司。AQP1抗体购自Abcam公司, 批号:Ab11025;a-ENaC抗体购自Proteintech公司, 10924-2-AP。免疫组化试剂盒购自北京中杉金桥生物公司。
2 方法 2.1 ALI/ARDS模型的建立及分组给药动物购入后适应性饲养1周, 将大鼠按体质量随机分为空白组、模型组、中药组, 每组9只。模型组与中药组于左侧尾静脉注射内毒素8 mg/kg, 复制ALI/ARDS模型。正常对照组大鼠静脉注射生理盐水。对照组与模型组在造模完成后即用生理盐水灌服, 每次0.01 mL/g。治疗组在造模完成后给予通腑泻肺中药灌胃, 每次0.01 mL/g, 每日1次, 共7 d。
2.2 镜下观察给药1周后, 取右肺下叶, 应用10%甲醛溶液进行固定, 常规石蜡切片, 进行苏木精-伊红(HE)染色检测。光镜下观察, 比较分析各组大鼠肺组织病理学改变。
2.3 免疫组化染色方法检测检测肺组织AQP1和a-ENaC的表达将组织切片行脱蜡、水化处理后, 高压修复抗原, 用3%过氧化氢溶液消除内源性过氧化酶, 血清封闭后各组切片分别加入兔源性AQP-1、a-ENaC多克隆抗体(均为1:100稀释), 4℃过夜后加入兔二抗, 经二氨基联苯胺(DAB)显色, 光镜下观察。AQP-1、a-ENaC的阳性反应产物均呈棕黄色。光学显微镜下随机观察5个视野、拍照, 代表该动物肺组织AQP-1、a-ENaC的蛋白表达强度。应用Image-Pro Plus6.0软件分析阳性细胞数, 同时将空白对照组阳性细胞率设置为100%, 计算其他组别的阳性细胞率, 并对结果进行统计分析。
2.4 统计学方法采用SPSS19.0统计软件包进行统计分析, 数据以均数±标准差(x±s)表示。多组比较用单因素方差分析, 组间两两比较采用Newman-Keuls检验, P < 0.05为差异具有统计学意义。
3 结果 3.1 肺组织病理学表现空白组大鼠肺组织光镜下可见大部分肺泡结构正常、充盈良好, 无肺泡萎陷; 少部分肺泡间隔增宽、充血、少量淋巴细胞浸润, 未见肺泡萎陷; 灶性肺间质、细支气管周少量淋巴细胞浸润。模型组大鼠肺组织光镜下可见广泛肺泡萎陷, 肺泡间隔增宽、充血、较多淋巴、中性粒细胞、巨噬细胞浸润, 局部呈实性。部分肺泡腔可见少量红细胞、淋巴、中性粒及巨噬细胞渗出; 部分细支气管及终末细支气管周可见大量淋巴细胞浸润、淋巴组织增生。中药组大鼠肺组织镜下大部分肺泡结构正常、充盈良好, 无肺泡萎陷; 部分肺泡间隔增宽、充血、纤维组织增生, 较多淋巴细胞为主的炎细胞浸润, 可见肺泡萎陷; 偶见细支气管周灶性淋巴细胞浸润, 见图 1。
|
| 图 1 大鼠肺组织形态学改变(SP, ×100) Fig. 1 Histology changes of lung in rats(SP, ×100) |
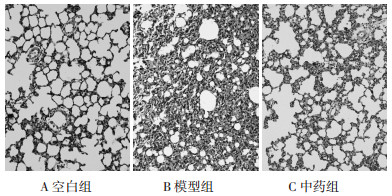
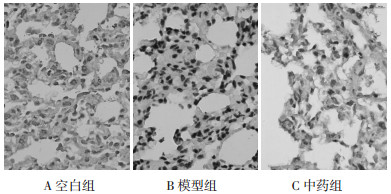
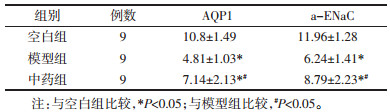
空白组大鼠肺组织中AQP1和a-ENaC均呈高水平表达, AQP1主要分布在肺组织微血管的内皮细胞膜, 以及少部分分布在肺上皮细胞膜, 见图 2。a-ENaC主要分布在肺泡细胞膜, 见图 3。与空白组比较, 模型组可见AQP1表达显著下降(P < 0.01);中药组经过治疗干预后, AQP1表达增强, 差异具有统计学意义(P < 0.05)。与空白组比较, 模型组可见a-ENaC表达显著下降(P < 0.01);中药组经过治疗干预后, a-ENaC表达增强, 差异具有统计学意义(P < 0.01)。见表 1。
|
| 图 2 AQP1在肺组织的分布与表达(SP, ×400) Fig. 2 Distribution and expression of AQP1 in lung tissue(SP, ×400) |
|
| 图 3 a-ENaC在肺组织的分布及表达(SP, ×400) Fig. 3 Distribution and expression of a-ENaC in lung tissue(SP, ×400) |
|
ALI/ARDS状态下肺微血管的通透性增高, 肺泡上皮受损, 导致大量血管内液渗透到肺间质及肺泡内, 引起肺泡内及肺间质大量肺水形成的高通透性水肿[5]。研究发现的AQPs包括AQP 0~12共13种亚型。其中, AQP-1主要分布于微血管内皮细胞、支气管周围血管床、气管黏膜、淋巴管、胸膜和Ⅱ型肺泡上皮细胞[6]。敲除AQP1基因的小鼠肺泡毛细血管通透性较野生型发生显著改变, 肺泡毛细血管膜屏障通透性下降10倍左右[7]。ENaC通过主动吸收肺泡腔内的钠离子实现的肺泡液体吸收主要途径, 是肺水肿清除的决定因素[8]。ENaC主动转运将肺泡腔内的钠离子转运入肺泡Ⅱ型细胞内, 随后位于基底膜的钠/钾ATP酶再将钠离子转运至肺间质, 其中主动转运为肺水肿液清除提供了源动力, 将肺水肿液体继发性主动转运至间质, 并通过静脉和淋巴回流, 从而减轻肺水肿。整个转运过程中90%的跨膜转运阻力存在于ENaC中, 因此ENaC是肺泡腔内钠水重吸收的限速步骤[9]。a-ENaC基因敲除小鼠因肺水肿液清除能力低下而在出生后死于ARDS[10]。
通腑泻肺方药源自中医学"肺与大肠相表里"理论, 肺与大肠通过经脉相连, 两者在生理功能上相互协调, 而在发生病理变化时又相互影响。通腑用小承气汤, 方中大黄具有破积聚、荡涤胃肠等功效。厚朴行气散满, 枳实破气消痞, 诸药合用, 可以轻下热结, 除满消痞。泻肺用葶苈子, 性大寒, 味辛、苦, 归肺、膀胱经, 功能泻肺平喘, 行水消肿; 桑白皮, 甘寒入肺, 功能泻肺平喘, 利水消肿。上述两者合用为通腑泻肺方, 既可泻肺平喘, 又能通腑泻热, 肺肠同治。前期研究发现通腑泻肺方可以明显减轻ALI/ARDS大鼠炎症因子水平的表达, 减轻肺部的炎症反应[11-12]。
实验结果发现, 通腑泻肺中药组肺组织病理损伤减轻, 免疫组化方法检测发现其可上调肺组织AQP1和a-ENaC表达。提示通腑泻肺中药减轻ALI/ARDS大鼠肺水肿的机制可能在于其提高AQP1和a-ENaC表达, 促进肺水肿的吸收, 为临床治疗提供了新思路。
| [1] | Huang B, Wang DX, Deng W. Protective effects of dexamethasoneon early acute lung injury induced by oleic acid in rats[J]. Int J Clin ExpMed, 2014, 7 (12): 4698–4709. |
| [2] | Borgnia M, Nielsen S, Engel A, et al. Cellular and molecularbiology of the Aquaporin water channel[J]. Annu RevBiochem, 1999, 68 : 425–458. |
| [3] | Borok Z, Liebler JM, Lubman RL, et al. Na transportproteins are expressed by rat alveolar epithelial type I cells[J]. Am J Physiol Lung Cell Mol Physio, 2002, 282 (4): L599–L608. DOI:10.1152/ajplung.00130.2000 |
| [4] | Talbot CL, Bosworth DG, Briley EL, et al. Quantitationand localization of ENa C subunit expression in fetal, new-born, and adult mouse lung[J]. Am J Respir Cell Mol Bi-ol, 1999, 20 (3): 398–406. DOI:10.1165/ajrcmb.20.3.3283 |
| [5] | Johnson ER, Matthay MA. Acute lung injury:epi-demiology, pathogenesis, and treatment[J]. J Aerosol MedPulm Drug Deliv, 2010, 23 (4): 243. DOI:10.1089/jamp.2009.0775 |
| [6] | Ablimit A, Hasan B, Lu W, et al. Changes in waterchannel aquaporin 1 and aquaporin 5 in the smallairways and the alveoli in a rat asthma model[J]. Micron, 2013, 45 : 68–73. DOI:10.1016/j.micron.2012.10.016 |
| [7] | Bai C, Fukuda N, Song Y, et al. Lung fluid transport in aquapor-in-1 and aquaporin-4 knockout mice[J]. J Clin Invest, 1999, 103 (4): 555–561. DOI:10.1172/JCI4138 |
| [8] | Matalon S, O'Brodovich H. Sodium channels in alveolarepithelial cells:molecular characterization, biophysicalproperties, and physiological significance[J]. Annu RevPhysiol, 1999, 61 : 627–661. |
| [9] | Chen HI, Yeh DY, Liou HL, et al. Insulin attenuates endotoxin-induced acute lung injury in conscious rats[J]. Crit Care Med, 2006, 34 (3): 758–764. DOI:10.1097/01.CCM.0000201902.37115.22 |
| [10] | Hummler E, Barker P, Gatzy J, et al. Early death due todefective neonatal lung liquid clearance in alpha-ENa C-de-ficient mice[J]. Nat Genet, 1996, 12 (3): 325–328. DOI:10.1038/ng0396-325 |
| [11] | 杨英伟, 刘恩顺. 急性肺损伤/急性呼吸窘迫综合征中医病因病机及辨证分型的研究进展[J]. 辽宁中医杂志, 2013, 56 (9): 1937–1939. |
| [12] | 刘恩顺, 孙增涛, 苏景深, 等. 急性肺损伤/急性呼吸窘迫综合征肺肠相关证候特征及其演变的临床调查[J]. 中华中医药杂志, 2013, 28 (10): 3125–3127. |
2. Tianjin Jinnan District Xianshuigu Hospital, Tianjin 300073, China;
3. Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China
 2018, Vol. 35
2018, Vol. 35