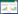文章信息
- 王莎莎, 曲竹秋
- WANG Shasha, QU Zhuqiu
- 速效救心丸对动脉粥样硬化大鼠血脂、主动脉形态及主动脉壁ABCA1表达的影响
- Effects of Suxiao Jiuxin pill on the blood lipid, the pathologic change of arteria aorta and the expression of ABCA1 of arteria aorta in rats of atherosclerosis
- 天津中医药, 2018, 35(6): 445-449
- Tianjin Journal of Traditional Chinese Medicine, 2018, 35(6): 445-449
- http://dx.doi.org/10.11656/j.issn.1672-1519.2018.06.13
-
文章历史
- 收稿日期: 2017-12-25
2. 天津医科大学总医院中医科, 天津 300052
速效救心丸由川芎、冰片等组成, 具有活血化瘀、行气止痛的作用。临床多用于治疗冠心病心绞痛的急性发作, 在临床20余年的应用中, 大量药理临床试验证明速效救心丸具有抗动脉粥样硬化(AS)作用。本实验将采用高脂饮食加大剂量钙负荷方法建立大鼠AS模型, 观察不同剂量速效救心丸对于AS大鼠血脂变化, 通过透射电镜观察其对主动脉病理形态学影响, 并应用免疫组织化学方法, 探讨速效救心丸对脂代谢途径的影响, 观察主动脉壁ABCA1的表达情况。
1 材料 1.1 动物采用2~3月龄健康清洁级SD大鼠60只, 雄性, 体质量(256±20) g。由中国医学科学院放射医学研究所实验动物中心提供。饲养于天津医科大学动物实验中心标准化饲养房。
1.2 药物速效救心丸由天津中新药业第六中药厂惠赠; 阿托伐他汀由美国辉瑞制药有限公司生产; 维生素D3注射液, 由上海通用药业生产。
2 方法 2.1 动物造模大鼠动脉粥样硬化模型制备参照文献[1]方法加以改进, 采用一次性腹腔注射60万U/kg维生素D3, 并同时予以高脂饲料(配方:基础饲料配方中添加2%胆固醇、0.5%胆酸钠、0.2%丙基硫氧嘧啶、5%白糖、10%猪油)喂养12周后, 抽样检测大鼠主动脉, 以发现AS斑块为造模成功。
2.2 动物分组与给药将60只大鼠适应性饲养1周后称取体质量, 采用随机区组方法分成6组, 每组10只。正常组:基础饲料饲养, 灌胃用生理盐水每天0.5 mL/100 g; 模型组:灌胃用生理盐水每天0.5 mL/100 g、速效救心丸低剂量组、中剂量组、高剂量组及西药组所用药量:根据临床成人常用量, 按照体重系数折合成大鼠用量:速效救心丸低、中、高剂量组分别为:60 mg/kg、600 mg/kg、1 800 mg/kg, 阿托伐他汀:4 mg/kg。按大鼠0.5 mL/100 g灌胃量, 将上述药物溶于蒸馏水, 每日灌胃1次, 连续灌胃12周。
2.3 血脂的测定于实验第12周末最后1次灌胃后, 禁食12 h于次日晨将全部动物股动脉放血处死, 留取血标本, 分离血清, 全自动生化分析仪测定总胆固醇(TC)、甘测三酯(TG)、高密度脂蛋白(HDL)和低密度脂蛋白(LDL)。
2.4 主动脉电镜标本制备观察大鼠处死后迅速解剖, 分离主动脉弓至髂总动脉分叉处的整条主动脉, 仔细剔除血管外脂肪及结缔组织, 剪取主动脉弓, 冷生理盐水洗去血管壁内外血迹, 切取(1×1) mm3动脉环3个, 经过常规前固定、清洗、后固定、清洗、脱水、浸透、包埋、聚合、超薄切片、电子染色、用日立H-7500型透射电子显微镜观察、照相。
2.5 免疫组化标本制备及测定步骤于主动脉弓下缘水平切取主动脉长约1~2 cm, 冷生理盐水洗去血管壁内外血迹后, 置入10%福尔马林溶液中固定24 h后, 常规脱水、透明、浸蜡、包埋、连续切片厚度4 μm, 40℃恒温水浴捞片, 贴于普通载玻片上, 供免疫组化用。SABC法, 阳性表达均以棕黄色或褐色颗粒为准, Frank半定量计分法进行判定。染色面积以百分率计分, ≤ 5%为0分, 6%~25%为1分, 26%~50%为2分, 51%~75%为3分, ≥ 76%为4分; 按着色强度计分, 无着色为0分, 淡黄色为1分, 棕黄色为2分, 棕褐色为3分。将两个评分相乘所得的染色分数进行半定量分析, 每例随机观察5个高倍视野, 取其平均值作为半定量结果。
2.6 统计方法采用SPSS 19.0统计学软件对数据进行处理, 实验结果采用均数±标准差(x±s)表示, 多组间比较采用单因素方差分析, 组间两两比较采用LSD法, P < 0.05为差异有统计学意义。
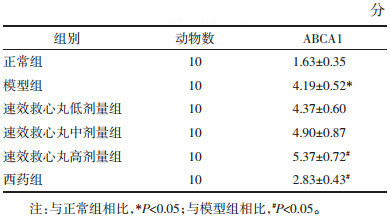
3 结果 3.1 血脂及AI值变化检测结果见表 1。实验结果表明, 与模型组相比, 速效救心丸中、高剂量组和西药组可降低血清TC、TG和LDL含量及AI值, (P < 0.05), 速效救心丸高剂量组和西药组可以升高血清HDL水平(P < 0.05)。而低剂量组对血脂各项指标则无明显影响(P>0.05)。
|
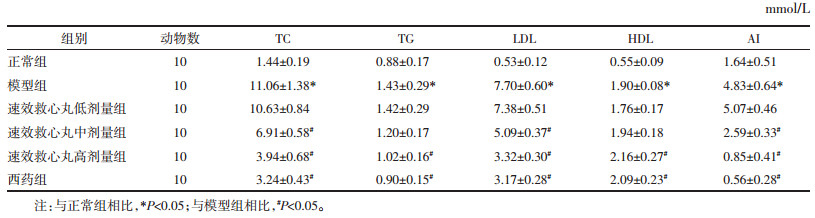
结果见图 1。正常组主动脉内膜薄, 内皮细胞扁平, 表面较平滑, 呈长梭形, 细胞器结构正常, 细胞间连接紧密, 内皮下间隙较小, 无脂质沉积, 内弹力板完整连续; 中膜平滑肌细胞(SMC)大小均匀, 核形态规则, 细胞器结构正常。模型组主动脉内膜增厚明显, 不光滑, 不连续, 内皮细胞微绒毛缺失, 大部分细胞膜缺失, 细胞质外溢到管腔, 只剩下少量细胞质, 为祼核, 内皮细胞间连接破坏, 部分内皮细胞及细胞质内有许多脂滴, 大小不等, 呈圆形或椭圆形, 电子密度不等, 多数细胞膜破损、缺失, 内皮细胞内线粒体大部分嵴融合或消失, 粗面内质网扩张呈圆形或椭圆形, 有的明显扩张呈池状, 有严重脱颗粒现象, 吞饮小泡明显减少, 几乎看不到, 内皮下间隙宽窄不一, SMC迁入内皮下间隙。低剂量组主动脉超微结构与模型组相似, 无显著改善。中剂量组、高剂量组及西药组主动脉内膜增厚明显减轻, 内皮细胞较完整, 细胞间连接尚可, 内皮下间隙较小, 均匀一致, 偶可见少量脂滴, 内弹力板尚连续; SMC向内皮下迁移明显减少。

|
| 图 1 各组AS大鼠主动脉透射电子显微镜结果 Fig. 1 Electron microscope examination of rats in each group |
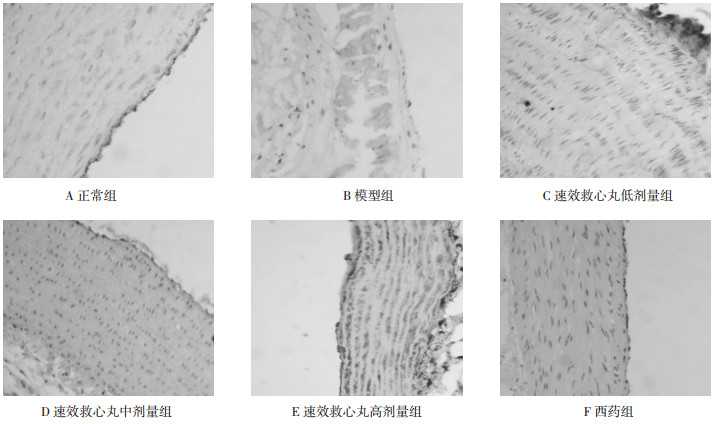
结果见表 2、图 2。单纯从染色分数数值上来看, 速效救心丸低、中、高剂量组ABCA1表达均有所上升, 与模型组相比, 低、中剂量差异没有统计学意义(P>0.05), 而高剂量组差异有统计学意义(P < 0.05)。而阿托伐他汀降低ABCA1的表达, 与模型组相比, 差异有统计学意义(P < 0.05)。
|
| 图 2 各组大鼠主动脉ABCA1表达结果(×200) Fig. 2 Expression of ABCA1 on aorta in each group of rats(×200) |
AS的病因及发病机制虽尚未完全阐明, 但脂肪代谢紊乱所致的高脂血症已被公认为是AS发病的重要危险因素。高脂血症可致内皮细胞损伤或灶状脱落, 导致血管壁通透性增高, 血浆脂蛋白进入内膜, 引起巨噬细胞的消除反应和平滑肌细胞增殖, 从而促进AS的形成[2]。故调节血脂对于抗AS有着重要的意义。
中医学中并没有AS之称, 但从其所表现的症状可将其归于中医中"胸痹"、"真心痛"等病证的范畴。中医学认为本病病位在脉, 与心密切相关, 血脉瘀阻是其基本病理特征, 因此活血化瘀成为中医治疗AS的主要方法。速效救心丸由川芎、冰片等药物组成, 川芎辛温, 入肝胆经, 为血中气药, 能"上行头目", "下行血海", 具有祛风止痛, 行气开郁, 活血化瘀的功效, 且秉升散之性; 冰片辛苦、凉, 入心肺经, "性善走窜开窍, 无往不达", 具有行气活血, 通窍止痛之功效。川芎、冰片两药合用, 性味归经相互配合, 相得益彰, 具有活血化瘀, 行气止痛的功效。问世20余年来, 大量药理实验证明速效救心丸具有改善微循环、保护心肌细胞和血管内皮细胞等作用。临床主要用于治疗冠心病、心绞痛、高血压等心脑血管疾病及急性腹痛等各种痛证, 长期使用, 能明显改善心功能, 降低心绞痛发作[3]。药理实验发现速效救心丸的有效成份川芎/川芎嗪能明显降低实验性AS家兔及载脂蛋白E缺陷(ApoE-/-)小鼠血清TG、TC水平, 有效改善主动脉AS病变[4-6]。
在以往研究的基础上, 本次实验观察了速效救心丸不同剂量预防性给药后, 对于AS大鼠血脂水平的影响。其中以速效救心丸高剂量调脂作用更为明显。阿托伐他汀是选择性竞争HMG-COA还原酶抑制剂, 具有良好的调脂作用。经过大规模的临床试验表明, 他汀类药物在有或没有冠心病的患者可显著减少心血管相关的发病率和死亡率[7]。目前他汀类药物已成为抗AS的一线用药。速效救心丸高剂量的调脂作用与阿托伐他汀作用没有明显差异(P>0.05)。病理形态学观察亦发现速效救心丸中、高剂量和阿托伐他汀, 能够逆转AS的病理变化, 对于内皮细胞的损伤, 平滑肌细胞的增殖和迁移均有良好的抑制作用。
ABCA1是ABC转运体超家族成员之一, 其在胆固醇的逆向转运、胆固醇代谢以及高密度脂蛋白代谢过程中起着极其重要的调节作用, 被称为胆固醇逆转运的守门人。肝X受体(LXR)与视黄酸X受体(RXR)是核激素受体蛋白质超家族成员, 两者可结合形成LXR/RXR异二聚体转移到ABCA1基因启动子的识别序列DR-4上, 从而诱导ABCA1基因的转录, 是ABCA1表达的天然调控因子。阳性对照组阿托伐他汀组与速效救心丸高剂量组降脂效果没有明显差异, 但阿托伐他汀组对大鼠主动脉ABCA1表达并无明显影响。有研究表明, 他汀类药物可以抑制氧化类固醇的合成, 氧化类固醇正是LXRα的重要配体, 在与LXRα结合后, 可促进ABCA1基因的转录。他汀类药物正是通过抑制LXRα氧化类固醇配体的合成, 间接抑制LXR靶基因ABCA1的表达, 从而抑制胆固醇的外流[8-9]。Zanotti等[10]研究发现他汀类药物仅仅通过cpt-cAMP诱导ABCA1表达的条件下, 才能抑制ABCA1介导的胆固醇和磷脂的外流。Argmann等[11]却发现他汀药物可以增强LXR/RXR的活性, 增强ABCA1的表达, 促进细胞内胆固醇的外流。上述几项研究的实验材料、方法及他汀类药物均有所不同, Zanotti等[10]认为这可能与甲羟戊酸衍生物对ABCA1活性的双相效应有关, 一方面, 他汀类药物诱导的作为强效LXRα激动剂, 24, 25-环氧胆固醇的消耗活化了LXR途径的ABCA1, 另一方面, 他汀类药物导致的甲羟戊酸合成的类异戊二烯产物的消耗, 致使ABCA1阻抑途径的抑制。因此目前他汀类药物对LXR途径的最终效应尚不清楚, Qiu等[12]推断他汀类药物对LXR途径的作用可能是通过依赖细胞内甲羧戊酸途径中类异戊二烯和非异戊二烯的平衡或其他途径而实现的。ABCA1的功能及其通路非常复杂, 他汀类药物对ABCA1的作用及通过何种途径调节ABCA1需要更深入的研究。本实验中观察到速效救心丸高剂量可以诱导ABCA1转运体的表达, 从而促进胆固醇逆转运过程的进行, 提高血浆中HDL的水平, 降低外周组织和血液中LDL和胆固醇的水平, 从而减轻主动脉粥样硬化病理改变。但速效救心丸中剂量亦能够降低血清中TC、TG、LDL水平, 升高HDL含量, 改善主动脉病理变化, 但其主动脉ABCA1表达与模型组相比, 差异并不明显, 可见速效救心丸是通过多途径、多靶点来调节脂质代谢紊乱的, 其通过何种途径调节ABCA1的表达, 发挥调节血脂, 抗AS的作用, 仍需进一步研究探索。
| [1] | 杨鹏远, 芮耀诚, 焦亚斌. 动脉粥样硬化大鼠实验模型的建立[J]. 第二军医大学学报, 2003, 24 (7): 802. |
| [2] | Ross R. Atherosclerosis an inflammatory disease[J]. N Eng J Med, 1999, 340 (2): 115–126. |
| [3] | 孙世仁, 黄熙, 张菊. 速效救心丸的药动-药效学及临床研究进展[J]. 中草药, 2002, 33 (1): 89–91. |
| [4] | 梅家俊, 蔡大勇, 赵婷秀, 等. 川芎防治动脉粥样硬化症机制的实验研究[J]. 湖北中医学院学报, 2004, 6 (2): 5–7. |
| [5] | 董加喜, 王梅娟, 李映红, 等. 富含川芎脂质体对实验性动脉粥样硬化家兔的降脂和抗氧化作用[J]. 中国中医药科技, 1997, 4 (6): 54. |
| [6] | 徐浩, 文川, 陈可冀, 等. 川芎、赤芍及其有效部位配伍对载脂蛋白E基因缺陷小鼠动脉粥样硬化斑块稳定性影响的研究[J]. 中国中西医结合杂志, 2007, 27 (6): 513–518. |
| [7] | Cannon CP, Braunwald E, McCabe CH, et al. Pitavastatin or atorvastatin evaluation and infection therapy-thrombolysis in myocardial infarction 22 investigators. Intensive versus moderate lipid lowering with statin after acute coronary syndromes[J]. N Engl J Med, 2004, 350 : 1495–1504. DOI:10.1056/NEJMoa040583 |
| [8] | Sone H, Shimano H, Shu M. Statins downregulate ATP-binding cassette transporter A1 gene expression in macrophage[J]. Biochem Biophys Res Commun, 2004, 316 (3): 790–794. DOI:10.1016/j.bbrc.2004.02.121 |
| [9] | Wong J, Quinn CM, Brown AJ. Statins inhibit synthesis of an oxysterol ligand for the liver X receptor in human macrophages with consequences for cholesterol flux[J]. Arterioscler Thromb Vasc Biol, 2004, 24 (12): 2365. DOI:10.1161/01.ATV.0000148707.93054.7d |
| [10] | Zanotti I, Poti F, Favari E, et al. Pitavastatin effect on ATP binding cassette A1-mediated lipid efflux from macrophages:evidence for liver X receptor (LXR)-dependent and LXR independent mechanisms of activation by cAMP[J]. J Pharmacol Exp Ther, 2006, 317 (1): 395–401. |
| [11] | Argmann CA, Edwards JY, Sawyez CG, et al. Regulation of macrophage cholesterol efflux through hydroxymethylglutaryl-COA reductase inhibition[J]. JBC, 2005, 280 (23): 22212–22221. DOI:10.1074/jbc.M502761200 |
| [12] | Qiu G, Hill JS. Atorvastatin inhibits ABCA1 expression and cholesterol effluxin THP-1 macrophages by an LXR-dependent pathway[J]. J Cardiovasc Pharmacol, 2008, 51 (4): 388–395. DOI:10.1097/FJC.0b013e318167141f |
2. Traditional Chinese Medicine Department, Tianjin Medical University General Hospital, Tianjin 300052, China
 2018, Vol. 35
2018, Vol. 35