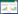文章信息
- 钱颖仪, 刘雁峰
- CHIN Wing Yee, LIU Yanfeng
- 七子益肾理冲汤对DOR大鼠卵巢储备的影响
- Effect of Qizi Yishen Lichong decoction on ovarian reserve in rats model
- 天津中医药, 2018, 35(6): 450-453
- Tianjin Journal of Traditional Chinese Medicine, 2018, 35(6): 450-453
- http://dx.doi.org/10.11656/j.issn.1672-1519.2018.06.14
-
文章历史
- 收稿日期: 2018-04-28
2. 香港浸会大学中医药学院临床部, 香港
卵巢储备功能低下(DOR), 或称卵巢储备功能不足, 是指卵巢内存留的可募集卵泡数量减少, 卵子成熟能力减弱, 卵泡质量下降, 导致女性生育能力下降及性激素缺乏的疾病; 此病患者约占不孕妇女的10%[1]。卵巢的储备功能减退是一个渐进性的过程, 早期发现及诊断卵巢储备功能减退, 及时进行干预, 可以改善女性的生殖潜能, 提高受孕能力及妊娠结局。
七子益肾理冲汤为当代名老中医、妇科名家肖承悰教授所创, 是治疗卵巢储备功能低下及卵巢早衰的经验方。前期临床研究显示, 七子益肾理冲汤改善卵巢早衰妇女月经周期、经期、经色、经质, 亦改善患者烘热汗出、阴道干涩等肾虚血瘀的临床症状[2]。本研究旨在探讨七子益肾理冲汤在卵巢储备功能低下的情况下调治卵巢储备及促进卵泡发育的作用。实验以检测卵泡刺激素(FSH)、雌二醇(E2)及抗穆勒氏管激素(AMH)水平评估七子益肾理冲汤对卵巢储备功能的影响; 病理学改变观察七子益肾理冲汤对模型大鼠卵巢组织损伤的修复情况, 评估七子益肾理冲汤对卵泡凋亡及卵泡发育的影响。
1 材料与方法 1.1 实验动物60只SPF级SD大鼠, 雌性, 8周龄, 200~220 g, 由北京维通利华实验动物技术有限公司提供, 动物生产许可证号SCXK(京)2012-0001。动物适应环境7 d, 自由饮水饮食, 室温(21±2)℃, 湿度(40±10)%, 光照周期12/12 h。进行阴道涂片, 检查动情周期, 连续观察2个动情周期正常纳入实验。
1.2 实验药物七子益肾理冲汤(组成:女贞子15 g, 枸杞子15 g, 菟丝子15 g, 沙苑子15 g, 覆盆子15 g, 桑椹15 g, 香附15 g, 桑寄生15 g, 续断15 g, 巴戟天15 g, 熟地黄15 g, 白芍15 g, 黄芪15 g, 黄精15 g)实验药物为浓缩中药颗粒, 由培力(香港)有限公司生产的农本方中药颗粒, 临用前加双蒸水配成低、中、高浓度的混悬液; 脱氢表雄酮(DHEA)为美国GNC公司生产的25 mg DHEA, 由香港牛奶有限公司旗下万宁购买。DHEA药片研磨, 溶于生理盐水配成混悬液。
1.3 方法 1.3.1 动物分组实验动物共分为6组, 分别为空白组、模型组、中药低剂量组、中药中剂量组、中药高剂量组及西药组(DHEA组)。每组实验动物各10只。
1.3.2 动物模型的建立将所有大鼠编号, 使用随机数字表法将大鼠随机分为两组:空白对照组(空白组)10只、DOR造模组50只。DOR造模组大鼠, 每日于9时定时腹腔注射脱氧乙烯基环己烯(VCD), VCD稀释至浓度约8 mg/mL备用, 每只大鼠根据体质量调整给药量, 每100 g体质量注射1 mL, 连续用药15天。
1.3.3 给药方法低、中、高剂量组的剂量:七子益肾理冲汤每天临床人类的临床用量为0.6 g/kg; 而实验中的低、中、高剂量组的剂量分别相当于临床等效剂量的0.5、1、2倍。大鼠用量计算根据"人和动物体表面积折算的等效剂量比率表"折算。实验药物临用前加双蒸水配成低、中、高浓度的混悬液, 灌胃给药, 每只大鼠按每100 g灌1 mL, 每天1次, 连续15 d(约为3个大鼠动情周期)。西药组:DHEA用量6.75 mg/kg, 经计算用量后, 以DHEA药片研磨及溶于生理盐水至浓度为0.675 mg/mL, 组内大鼠根据体质量灌胃给药, 每100 g灌1 mL, 每天1次, 连续15 d。空白对照组及模型组:按体质量每100 g予1 mL生理盐水灌胃, 每天1次, 连续15 d。
末次给药2 h后, 称取体质量; 大鼠摘眼球取血, 待血液凝固后, 室温下以3 000 r/min离心15 min, 取上清液, 分装于Eppendorf管, -80℃保存备用; 处死大鼠, 摘取双侧卵巢及子宫, 分别测量卵巢及子宫的体积, 在天平上称湿质量后, 一侧卵巢组织液氮保存, 另一侧放于固定液中, 石蜡包埋, 切片备用。
1.4 指标检测1) 计算卵巢指数:卵巢指数=双侧卵巢湿质量(mg)/体质量(g)×100%。2)卵巢组织病理切片:一侧卵巢包埋切片后, 制作苏木精-伊红(HE)病理切片, 后在显微镜下40×、100×及200×观察卵巢显微结构, 并参考卵泡分级标准, 由专业人员阅片, 采用单盲法独立统计, 100×显微镜下进行大鼠卵巢切片标本中的各级卵泡总数、成熟卵泡数及黄体计数。每组观察统计6个卵巢, 每个卵巢观察统计5张切片。3)血清FSH、E2、AMH水平的测定:对大鼠外周血血清, 运用酶联免疫吸附(ELISA)法检测, 使用商业化的放射免疫试剂盒测定每个动物血清样本的FSH、E2、AMH指标。每项化验重复进行, 计算平均值。
1.5 数据处理使用SPSS 22.0统计软件, 计量资料采用均数±标准差(x±s)表示, 多组间比较采用单因素方差分析, 组间多重比较采用LSD法, P < 0.05表示差异具有统计学意义。
2 结果 2.1 各组大鼠卵巢指数及体积模型组较对照组, 卵巢指数明显降低(P < 0.01), 卵巢体积明显减小(P < 0.01);给药组较模型组、卵巢指数升高, 且有统计学差异(P < 0.05);低剂量组较模型组, 卵巢体积增大, 但无统计学差异; 中剂量组, 高剂量组和西药组较模型组, 卵巢体积明显增大, 且存在统计学差异(P < 0.01);与西药组比较, 中剂量组及高剂量组的卵巢指数及体积, 均无统计学差异。见表 1。
从卵巢组织HE病理切片镜下观察可见, 空白对照组卵巢皮质结构正常, 可见有许多原始卵泡、各级卵泡, 卵泡形态大小各异, 卵泡内卵母细胞大而圆, 轮廓清晰并见大量黄体分布, 形态正常; 模型组部分卵巢皮质有萎缩, 原始卵泡减少, 闭锁卵泡增多, 黄体减少; 中药高剂量组卵巢皮质中原始卵泡较模型组有所增加, 中药低、中、高剂量组闭锁卵泡数量较模型组有所降低, 黄体数量有所增加; 西药组原始卵泡较模型组增多, 但低于对照组, 闭锁细胞较模型组降低, 且低于对照组, 黄体数量较模型组增多, 且多于对照组。见图 1。
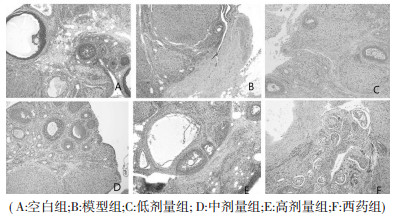
|
| 图 1 HE卵巢组织病理切片图(40×) Fig. 1 HE slides of ovarian samples (40×) |
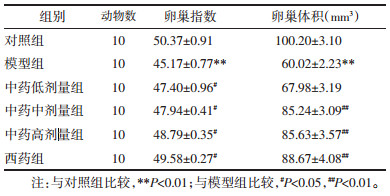
模型组较对照组血清中FSH明显升高, 而血清中E2则明显下降, 且均存在统计学差异(P < 0.05);中西药给药组较模型组血清中FSH明显降低(P < 0.05), 而血清中E2则明显升高(P < 0.05);中药低、中、高剂量组之间相互比较, 高剂量组较中剂量组及低剂量组, FSH下降、E2升高明显。可见七子益肾理冲汤能有效调节模型大鼠性激素水平, 使得FSH水平下降, E2水平上升。见表 2。
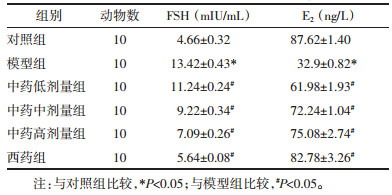
模型组较对照组, 血清中AMH明显下降, 且均存在统计学差异(P < 0.05);中西药给药组较模型组, 血清中AMH则明显升高(P < 0.05);中药低、中、高剂量组之间相互比较, 高剂量组较中剂量组及低剂量组的AMH明显升高, 均具有统计学差异; 而对比西药组, 高剂量组AMH水平未见明显差异。见表 3。
本研究以卵巢指数、观察光镜下显微组织病理学改变和观察光镜下各级卵泡并黄体的比例, 用于观察七子益肾理冲汤对DOR模型大鼠卵巢组织损伤的修复情况, 并研究七子益肾理冲汤维护大鼠各级卵泡凋亡、促进卵泡发育、及黄体生成的作用, 从而探讨七子益肾理冲汤对卵巢功能恢复提供形态学依据。在HE病理切片中可见模型组各级卵泡及黄体数量大幅减少、闭锁卵泡增多, 并见卵泡发育不良, 生长卵泡内颗粒细胞明显减少。各中西药组大鼠经过治疗, 在HE切片中可见卵泡发育较正常, 各级卵泡及黄体均较模型组增多而闭锁卵泡减少, 推测用药透过调节HPOA生殖轴及卵巢局部微环境, 使卵泡发育渐获恢复, 重建卵巢正常的生理功能。
3.2 FSH、E2与卵巢储备的关系血清FSH升高是DOR的典型内分泌特征之一, 随着卵巢储备功能的下降, 卵泡颗粒细胞分泌抑制素减少, 卵泡数量的减少使卵泡对FSH敏感性降低, 以致卵泡发育受限, 颗粒细胞产生的抑制素(INH)减少导致早卵泡期的基础FSH水平升高。卵泡期FSH水平会逐渐升高, 促进一定数量窦卵泡的发育生长, 此影响所分泌的E2水平。而过多卵泡的丢失造成雌激素合成受阻, 血清中E2水平降低。减少雌激素调节卵母细胞的成熟和颗粒细胞的增殖与分化、促进卵泡发育的功能。循环中的低雌激素水平又再对下丘脑、垂体产生反馈调节作用而致下丘脑促性腺激素释放激素至FSH分泌增加, 持续高水平的FSH对卵泡自身受体的下调使残留卵泡的功能处于抑制状态, 因此基础状态下的FSH和E2水平某种程度上可以反映卵巢的储备功能。临床上当40 mU/mL>基础FSH>10 mU/mL时提示女性人体卵巢储备功能低下[3]。本研究结果显示, 模型组、各中西药治疗组FSH水平较空白组均明显升高, 及则E2明显下降, 说明模型组大鼠因VCD直接影响模型大鼠的生殖系统, 对其卵巢造成损伤, 加速了卵泡闭锁以致卵泡数急剧下降从而造成卵巢储备功能不良。
3.3 AMH与卵巢储备的关系AMH属于转化生长因子β(TGF-β)超家族成员之一, 在卵巢中的AMH主要由窦前卵泡和窦状卵泡的颗粒细胞所分泌, 其作用是开启卵泡发育和选择性生长的过程, 具有抑制雄性穆勒管发育, 调节两性生殖细胞和性腺发育的重要功能。AMH在人类卵泡生长过程中发挥着重要的作用, 可以作为预测卵巢储备功能及促排卵过程中卵巢反应性的血清学标记物[4-5]。Seifer等[6]首次证实卵泡早期血清AMH与获得的卵泡数目即最终成熟的卵泡数成正相关, 认为血清AMH可以反映始基卵泡库的大小, 可能成为预期IVF促排卵中获卵数的标志物。La Marca等[7]及Tsepelidis等[8]研究指出, AMH在整个月经周期的波动极小, 呈相对稳定状态, 而且AMH独立于下丘脑-垂体-卵巢轴, 比其他卵巢储备功能预测指标更具有优势。
3.4 七子益肾理冲汤与卵巢储备的关系肖承悰教授认为卵巢储备功能低下, 其主要病机是肾虚冲血不足、血海空虚, 而临床上亦以肾虚血瘀证最为多见, 故以"肾主生殖"基础理论为指导, 以补肾活血为法, 运用益肾填精的中药, 从整体对女性下丘脑-垂体-卵巢-子宫生殖轴进行调理, 并用补血养肝之药物调理冲脉, 使血海充盈而经调, 总结经验而独创七子益肾理冲汤[9]。七子益肾理冲汤中"七子", 启发于五子衍宗丸, "七子"所指中药材为女贞子、枸杞子、菟丝子、沙苑子、覆盆子、香附(子)、桑椹(子), 于肾中阴阳并补, 使肾中阴阳互根互长, 以期阳中有阴, 阴中有阳, 以奏益肾之功。此方于"七子"以上, 还加上续断、桑寄生、巴戟天, 能补肾助阳兼安胎, 熟地黄、白芍、黄精、黄芪, 能补气养血, 滋阴柔肝, 全方补肾活血并用, 补益肾中精气同时注重活血养肝, 调理冲脉血海, 其组方合理, 配伍巧妙, 用药精良。
本实验中VCD的化学毒作用伤害模型组大鼠原始卵泡及初级卵泡, 加速原始和初级卵泡的闭锁, 而致卵泡闭锁增多, 卵巢内残留卵泡减少, 促使窦前卵泡和窦状卵泡的颗粒细胞所分泌之AMH水平下降, 卵巢储备能力降低, 相应影响FSH升高及E2降低。中药高剂量组经七子益肾理冲汤治疗后, 原始卵泡数量增加和闭锁卵泡减少, FSH水平下降及E2回升, 在一定幅度上恢复卵巢储备能力。中药高剂量组AMH上升亦反映七子益肾理冲汤对始基卵泡库有修复作用, 效果与DHEA相若。
| [1] | 吴丽婷. 七子益肾理冲汤治疗肝肾阴虚型卵巢早衰临床疗效观察[D]. 北京: 北京中医药大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10026-1017183657.htm |
| [2] | Maheshwari A, Fowler P, Bhattacharya S. Assessment of ovarian reserve should we perfrom tests of ovarian reserve routinely?[J]. Hum Reprod, 2006, 21 (11): 2729–2735. DOI:10.1093/humrep/del188 |
| [3] | Kalu E, Panay N. Spontaneous premature ovarian failure:management challenges[J]. Gynecol Endocrinol, 2008, 24 (5): 273–279. DOI:10.1080/09513590801990764 |
| [4] | Weenen C, Laven JS, Von Bergh AR, et al. Anti-Mullerian hormone expression pattern in the human ovary:potential implications for initial and cyclic follicle recruitment[J]. Mol Hum Reprod, 2004, 10 (2): 77–83. DOI:10.1093/molehr/gah015 |
| [5] | Gnoth C, Schuring AN, Friol K, et al. Relevance of anti-Mullerian hormone measurement in a routine IVF program[J]. Hum Reprod, 2008, 23 (6): 1359–1365. DOI:10.1093/humrep/den108 |
| [6] | Seifer DB, Baker VL, Leader B. Age-specific serum anti-Müllerian hormone values for 17120 women presenting to fertility centers within the United States[J]. Fertil Steril, 2011, 95 (2): 747–750. DOI:10.1016/j.fertnstert.2010.10.011 |
| [7] | La Marca A, Stabile G, Artenisio AC, et al. Serum anti-Mullerian hormone throughout the human menstrual cycle[J]. Hum Reprod, 2006, 21 (12): 3103–3107. DOI:10.1093/humrep/del291 |
| [8] | Tsepelidis S, Devreker F, Demeestere I, et al. Stable serum levels of anti-Mullerian hormone during the menstrual cycle:a prospective study in hormone as a surrogate for antral follicle count for definition of the polycystic ovary syndrome[J]. J Clin Endocrinal Metab, 2006, 91 (3): 941–945. DOI:10.1210/jc.2005-2076 |
| [9] | 吴丽婷, 石玥, 刘雁峰. 肖承悰治疗卵巢早衰经验[J]. 中医杂志, 2017, 8 (2): 108–110. |
2. School of Chinese Medicine of Hong Kong Baptist University, Hong Kong
 2018, Vol. 35
2018, Vol. 35