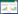文章信息
- 栗茜, 彭莎, 候宁, 刘敏, 李晶, 张宇昕, 张乔, 王石峰, 张燕玲, 乔延江
- LI Xi, PENG Sha, HOU Ning, LIU Min, LI Jing, ZHANG Yuxin, ZHANG Qiao, WANG Shifeng, ZHANG Yanling, QIAO Yanjiang
- 穿心莲内酯通过下调PPARγ-C/EBPα抑制脂滴形成
- Andrographolide inhibits lipid droplet accumulation by blocking PPARγ-C/EBPα expression
- 天津中医药, 2018, 35(6): 454-459
- Tianjin Journal of Traditional Chinese Medicine, 2018, 35(6): 454-459
- http://dx.doi.org/10.11656/j.issn.1672-1519.2018.06.15
-
文章历史
- 收稿日期: 2018-01-03
2. 国家中医药管理局中药信息工程重点研究室, 北京 100102
穿心莲内酯为爵床科植物穿心莲[Andrographis panicultata (Burm.f) Nees]中提取得到的二萜内酯类化合物, 是穿心莲的主要活性成分之一。穿心莲内酯呈白色方棱形或片状结晶, 无臭, 味苦[1], 在水中的溶解度非常小, 易溶于油相, 在甲醇中溶解度最高, 化学成分见图 1。穿心莲味苦, 主要具有清热解毒、凉血消肿等功能[2]。现代研究表明, 穿心莲内酯具有解热、抗炎、抗病毒、调节机体免疫力、抗心肌缺血、保肝利胆和调节血糖等作用[3]。然而, 穿心莲调控脂代谢的活性物质基础和分子作用机制并不明确。
|
| 图 1 穿心莲内酯的化学结构式 Fig. 1 Chemical structure of andrographolide |
肥胖形成的原因包括脂肪细胞数目增加和体积增大, 前脂肪细胞增殖、分化和凋亡影响脂肪细胞数量, 其体积主要取决于脂质形成和脂质水解的平衡[4]。脂肪堆积被认为是肥胖发展的关键诱因, 控制脂肪细胞分化和脂滴堆积能有效控制肥胖[5]。前脂肪细胞向成熟脂肪细胞分化受一系列转录因子调控, 它们控制着成熟脂肪细胞表型的各种蛋白表达[6]。过氧化物酶体增殖物激活受体γ(PPARγ)基因属于核受体超家族成员基因, 作为转录调控因子能启动脂肪细胞分化[7]。CCAAT/增强子结合蛋白α (C/EBPα)是碱性亮氨酸拉链蛋白家族的一个亚家族成员之一, 在脂肪细胞分化和发育过程中发挥重要作用, 可激活众多脂肪细胞分化及相关基因转录表达, 促进脂滴的形成[8-9]。PPARγ和C/EBPα是脂肪细胞分化和生成的关键标志物, 共同调节脂肪细胞分化过程[10]。C/EBPβ、C/EBPα和PPARγ参与脂肪形成过程中的级联[11], 而C/EBPβ并不直接调节C/EBPα的表达, 需要PPARγ参与[12]。通过对脂滴形成的各个阶段进行干预和调控, 能有效控制脂肪细胞数量和体积。本研究基于3T3-L1脂肪模型, 采用高内涵技术检测脂肪细胞分化和脂滴形成, 探讨穿心莲内酯抑制脂肪细胞堆积的生物活性和分子作用机制。
1 材料和方法 1.1 试剂耗材穿心莲内酯(CAS No.5508-58-7)购买于江西本草天工科技有限责任公司; DMEM高糖培养基和胎牛血清(FBS)购买于Gibco公司; 0.05% Trypsin/EDTA购买于Thermo公司; Hoechst 33342、Nile red、Rosiglitazone、IBMX、地塞米松、胰酶、Insulin Anti-rabbit FITC IgG和明胶购买于Sigma公司。Mouse anti-PPARγ来源于Santa Cruz Biotechnology Inc; Rabbit anti-C/EBPα来源于Epitomics Inc, 乙醇购买于北京高华伟业食品添加剂有限公司, 黑壁透明底96孔板购买于Greiner bio-one公司; 60 mm细胞培养皿和T25细胞培养皿购买于Nest公司。
1.2 实验仪器本研究所使用的实验仪器如下:ImagXpress Micro XLS (Molecular Devices); Collomics ArrayScan VTI reader (Thermo Fisher Scientific); 超净工作台(上海智诚公司); 高压蒸汽灭菌锅(上海西域公司; 倒置相差显微镜(Olympus, Japan); 二氧化碳培养箱(Thermo Forma); 高速低温离心机(Eppendorf)。
1.3 3T3-L1细胞培养3T3-L1前脂肪细胞购买于美国ATCC公司, 细胞传代至14代以内。3T3-L1前脂肪细胞培养于含有10%胎牛血清的DMEM完全培养基, 另加入100 U/mL硫酸链霉素和100 μg/mL盘尼西林。细胞复苏次日更换新鲜培养基, 每2~3 d进行细胞传代和换液, 待细胞培养至对数生长期进行药物活性评价。
1.4 脂肪细胞诱导分化及加药处理3T3-L1脂肪细胞以3 000个/孔接种于96孔板, 培养3 d至细胞生长融合时开始诱导分化。分化诱导液组成为:0.5 mmol/L IBMX、1 μg/mL胰岛素、0.25 μmol/L地塞米松、2 μmol/L罗格列酮。分化第3天, 将培养基更换为含1 μg/mL胰岛素的完全培养基连续培养48 h。分化第5天, 使用DMEM完全培养基再连续培养48 h。将穿心莲内酯用二甲基亚砜(DMSO)溶解制备成储存液, 使用时用DMSO溶解成相应浓度, 使得DMSO终浓度为0.1%(初始浓度稀释1 000倍)。从细胞诱导分化开始时加入待测药物, 以前脂肪细胞作为空白对照组, 诱导分化细胞为阴性对照组。
实验分为阴性对照组0.1% DMSO处理, 阳性对照组加入盐酸小檗碱(BBR)半数抑制浓度(IC50)为1.01 μmol/L, 实验组将穿心莲内酯从浓度为30 μmol/L按照3倍梯度依次稀释, 加入到分化的3T3-L1脂肪细胞。化合物连续作用6 d后, 采用高内涵荧光成像方法分析脂滴荧光强度及脂滴数量。为了探讨穿心莲内酯改善脂肪沉积的作用机制, 以30 μmol/L、10 μmol/L浓度分别作用于3T3-L1脂肪细胞, 观察PPARγ及C/EBPα的表达。
1.5 细胞固定及脂滴荧光染色分析细胞培养结束后, 弃去培养基, 磷酸缓冲盐(PBS)缓冲液润洗后, 加入预热的4%多聚甲醛溶液, 在室温放置20 min使细胞被固定。以Nile red (200 μg/mL)作为脂滴的特异性荧光染料, 在避光条件下, 室温孵育10 min, 标记细胞脂滴。弃去脂滴荧光染料, 以PBS缓冲液润洗3次, 加入Hoechst 33342溶液, 终浓度为10 μg/mL)。在避光条件下, 室温放置15 min, 标记细胞核。弃去Hoechst 33342溶液, 加入PBS缓冲液润洗3次。
采用Collomics ArrayScan VTI高内涵荧光成像系统采集Hoechst 33342和Nile red荧光信息。采用10×物镜, 每孔扫描9个视野。细胞核信号采集的激发/发射波长为386/460 nm; 脂滴荧光采用的激发/发射波长为488/525 nm。采用Spot Detector分析方法分析脂肪细胞数量、脂滴数量和脂滴荧光强度。
1.6 免疫荧光染色用4%多聚甲醛溶液固定细胞, 加入100 μL 0.1%Toriton-X-100使细胞通透30 min, 结束后用PBS溶液润洗3次。使用100 μL浓度为5% BSA溶液将细胞于室温下孵育1 h, 封闭细胞。5% BSA稀释一抗溶液, 50 μL/孔加到96孔板, 于4℃环境过夜。次日, 用PBST润洗细胞3次, 每次5 min。用5%BSA稀释二抗, 每孔50 μL, 室温孵育1.5 h, 用PBS润洗3次。避光条件下, 采用Hoechst 33342(10 μg/mL)标记细胞核, 室温孵育15 min。用PBS润洗。镜检, 采集荧光信息。
1.7 数据处理与统计学分析实验至少重复3次以上, 以0.1% DMSO为阴性对照组, 对药物处理组数据进行归一化分析, 数据表示方法为:x ±SEM, n=3。采用Graphpad (Version5)数据分析软件绘图。不同处理组之间采用单因素方差检验(one-way ANOVA), P < 0.05表示差异有统计学意义。
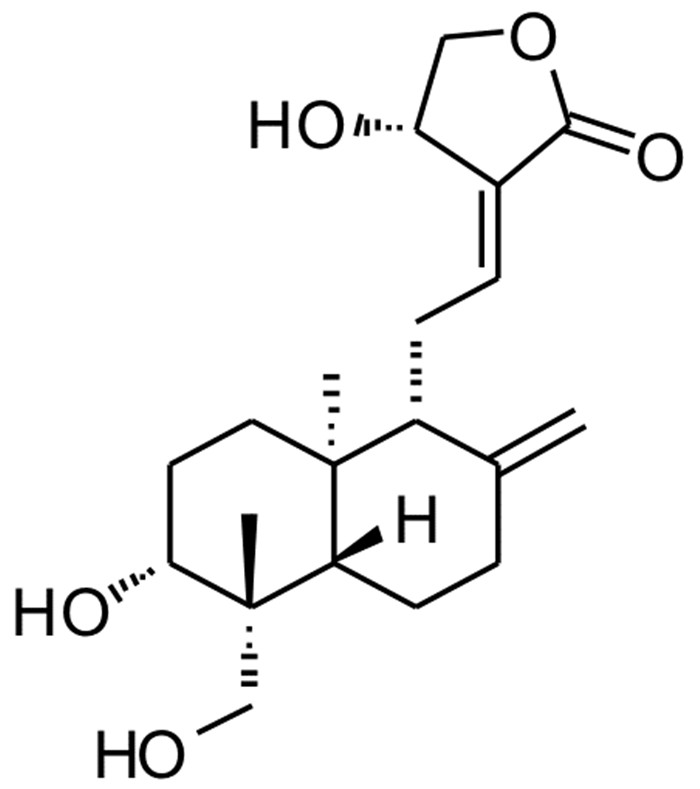
2 结果 2.1 穿心莲内酯抑制脂滴堆积作用在30 μmol/L时, 可观察到视野内脂滴数量显著减少, 浓度降低时抑制作用减弱(图 2a)。脂滴荧光强度分析显示, 30 μmol/L对脂滴的抑制率达到90%以上(图 2b), 随着浓度降低, 抑制作用迅速减弱, 3 μmol/L内基本无明显抑制作用。细胞数量分析显示, 穿心莲内酯在30 μmol/L时轻微降低脂肪细胞数量(图 2c), 表明穿心莲内酯可抑制脂肪细胞分化和早期有丝分裂。
|
| 图 2 穿心莲内酯剂量依赖降低3T3-L1脂肪细胞脂滴堆积 Fig. 2 Andrographolide dose-dependently decreased lipid droplet deposition in 3T3-L1 adipocytes (a)不同浓度穿心莲内酯处理脂肪细胞脂滴荧光成像。将穿心莲内酯从浓度为30 μmol/L按照3倍梯度稀释, 加入诱导分化的脂肪细胞连续培养6 d, 采用nile red标记细胞脂滴。(b)穿心莲内酯降低脂滴荧光强度浓度效应关系, 0.1% DMSO处理的脂肪细胞为阴性对照组, 盐酸小檗碱为阳性对照组。(c)穿心莲内酯对脂肪细胞数量的影响, 其余条件同b。 |
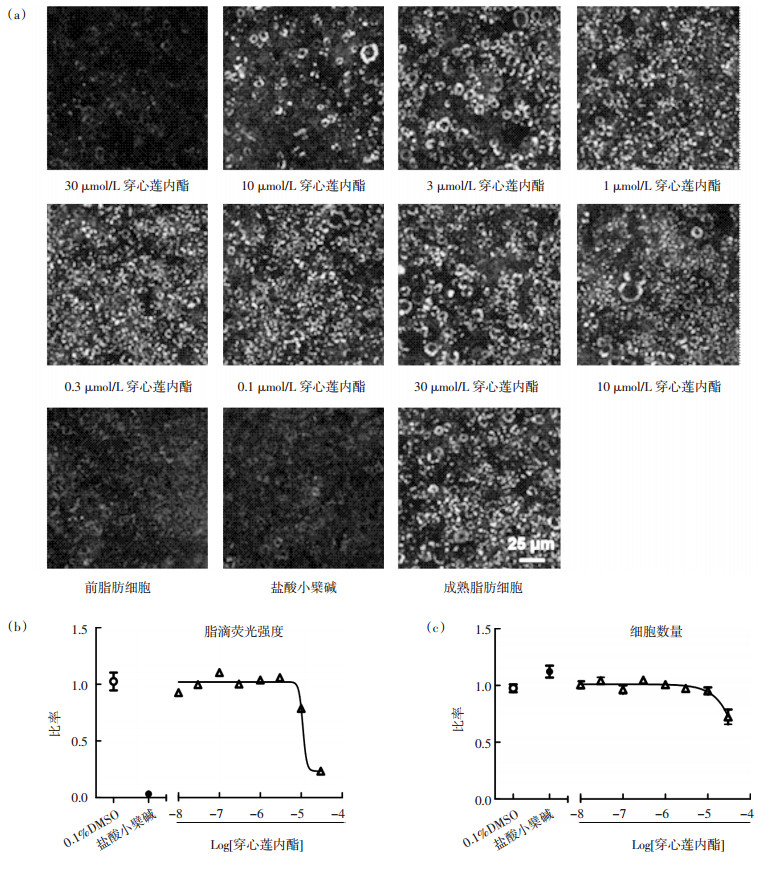
为了探讨穿心莲内酯改善脂肪沉积的作用机制, 以30 μmol/L和10 μmol/L浓度分别作用于3T3-L1脂肪细胞, 观察PPARγ的表达。结果显示, 脂肪细胞诱导后PPARγ表达明显增高, 表明模型诱导成功(图 3a)。30 μmol/L时穿心莲内酯显著降低PPARγ的阳性率(P < 0.01), 由60%降低至20%;10 μmol/L时轻微降低PPARγ阳性率, 但与阴性对照组无统计学差异(P>0.05)(图 3b)。荧光强度分析结果显示, 10 μmol/L与30 μmol/L穿心莲内酯均能显著降低PPARγ荧光强度, 与阴性对照组比较均有显著差异(P < 0.01)(图 3c)。在所分析的浓度范围内, 穿心莲内酯处理组的细胞数量与阴性对照组无统计学差异(P>0.05) (图 3d)。该研究表明, 穿心莲内酯可以抑制PPARγ介导的细胞分化作用。
|
| 图 3 穿心莲内酯对3T3-L1细胞PPARγ表达的调节作用 Fig. 3 Effect of andrographolide on regulating PPARγ expression in 3T3-L1 adipocytes (a)3T3-L1脂肪细胞PPARγ免疫荧光成像。(b)PPARγ阳性细胞百分比, 以总细胞数量为100%。(c)PPARγ荧光强度分析, 以诱导后的阴性对照组的比例为1。(d)细胞数量分析, 以诱导后的阴性对照组的比例为1。n=4。与阴性对照组比较, **P < 0.01。 |
以30 μmol/L和10 μmol/L穿心莲内酯分别作用于3T3-L1脂肪细胞, 观察C/EBPα表达。结果显示, 脂肪细胞诱导后C/EBPα表达明显增高, 表明模型诱导成功(图 4a)。30 μmol/L时穿心莲内酯显著降低C/EBPα的阳性率, 由40%降低至10%(P < 0.01);10 μmol/L时轻微降低C/EBPα阳性率, 但与阴性对照组无统计学差异(如图 4b)。荧光强度分析结果显示, 30 μmol/L穿心莲内酯能显著降低C/EBPα表达的荧光强度(P < 0.01), 10 μmol/L时与阴性对照组比较无统计学差异(图 4c)。在所分析的浓度范围内, 穿心莲内酯处理组的细胞数量与阴性对照组无统计学差异(图 4d)。该研究表明, 穿心莲内酯可以抑制C/EBPα介导的细胞分化作用。
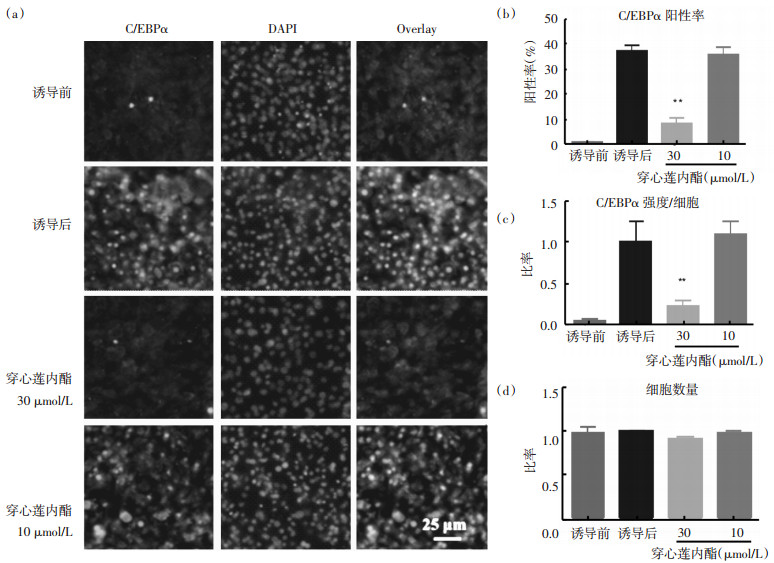
|
| 图 4 穿心莲内酯对3T3-L1细胞C/EBPα表达的调节作用 Fig. 4 Effect of andrographolide on regulating C/EBPα expression in 3T3-L1 adipocytes (a)3T3-L1脂肪细胞C/EBPα免疫荧光成像。(b)C/EBPα阳性细胞百分比, 以总细胞数量为100%。(c)C/EBPα荧光强度分析, 以诱导后的阴性对照组的比例为1。(d)细胞数量分析, 以诱导后的阴性对照组的比例为1。n=4。与阴性对照组比较, **P < 0.01。 |
本研究确认了穿心莲内酯抑制PPARγ-C/EBPα通路介导的脂肪细胞分化和抑制脂滴堆积活性, 并观察到穿心莲内酯显著降低PPARγ和C/EBPα表达。Jin等[13]数据显示穿心莲内酯主要抑制脂肪分化的早期阶段, 可能是通过调节PPARγ的表达, 与本文的结果相符。Lefterova MI等[14]研究表明, PPARγ和C/EBPα已经成为脂肪形成的主要调节剂, 最近的全基因组研究表明其转录靶标中存在广泛的重叠。Chen等[15]研究表明, 穿心莲内酯与消耗细胞内的谷膀氨肽(GPX1和GSH)有关, 导致细胞内的ROS累积, 从而抑制脂肪细胞分化。此外, 细胞外调节蛋白激酶(ERK)和糖原合成酶激酶-3(GSK-3β)依赖的C/EBPβ也参与穿心莲内酯对脂肪细胞分化的抑制作用[16]。GSK-3β和环磷腺苷效应元件结合蛋白(CREB)是脂肪细胞中调控脂肪细胞分化和脂生成的关键蛋白, 通过上调TR4孤儿核受体表达作用[17], 而TR4可以促进游离脂肪酸的合成。冯丽娜等[18]研究发现穿心莲内酯可以诱导3T3-L1细胞程序性死亡, 可见高浓度时穿心莲内酯可能诱导细胞毒性作用, 应合理的控制使用剂量。
研究发现超重或肥胖可能增加多种疾病风险, 包括乳腺癌、冠心病、2型糖尿病、胆囊疾病、骨关节疾病、结肠癌、高血压等病[19]。脂代谢综合症的发生也会引起机体内的慢性炎症, 造成身体功能紊乱[20]。本研究显示穿心莲内酯通过阻断PPARγ-C/EBPα表达, 抑制脂肪细胞分化, 降低脂滴堆积, 并确认了其活性浓度范围。本文的研究结果为天然植物功能因子干预肥胖的功效及作用机制的研究提供了一种思路和方法, 为穿心莲内酯减肥降脂的应用提供了前期的研究基础, 并揭示了其分子作用机制, 为改善肥胖相关代谢疾病提供一种潜在的治疗策略。此外, 在体内水平穿心莲内酯对肥胖的干预作用尚有待于进一步研究。
| [1] | 马长沙, 段成军, 马静洁, 等. 穿心莲内酯及其衍生物药理活性研究[J]. 吉林中医药, 2014, 34 (1): 77–81. |
| [2] | 陈伶俐, 王振华. 穿心莲内酯基本理化性质考察[J]. 今日药学, 2010, 20 (1): 41–43. |
| [3] | 吕巧莉, 涂国刚, 王嘉琦, 等. 穿心莲内酯的研究进展及临床应用[J]. 南昌大学学报(医学版), 2013, 58 (1): 83–86. |
| [4] | Cristancho AG, Lazar MA. Forming functional fat:a growing under-standing of adipocyte differentiation[J]. Nature Reviews Molecular Cell Biology, 2011, 12 (11): 722. DOI:10.1038/nrm3198 |
| [5] | Rosen ED, Spiegelman BM. Adipocytes as regulators of energy balance and glucose homeostasis[J]. Nature, 2006, 444 (7121): 847–53. DOI:10.1038/nature05483 |
| [6] | 黄家鑫. C/EBPβ在脂肪细胞分化过程中对自噬的调控及SCO1在肥胖相关代谢性疾病中的机制研究[D]. 上海: 上海复旦大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10246-1015428839.htm |
| [7] | 蒋金航, 马云, 王新庄, 等. PPARγ基因调控脂肪细胞分化的研究进展[J]. 中国畜牧杂志, 2014, 62 (9): 91–95. |
| [8] | Ohlsson E, Hasemann MS, Willer A, et al. Initiation of MLL-rear-ranged AML is dependent on C/EBPα[J]. Journal of Experimental Medicine, 2014, 211 (1): 5–13. DOI:10.1084/jem.20130932 |
| [9] | Wang H, Zan LS, Wang HB, et al. Cloning, expression analysis and sequence prediction of the CCAAT/enhancer binding, protein alpha gene of Qinchuan cattle[J]. Genetics & Molecular Research Gmr, 2012, 11 (2): 1651. |
| [10] | Auwerx J, Cock TA, Knouff C. PPAR-gamma:a thrifty transcription factor[J]. Nuclear Receptor Signaling, 2002, 1 (1): e006. |
| [11] | Tang QQ, Zhang JW, Daniel LM. Sequential gene promoter interac-tions of C/EBPbeta, C/EBPalpha, and PPARgamma during adipoge-nesis[J]. Biochemical & Biophysical Research Communications, 2004, 318 (1): 213–218. |
| [12] | Zuo Y, Qiang L, Farmer SR. Activation of CCAAT/enhancer-binding protein (C/EBP) alpha expression by C/EBP beta during adipogenesis requires a peroxisome proliferator-activated receptorgamma-associated repression of HDAC1 at the C/ebp alpha gene promoter[J]. Journal of Biological Chemistry, 2006, 281 (12): 7960–7967. DOI:10.1074/jbc.M510682200 |
| [13] | Jin L, Fang W, Bo L, et al. Inhibitory effect of Andrographolide in 3T3-L1 adipocytes differentiation through the PPARγ pathway[J]. Molecular & Cellular Endocrinology, 2012, 358 (1): 81–87. |
| [14] | Lefterova MI, Lazar MA. New developments in adipogenesis[J]. Trends in Endocrinology & Metabolism, 2009, 20 (3): 107–114. |
| [15] | Chen W, Su H, Feng L, et al. Andrographolide suppresses preadipocytes proliferation through glutathione antioxidant systems abrogation[J]. Life Sciences, 2016 (156): 21. |
| [16] | Chen CC, Chuang WT, Lin AH, et al. Andrographolide inhibits adipogenesis of 3T3-L1 cells by suppressing C/EBPβ expression and activation[J]. Toxicology & Applied Pharmacology, 2016 (307): 115. |
| [17] | Park SS, Choi H, Kim SJ, et al. CREB/GSK-3β signaling pathway regulates the expression of TR4 orphan nuclear receptor gene[J]. Molecular & Cellular Endocrinology, 2016 (423): 22–29. |
| [18] | 冯丽娜. 穿心莲内酯对肥胖的干预作用及其机制研究[D]. 杭州: 浙江工商大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10353-1014224849.htm |
| [19] | 邹大进. 肥胖是一种疾病[J]. 科学世界, 2014, 16 (8): 1. |
| [20] | Hotamisligil GS. Endoplasmic reticulum stress and the inflammatory basis of metabolic disease[J]. Cell, 2010, 140 (6): 900–917. DOI:10.1016/j.cell.2010.02.034 |
2. State Administration of Traditional Chinese Medicine, Research Center of TCM-Information Engineering, Beijin 100102, China
 2018, Vol. 35
2018, Vol. 35