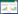文章信息
- 郭家鼎, 郝佳, 李梦荣, 王誉程, 刘二伟
- GUO Jiading, HAO Jia, LI Mengrong, WANG Yucheng, LIU Erwei
- 补骨脂苷和异补骨脂苷与牛血清白蛋白相互作用研究
- Study on the interaction between BSA and psoralenoside as well as isopsoralenoside
- 天津中医药, 2018, 35(6): 460-465
- Tianjin Journal of Traditional Chinese Medicine, 2018, 35(6): 460-465
- http://dx.doi.org/10.11656/j.issn.1672-1519.2018.06.16
-
文章历史
- 收稿日期: 2017-12-06
2. 天津市中药化学与分析重点实验室, 天津 300193
中药补骨脂为豆科植物(Psocalea corylicolia L.)的果实, 具有补肾壮骨、升达脾胃、纳气止泻的功效, 其主要药效成分是香豆素类化合物补骨脂素、异补骨脂素及其对应的糖苷类化合物补骨脂苷(PO)、异补骨脂苷(IPO), 文献报道补骨脂原药材中PO、IPO的含量高于补骨脂素、异补骨脂素[1]。血清白蛋白是血浆中含量最丰富的载体蛋白, 可与许多内源性或外源性化合物结合[2]。开展药物与血浆蛋白相互作用研究是每个药物开发过程中必须进行的研究工作。牛血清白蛋白(BSA)与人血清白蛋白(HSA)具有极好的结构相似性, 且前者易于获取和具有高度稳定性[3], 所以在研究中常作为HSA的替代品。补骨脂素、异补骨脂素与血浆蛋白结合的研究已有相关报道[4], 但其糖苷类化合物PO、IPO的相应研究还未见报道。本文利用紫外吸收光谱法和荧光光谱法首次研究PO和IPO与BSA的相互作用, 为补骨脂的安全应用提供实验支撑。
1 仪器与试剂 1.1 仪器荧光分光光度计(F-7000, 日立高新技术有限公司); 超级恒温水浴箱(天津欧诺仪器有限公司); 紫外检测器(Agilient 1260高效液相色谱仪); 十万分之一天平(瑞士Mettler Toledo公司, AX-205);超纯水制造机(Millipore公司, Mill-Q Ⅱ型)。
1.2 试剂PO, IPO(天津西玛科技有限公司); 布洛芬Ibu、BSA、磷酸盐缓冲液PBS(索莱宝科技有限公司); 华法林钠War(天津渤尔特科技有限公司); 8-苯胺基-1-萘磺酸钠ANS-Na(梯希爱化成工业发展有限公司); 其他试剂均为分析纯, 实验用水均为超纯化水。
2 实验方法 2.1 储备溶液配制以PBS缓冲溶液(pH 7.4溶剂配制1.0×10-4 mol/L的BSA标准溶液备用, PO和IPO配成1×10-2 mol/L标准液备用, 均在0~4℃冰箱中保存。
2.2 紫外光谱研究移取100 μL 1.0×10-3 mol/L药物溶液、一定量的BSA溶液于1.5 mL离心管中, 以PBS缓冲溶液(pH 7.40)定容至1 mL, 扫描得到190~400 nm紫外吸收光谱。
2.3 荧光光谱研究 2.3.1 荧光淬灭光谱移取100 μL 5.0×10-5 mol/L BSA溶液和一定量的PO与IPO溶液于1.5 mL离心管中, 以pH 7.40的PBS缓冲溶稀释至1 mL, 得到不同浓度的PO和IPO待测溶液, 其浓度从1到8依次是0、0.2、0.5、1、1.5、2、2.5、3×10-4 mol/L。实验过程中, 为了避免内滤光效应, 使BSA的终浓度为5×10-6 mol/L。工作液至于37℃水浴中温育1 h, 分取样品100 μL至于96孔板中, 制备4个复孔。激发波长278 nm, 进行300~500 nm的全波长扫描, 激发波长和发射波长的狭缝分别是5 nm, 扫描速度240 nm/min。记录样品在37℃条件下的荧光发射光谱。
2.3.2 同步荧光扫描图谱以240 nm为激发波长, 300 nm为发射波长(Δλ=60 nm), 测定加入药物后体系的同步荧光光谱。药物浓度浓度从1到8依次是0、0.2、0.5、1、1.5、2、2.5、3×10-4 mol/L。
2.3.3 三维荧光扫描图谱激发波长的范围240~320 nm; 发射波长范围300~450 nm, 其他参数同荧光发射光谱。
2.3.4 位点竞争实验固定BSA的浓度, 向药物-BSA体系分别加入一定量的竞争试剂:位点Ⅰ(Site Ⅰ)的探针试剂为War, 位点Ⅱ(Site Ⅱ)的探针试剂为Ibu, 在激发波长为278 nm, 发射波长为340 nm处测定其荧光强度, 所得数据用来计算药物与BSA结合常数。
2.3.5 疏水探针ANS结合研究:实验(1), 将PO/IPO加入到BSA-ANS-Na (CBSA:CANS-Na=1:1)体系中, PO/IPO浓度变化范围为0~3×10-4 mol/L, 设置激发波长为375 nm, 记录ANS-Na在最大发射波长465 nm处的荧光值; 实验(2), 将PO/IPO加入到BSA-ANS-Na(CBSA:CANS-Na=1:1)体系中, PO/IPO浓度变化范围为0~3×10-4 mol/L, 设置激发波长为278 nm, 记录BSA在最大发射波长340 nm处的荧光值, 所得数据用来计算药物与BSA键合常数。
3 结果 3.1 紫外/可见吸收光谱研究紫外/可见吸收光谱法方法简单适用于探索结构变化和了解复合物的形成[5]。通过预实验发现, 当固定BSA的浓度, 不断增加药物浓度时, 在BSA最大吸收波长处有干扰, 因此为了考察PO、IPO与BSA相互作用, 实验固定药物浓度, 测试不同浓度BSA与一定量的药物作用的紫外/可见吸收光谱。如图 1所示, 随着BSA浓度的增加, 药物的紫外吸收光谱呈现了增色效应, 提示可能是因为二者发生了相互作用, 导致了BSA构像发生变化。但是药物和BSA相互作用机制还需要进一步探讨, 因此, 进行了荧光光谱研究。
|
| 图 1 PO(A)和IPO(B)对BSA的紫外吸收图谱 Fig. 1 UV/vis absorbance spectra of PO (A) or IPO (B) in the absence and presence of BSA CPO=CIPO=1×10-4 mol/L; 1~4(CBSA):0、0.1、0.5、1×10-6 mol/L。 |
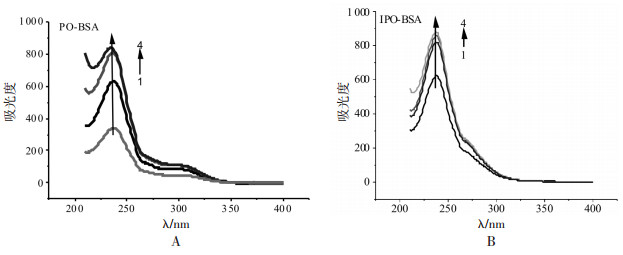
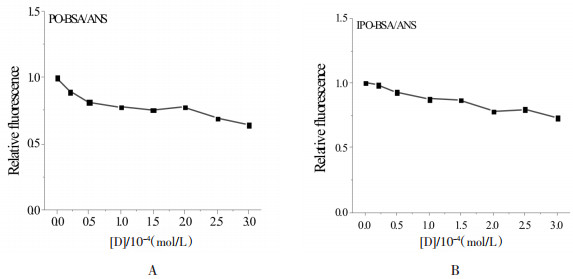
如图 2A所示, 当激发光波长为278 nm时, BSA荧光发射峰位置在339 nm附近, 且PBS缓冲液及两种药物在339 nm附近无明显的荧光发射, 对实验不造成干扰。本实验以PBS作为参比溶液, 采用背景扣除法修正参比溶液的背景荧光得到如图 2B-C荧光淬灭图谱。由图 2B-C可知, 固定BSA的浓度不变, 随着PO和IPO浓度的增加, BSA荧光强度逐渐下降, 最大发射波长发生了约2 nm的轻微红移, 说明PO和IPO对BSA具有明显的荧光淬灭作用。又如图 2B-C所示, PO和IPO对BSA的荧光淬灭图谱中均出现了等发射点, 表明PO和IPO与BSA的相互作用过程中产生了新的化合物, 导致其对BSA的荧光淬灭行为。
|
| 图 2 BSA荧光图谱(A)及PO(B)、IPO(C)对BSA的荧光淬灭图 Fig. 2 Fluorescence spectra of BSA in the absence (A) and presence of PO (B) or IPO (C) CBSA=5×10-6 mol/L; 1~8:0, 0.2, 0.5, 1, 1.5, 2, 2.5, 3×10-4 mol/L。 |
荧光淬灭作用分为动态淬灭和静态淬灭, 无论是动态猝灭还是静态猝灭, 全部遵循Stern-Volmer方程[12]:
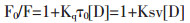 |
(1) |
由Stern-Volmer方程拟合得到的图 3显示, 在一定的药物浓度范围内(0-3×10-4 mol/L), F0/F与[D]线性关系良好, 且由表 1可知, 37℃时, PO和IPO对BSA荧光淬灭速率常数均为3.1×1011 L/(mol·s), 大于各类荧光淬灭剂对生物大分子的最大动态荧光淬灭速率常数2.0×1010 L/(mol·s), 说明PO和IPO对BSA的荧光淬灭是因为新的结合物生成而引起, 即静态淬灭, 这与上述荧光淬灭图谱的结果一致。
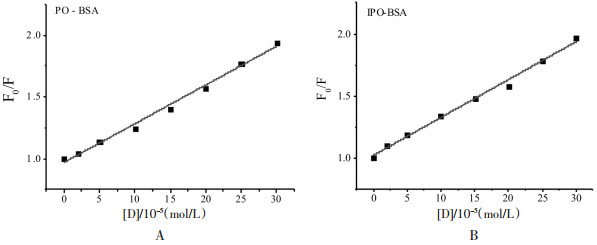
|
| 图 3 PO(A)和IPO(B)对BSA的Stern-Volmer拟合图 Fig. 3 Stern-Volmer curve of BSA fluorescence quenching treated with different concentrations of PO (A) or IPO (B) |
|
静态淬灭过程也可以用修正的Stern-Volmer方程分析[6],
 |
(2) |
根据方程(2)拟合得到线性方程F0/(F0-F)~1/[D], 见图 4。由截距和斜率计算得到37℃时PO和IPO对BSA的结合常数Ka, 详见表 1。

|
| 图 4 PO(A)和IPO(B)对BSA的F0/(F0-F)~1/[D]拟合图 Fig. 4 Plot of F0/(F0-F) versus 1/[D] for fluorescence quenching of BSA by PO (A) or IPO (B) |
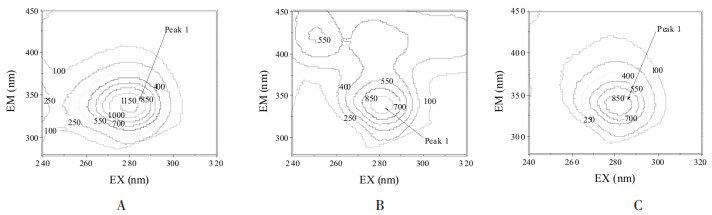
药物在BSA上结合位点数的推算多采用修正后的Scatchard方程[7], 图 5为利用lg[(F0-F)/F]~lg[D]作图得到的药物-BSA体系的Scatchard图:
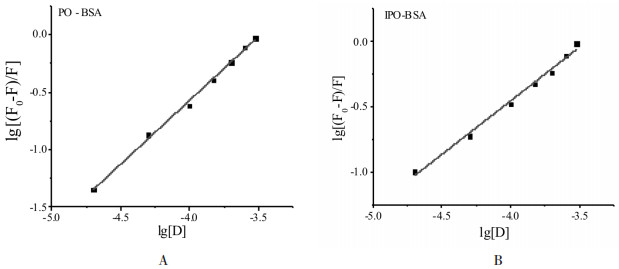
|
| 图 5 PO(A)和IPO(B)对BSA的lg[F0-F)/F]~lg[D]拟合图 Fig. 5 Plot of lg[F0-F)/F] versus lg[D] for quenching process of PO (A) or IPO (B) with BSA |
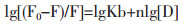 |
(3) |
由图 5的直线斜率计算得到37℃时药物分子在BSA上的结合位点数n并列于表 1中。PO和IPO在在BSA上的结合位点数分别是1.11和0.94, 说明药物在BSA上只存在一个结合位点, 即药物与BSA以1:1的比例进行结合。
3.3 PO和IPO对BSA位点确定研究HSA上至少有两个特异的高亲和药物结合位点, 分别称为siteⅠ和siteⅡ。许多药物对HSA的结合具有特异性[8], 如War结合于siteⅠ, Ibu结合于siteⅡ, 这两个药物可以用作位置探针。BSA与HSA结构上有极高的相似度, 因此, 选择War、Ibu分别作为siteⅠ、siteⅡ的探针药物, 从而研究探针药物与PO和IPO的竞争结合情况, 确定药物在BSA上的结合位点。本实验中, 探针药物与BSA按1:1比例混合, 同时加入到含有不同浓度的药物溶液中。在3种探针药物存在下, 根据方程(2)分析荧光淬灭数据, 相关荧光参数列于表 1。根据方程(3)所得的结合位点n约为1, 说明探针药物的存在并没有改变PO和IPO在BSA上结合位点数, 证实了上述PO和IPO在BSA上均有一个结合位点的结论。由表 1可知, 探针Ibu存在时, IPO对BSA的结合常数Ka变小幅度最大, 表明Ibu与IPO同时竞争同一个结合位点, 但是探针试剂的加入并没有对PO的结合常数造成影响。
3.4 ANS置换探针ANS在极性环境中没有明显的荧光发射, 但是与蛋白质的疏水区域结合后荧光信号增强[8], 所以本实验选用疏水性探针试剂ANS-Na研究BSA与PO/IPO之间相互作用的性质。在实验(1)中, 将不同浓度的PO/IPO加入到BSA-ANS体系, 药物浓度变化范围0~3×10-4 mol/L, 记录ANS相对荧光强度F/F0(F0:未加药物时ANS荧光值, F:加入不同浓度药物时ANS荧光值)随药物浓度变化趋势, 得图 6, 如图所示随着药物浓度的增加ANS荧光值变小。ANS是一个广谱性荧光探针, 在BSA上有5个结合位点, 但是当ANS与BSA浓度比为1:1时, 其主要结合位点主要位于SiteⅡ[9], 因此推测PO/IPO与ANS竞争性结合BSA致使ANS荧光强度下降。利用ANS进行了第二系列实验, ANS对PO/IPO与BSA结合常数的影响结果列于表 1, 发现ANS使PO/IPO结合常数Ka变小, 再一次对PO/IPO在BSA上的结合位点是Site Ⅱ的结果进行了验证。
|
| 图 6 疏水荧光探针ANS在PO/IPO作用下的相对荧光图谱 Fig. 6 Displacement of fluorescent probes from HSA by drugs (PO/IPO) CBSA=CANS=5×10-6 mol/L; CPO/CIPO:0, 0.2, 0.5, 1, 1.5, 2, 2.5, 3×10-4 mol/L。 |
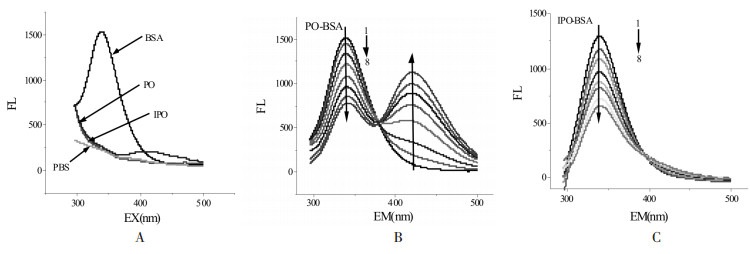
使用同步荧光光谱可以探测蛋白质氨基酸微环境的改变, 而血清白蛋白的荧光发射的特性主要来自色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)的贡献, 其中Trp荧光强度最大, 因此Trp的荧光猝灭可以用来表征药物与BSA的结合关系及BSA形态的变化[10]。本实验把Trp的同步荧光光谱作为定性判断BSA构象变化的依据, 见图 7。当Δλ=λem-λex=60 nm时, 同步荧光显示为Trp的荧光行为。如图 7所示, 固定BSA的浓度不变, 随着药物浓度的增加, BSA的荧光强度逐渐下降, 最大发射波长发生了约3 nm的轻微红移, 表明药物对BSA的构象造成了轻微的影响, 使Trp所处的微环境极性略有增加。
|
| 图 7 PO(A)和IPO(B)对BSA同步荧光光谱图 Fig. 7 Influence of PO (A) or IPO (B) on synchronous fluorescence spectra of BSA CBSA=5×10-6 mol/L; 1~8(CPO=CIPO):0, 0.2, 0.5, 1, 1.5, 2, 2.5, 3×10-6 mol/L。 |
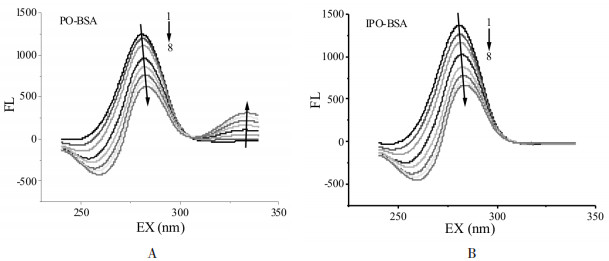
三维荧光图谱可以同时改变发射波长和激发波长, 从而提供荧光体的荧光特性信息[11]。图 8为BSA、PO-BSA和IPO-BSA的三维荧光图谱。如图 8所示, 峰1主要是tyr和try荧光发射行为, 随着PO和IPO的加入, 峰1的荧光值下降, 表明tyr和try的微环境发生了变化, PO和IPO与BSA之间的相互作用导致BSA构象发生了变化, 这与同步荧光发射图谱显示的结果一致。
|
| 图 8 BSA(A)、PO-BSA(B)和IPO-BSA(C)的三维荧光图谱 Fig. 8 Three-dimensional fuorescence spectra of BSA in the absence (A) and presence of PO (A) or IPO (B) CBSA=5×10-6 mol/L; CPO=CIPO=1×10-4 mol/L。 |
本实验采用紫外-可见吸收光谱法和荧光光谱法对PO和IPO在生理状态下对BSA的荧光淬灭方式、结合常数、结合位点数、以及PO和IPO对BSA构象的影响进行了研究。从荧光淬灭光谱、同步荧光光谱及三维荧光光谱可以看出, PO和IPO对BSA产生静态淬灭作用, 并且对BSA的构象产生了轻微影响。根据表 1结果可知, PO和IPO对BSA之间有较弱的结合。根据位点竞争实验结果可知, PO和IPO的在BSA上的主要结合位点在Site Ⅱ。
| [1] | Wang YF, Liu YN, Xiong W, et al. A UPLC-MS/MS method for in vivo, and in vitro, pharmacokinetic studies of psoralenoside, isopsoralenoside, psoralen and isopsoralen from Psoralea corylifolia, extract[J]. Journal of Ethnopharmacology, 2014, 151 (1): 609. DOI:10.1016/j.jep.2013.11.013 |
| [2] | Müller WE, Wollert U. Human Serum Albumin as a 'Silent Receptor' for Drugs and Endogenous Substances[J]. Pharmacology, 1979, 19 (2): 59–67. DOI:10.1159/000137289 |
| [3] | Hossain M, Khan AY, Suresh KG. Interaction of the anticancer plant alkaloid sanguinarine with bovine serum albumin[J]. Plos One, 2011, 6 (4): e18333. DOI:10.1371/journal.pone.0018333 |
| [4] | 何文英, 姚晓军, 胡之德, 等. 补骨脂素和异补骨脂素键合人血清白蛋白的比较[J]. 物理化学学报, 2010, 26 (1): 221–229. |
| [5] | Wang YQ, Zhang HM, Zhou QH. Studies on the interaction of caffeine with bovine hemoglobin[J]. European Journal of Medicinal Chemistry, 2009, 44 (5): 2100. DOI:10.1016/j.ejmech.2008.10.010 |
| [6] | Mehranfar F, Bordbar AK, Parastar HA. Combined spectroscopic, molecular docking and molecular dynamic simulation study on the interaction of quercetin with β-casein nanoparticles[J]. Journal of Photochemistry & Photobiology B Biology, 2013, 127 : 100. |
| [7] | Hao J, Zhang Y, Wang X, et al. Interaction between the Natural Components in Danhong Injection (DHI) with Serum Albumin (SA) and the Influence of the Coexisting Multi-Components on the SaB-BSA Binding System:Fluorescence and Molecular Docking Studies[J]. Plos One, 2015, 10 (6): e0128919. DOI:10.1371/journal.pone.0128919 |
| [8] | Bojko B, Sufkowska A, Macia'ek-Jurczyk M, et al. Investigations of acetaminophen binding to bovine serum albumin in the presence of fatty acid:Fluorescence and 1H NMR studies[J]. Journal of Molecular Structure, 2009 (s924-926): 332–337. |
| [9] | Jun HW, Ruenitz PC. Interaction of tricyclic antipsychotic and antidepressant drugs with 1-anilino-8-naphthalenesulfonic acid[J]. Journal of Pharmaceutical Sciences, 1978, 67 (6): 861. DOI:10.1002/jps.2600670637 |
| [10] | He LL, Wang ZX, Wang YX, et al. Studies on the interaction between promethazine and human serum albumin in the presence of flavonoids by spectroscopic and molecular modeling techniques[J]. Colloids & Surfaces B Biointerfaces, 2016 (145): 820–829. |
| [11] | Liu X, Ling Z, Zhou X, et al. Comprehensive spectroscopic probing the interaction and conformation impairment of bovine serum albumin (BSA) by herbicide butachlor[J]. Journal of Photochemistry & Photobiology B Biology, 2016 (162): 332. |
2. Key Laboratory of Pharmacology of Traditional Chinese Medical Formulae, Tianjin 300193, China
 2018, Vol. 35
2018, Vol. 35