文章信息
- 苑珍珍, 杨召, 金鸿宾, 许海委
- YUAN Zhenzhen, YANG Zhao, JIN Hongbin, XU Haiwei
- 柚皮苷通过Fas膜受体通路调控髓核细胞凋亡的机制研究
- Mechanism of naringin on the apoptosis of nucleus pulposus cells through Fas membrane receptor pathway
- 天津中医药, 2018, 35(6): 466-469
- Tianjin Journal of Traditional Chinese Medicine, 2018, 35(6): 466-469
- http://dx.doi.org/10.11656/j.issn.1672-1519.2018.06.17
-
文章历史
- 收稿日期: 2018-01-11
2. 天津医院, 天津 300211
椎间盘退变是引起颈腰部疾患的前提和基础。有统计显示, 世界上一半以上的人口会受到颈腰痛的困扰[1]。椎间盘连接上下两个椎体, 是维持脊柱结构与功能的重要组成部分。髓核细胞是构成椎间盘的主要成分, 可以合成和分泌细胞外基质, 在椎间盘退变过程中发挥着重要作用。骨碎补是治疗肾虚腰痛的常用药, 具有补肾壮骨, 活血止痛的作用。柚皮苷作为其主要组成单体, 研究显示其具有抑制髓核细胞退变的作用, 但作用机制报道较少[2]。本实验选取Fas/FasL通路, 观察柚皮苷对人退变椎间盘髓核细胞凋亡的影响, 进一步阐明其可能的机制。
1 材料与方法 1.1 组织来源人退变椎间盘髓核组织取自1例因椎间盘突出行椎间盘切除手术的患者, 年龄50岁。术前取得患者同意, 并签署知情同意书。取材时严格无菌操作, 取材后1h内细胞室内进行髓核细胞分离培养。
1.2 主要试剂及仪器DMEM培养基(GIBCO公司, 美国), 乙二胺乙酸二钠(EDTA)(Sigma公司, 美国), 胎牛血清(GIBCO公司, 美国), 甲苯胺蓝溶液(北京东胜泰博科技有限公司, 北京); CO2培养箱(Hera-cell公司, 德国), 恒温摇床(Heidolph公司, 德国), 倒置显微镜(OLYMPUS公司, 日本), 细胞培养板(Corning公司, 美国), 高通量实时荧光定量聚合酶链锁反应(PCR)仪(Roche公司, 瑞士), 百级层流细胞室(天津医院细胞工程室)。
1.3 方法 1.3.1 人退变椎间盘髓核细胞的分离和培养将髓核组织用含青霉素和不含青霉素的D-Hanks液各冲洗3遍; 将髓核组织剪碎, 37℃下用0.25%的胰蛋白酶和0.2%的Ⅱ型胶原酶联合消化40 min, 消化期间一直放置于摇床上, 轻轻晃动。收集消化液, 1 000 r/min离心5 min, 去除上清液。用DMEM/F12培养液吹匀细胞, 再次离心, 重复3次。用计数板进行细胞计数, 按1×106接种于底面积为25 cm2培养瓶中, 加入5 mL含青霉素100 U/mL、10%胎牛血清(FBS)的DMEM/F12培养液。37℃、体积分数为5% CO2的培养箱中培养。每3 d换液1次, 90%融合后用浓度为0.05%的胰酶消化传代。
1.3.2 髓核细胞的鉴定番红O染色:P1代细胞多聚甲醛固定后, 1%番红O染色后, 光镜下观察细胞分泌蛋白多糖能力。
甲苯胺蓝染色:细胞固定后, 1%甲苯胺蓝染色10 min, 磷酸盐(PBS)缓冲液冲洗, 封片, 光镜下观察细胞分泌糖胺聚糖能力。
1.3.3 噻唑蓝(MTT)法选择柚皮苷抑制人髓核细胞凋亡的最佳浓度采用MTT法测定不同浓度柚皮苷(0、20、40、80 μg/mL)对髓核细胞凋亡的抑制作用, 髓核细胞加入含柚皮苷的培养基72 h后, 用MTT实验检测柚皮苷对髓核细胞的抑制作用, 利用酶标仪在720 nm波长处测定吸光度A, 筛选柚皮苷抑制髓核细胞凋亡的最佳浓度, 定为实验组, 0 μg/mL柚皮苷为空白对照组。
1.3.4 流式细胞仪测定细胞凋亡率培养髓核细胞24h, 胰酶消化、计数、离心、洗涤、弃上清后再离心、重复洗涤细胞1次, 加入5 μL膜联蛋白V-FITC混合均匀后, 避光孵育15 min后离心洗涤细胞, 加入3 μL碘化丙啶混合均匀后, 流式细胞仪测定细胞凋亡率。
1.3.5 实时荧光定量PCR检测Fas、FasL、Caspase-8基因表达情况实验组和对照组P3代髓核细胞培养7 d后, 常规消化收集细胞, 加入1 mL Trizol试剂, 采用相分离技术提取RNA, 紫外分光光度法测定其在280 nm和260 nm处的吸光度, 计算RNA浓度和纯度(OD260/OD280, 正常值为1.7~2.0)。各组检测基因反转录为cDNA, 以GAPDH为内参基因, 引物(北京奥科鼎盛生物科技有限公司)如表 1。逆转录反应体系、PCR扩增体系以及反应条件, 依据说明书设定。反应完成后进行扩增曲线和熔解曲线分析。基因表达量中检测基因的初始模板量以2-△△Ct表示。
收集髓核细胞, 加入RIPA裂解液冰上裂解, 细胞裂解后, 微孔法测定蛋白浓度, 冲洗后加热, 使蛋白变性, 上样、电泳后转移至聚偏氟乙烯(PVDF)膜, 室温封闭。加入适当稀释的一抗(Fas 1:200, FasL 1:100, Caspase-8 1:100), 室温下反应1 h。加入相应二抗, 漂洗后, 用化学发光成像系统记录结果。
1.4 统计学方法采用SPSS 20.0统计软件包进行分析, 数据以均数±标准差(x±s)表示, 组间比较采用单因素方差分析, 两两比较采用LSD法, P < 0.05为有统计学意义。
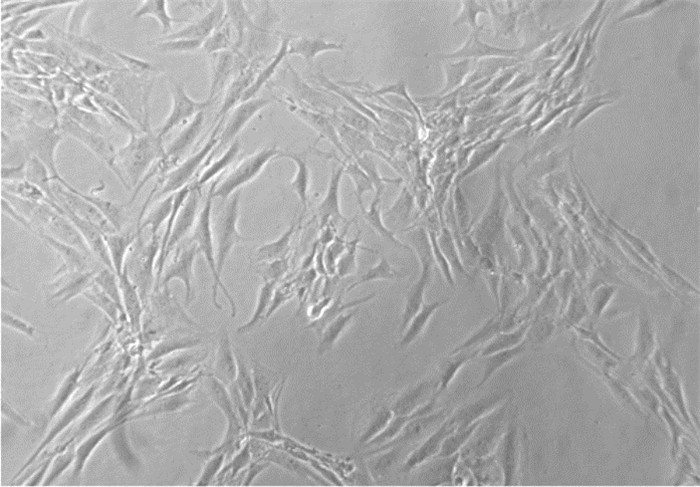
2 结果 2.1 髓核细胞培养以及形态观察原代髓核细胞7 d后基本贴壁, 细胞呈梭形。15 d后, 细胞进入对数生长期, 见图 1。
|
| 图 1 接种7 d后的细胞 Fig. 1 Cells inoculated for 7 days (×200) |
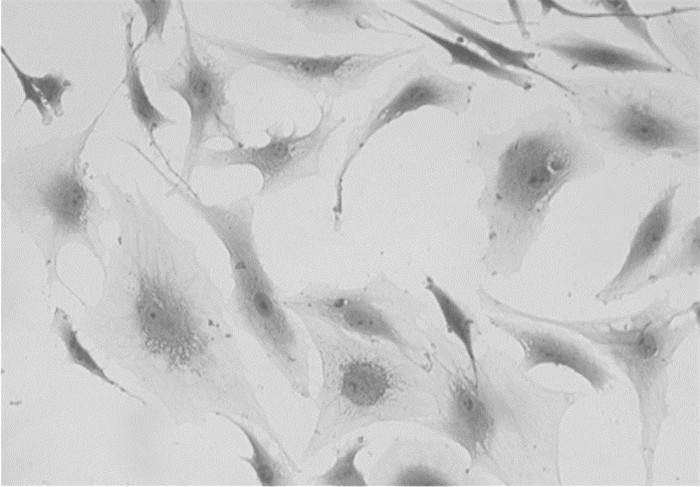
番红-O染色和甲苯胺蓝染色均为阳性, 表明细胞可以分泌蛋白多糖和糖胺多糖, 见图 2、图 3。

|
| 图 2 髓核细胞番红-O染色(×200) Fig. 2 Red -O staining of nucleus pulposus cells (×200) |
|
| 图 3 髓核细胞甲苯胺蓝化学染色(×200) Fig. 3 Toluidine blue staining of nucleus pulposus cells (×200) |
对照组吸光度为(0.26±0.02), 与对照组相比, 20 μg/mL柚皮苷组吸光度明显升高, 具有统计学意义(P < 0.01), 而40、80 μg/mL柚皮苷组无统计学意义(P>0.05)。与20 μg/mL柚皮苷组比较, 40、80 μg/mL柚皮苷组吸光度明显降低(P < 0.01)。80 μg/mL柚皮苷组吸光度值无明显差异(P>0.05)。见表 2。

|
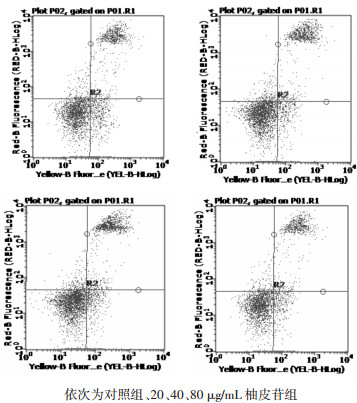
对照组细胞凋亡率为(12.48±1.38)%, 加入不同浓度柚皮苷后, 凋亡率均下降, 与对照组相比, 20、40 μg/mL柚皮苷组抑制细胞凋亡具有统计学意义(P < 0.05), 其中20 μg/mL柚皮苷对细胞凋亡抑制最明显(P < 0.01), 与20 μg/mL柚皮苷组比较, 40、80 μg/mL柚皮苷组细胞凋亡率较高(P < 0.01)。另外, 40 μg/mL柚皮苷组优于80 μg/ml柚皮苷组(P < 0.05), 见表 3、图 4。根据MTT与流式细胞的筛选结果采用20 μg/mL的柚皮苷, 定为实验组进行后续实验研究。
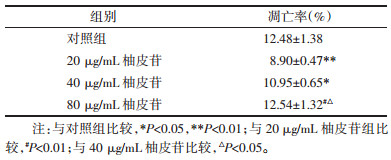
|
|
| 图 4 各组抑制人退变髓核细胞凋亡的流式细胞图片 Fig. 4 Flow cytometry in each group to inhibit the apoptosis of degenerative nucleus pulposus cells |
|
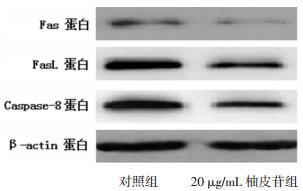
| 图 5 Western-blot检测Fas、FasL、Caspase-8蛋白表达 Fig. 5 Western-blot detection of Fas, FasL and Caspase-8 protein expression |
20 μg/mL柚皮苷组比对照组可以明显抑制Fas、FasL、Caspase-8基因的表达(P < 0.01)。柚皮苷组与对照组对于各个基因表达的影响, 见表 4。
腰椎间盘髓核组织主要由髓核细胞、蛋白多糖、糖胺多糖Ⅰ、Ⅰ型和Ⅱ型胶原及水分构成。成人髓核细胞为类软骨细胞, 主要分泌蛋白多糖、糖胺多糖、Ⅱ型胶原等细胞外基质[3]。随着髓核细胞凋亡增加, 细胞外基质含量下降, 水分减少, 椎间盘退变趋势明显增加。而细胞外基质的减少会进一步加剧髓核细胞的凋亡, 形成恶性循环, 腰椎间盘退变日趋加重[4]。本实验采用人退变椎间盘髓核组织, 分离培养其细胞, 番红O染色阳性显示细胞分泌蛋白多糖, 甲苯胺蓝染色阳性说明细胞可以分泌Ⅱ型胶原, 证明此为髓核类软骨细胞。
腰椎间盘退变中医属"腰痹"范畴, 病机主要为肝肾亏虚, 筋脉失养。中药骨碎补具有补肾壮骨、续伤止痛的作用, 常用于腰椎间盘退变的治疗。柚皮苷是黄酮类物质, 是中药骨碎补主要单体成分之一, 具有抗炎、抗氧化、促进骨形成、抑制骨破坏、促进神经细胞再生及修复等作用[5]。有研究显示, 柚皮苷能有效地促进人退变髓核细胞的增殖, 提高细胞活性, 这可能与其促进髓核细胞蛋白多糖、骨形态发生蛋白-2(BMP-2)的表达, 抑制肿瘤坏死因子-α(TNF-α)、SOX6和基质金属蛋白酶-3(MMP-3)的表达相关[6-7]。本实验通过MTT法和流式细胞法检测20 μg/mL柚皮苷为抑制人髓核细胞凋亡的最佳浓度, 与相关文献报道一致, 并用此浓度柚皮苷进行相关基因及蛋白检测。
细胞凋亡, 又称程序化细胞死亡, 是由基因调控的细胞主动死亡过程[8]。其凋亡途径主要有3条:死亡受体复合体通路(膜受体通路)、线粒体通路和内质网通路。死亡受体通路主要包括TNFR途径、TRAIL途径、Fas/FasL途径。细胞凋亡可能通过Fas/FasL系统触发死亡信号复合体介导途径实现。死亡受体通路中, Fas与FasL结合后, 形成死亡诱导信号复合体, 启动Caspase-8/Caspase-10, 可以通过Bid等细胞因子转导, 或直接激活凋亡执行蛋白Caspase-3等, 完成细胞凋亡[9-10]。qRT-PCR结果显示柚皮苷组可以下调Fas、FasL、Caspase-8基因表达, Western-blot结果显示柚皮苷可以抑制Fas蛋白表达, 说明柚皮苷可能通过调控Fas/FasL死亡受体通路, 抑制髓核细胞凋亡。
本实验结果显示, 柚皮苷可能通过调控Fas/FasL死亡受体通路抑制人髓核细胞凋亡, 为临床治疗腰痛提供新的途径。但是柚皮苷抑制髓核细胞凋亡机制较为复杂, 是否还通过其他途径, 需要进一步验证。相信随着椎间盘退变研究的逐步深入, 对其退变机制认识逐渐深刻, 会有更多、更有效的治疗手段服务于广大患者。
| [1] | Nianhu L, Camden W, Zhanwang X, et al. Therapeutic effects of naringin on degenerative human nucleus pulposus cells for disco-genic low back pain[J]. The Spine Journal, 2016, 16 (10): 1231–1237. DOI:10.1016/j.spinee.2016.05.007 |
| [2] | 朱慧锋, 王唯佳, 王珠美. 骨碎补研究进展[J]. 中国骨伤, 2009, 22 (1): 66–67. |
| [3] | Samartzis D, Borthakur A, Belfer I, et al. Novel diagnostic and prognostic methods for disc degeneration and low back pain[J]. Spine J, 2015, 15 (9): 1919–1932. DOI:10.1016/j.spinee.2014.09.010 |
| [4] | Wang F, Cai F, Shi R, et al. Aging and age related stresses:a senes-cence mechanism of intervertebral disc degeneration[J]. Osteoarthritis Cartilage, 2016, 24 (3): 398–408. DOI:10.1016/j.joca.2015.09.019 |
| [5] | Nyane NA, Tlaila TB, Malefane TG, et al. Metformin-like antidia-betic, cardio-protective and non-glycemic effects of naringenin:Molecular and pharmacological insights[J]. Eur J Pharmacol, 2017, 80 (15): 103–111. |
| [6] | 翟远坤, 牛银波, 潘亚磊, 等. 柚皮苷对体外培养乳鼠颅骨成骨细胞增殖和分化成熟的影响[J]. 中国中药杂志, 2013, 38 (1): 105–111. |
| [7] | 李风波, 孙晓雷, 马剑雄, 等. 柚皮苷对破骨细胞分化的影响[J]. 中国中药杂志, 2015, 40 (2): 308–312. |
| [8] | 赵彦超, 顾耘. 细胞凋亡通路研究进展[J]. 现代医学, 2013, 41 (4): 285–288. |
| [9] | Calmon-Hamaty F, Audo R, Combe B, et al. Targeting the Fas/FasL system in Rheumatoid Arthritis therapy:Promising or risky[J]. Cytokine, 2015, 75 (2): 228–233. DOI:10.1016/j.cyto.2014.10.004 |
| [10] | Sun Z, Wan ZY, Guo YS, et al. FasL on human nucleus pulposus cells prevents angiogenesis in the disc by inducing Fas-mediated apoptosis of vascular endothelial cells[J]. Int J Clin Exp Pathol, 2013, 6 (11): 2376–2385. |
2. Tianjin Hospital, Tianjin 300211, China
 2018, Vol. 35
2018, Vol. 35