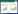文章信息
- 雷洋洋, 杨波, 裴明, 林燕, 杨洪涛
- LEI Yangyang, YANG Bo, PEI Ming, LIN Yan, YANG Hongtao
- 扶肾方对尿毒症大鼠腹膜间充质TGF-β1、E-cadherin和α-SMA表达的影响
- Effects of Fushen recipe on expression of TGF-β1, E-cadherin and α-SMA in peritoneal mesenchymal membranes of uremia rats
- 天津中医药, 2018, 35(7): 521-525
- Tianjin Journal of Traditional Chinese Medicine, 2018, 35(7): 521-525
- http://dx.doi.org/10.11656/j.issn.1672-1519.2018.07.13
-
文章历史
- 收稿日期: 2018-03-15
腹膜纤维化作为长程腹膜透析常见并发症,可导致腹膜超滤与转运功能衰竭,腹膜结构、功能丧失。因此有必要探寻能够干预甚至逆转腹膜纤维化进程的分子机制,间充质间质转化(EMT)是腹膜纤维化起始和可逆环节,有效调控EMT可抑制甚至逆转早期腹膜纤维化,本课题拟采用天津中医药大学第一附属医院肾病科之扶肾方以中医学“和法”理论为宗,探讨扶肾方对尿毒症大鼠腹膜间充质EMT影响,为中医治疗腹透腹膜纤维化提供理论依据。
1 材料与方法 1.1 实验动物SPF级雄性SD大鼠50只,体质量180~200 g,鼠龄6~8周,由中国人民解放军军事医学科学院实验动物中心提供。
1.2 主要实验试剂与仪器扶肾方中药饮片(天津中医药大学第一附属医院提供);肌酐生化试剂盒与尿素氮试剂盒(南京建成科技有限公司);转化生长因子-β1(TGF-β1)(北京中杉金桥生物科技有限公司);聚合酶链反应(PCR)试剂盒(北京天根生化科技有限公司);Bio-Rad CFX96型荧光定量PCR仪(美国伯乐公司);普通光学显微镜(日本Olympus公司产品);微量移液器(美国Eppendorf公司);低温高速离心机(美国Beckman公司);-20 ℃/4 ℃冰箱(青岛海尔)。
1.3 分组与给药50只SD大鼠适应性喂养1周后,随机分为5组,每组10只,每日给予扶肾方中药灌胃,实验周期为6周,具体见表 1。
50只雄性SD实验大鼠在处死之前,目内眦取血,3 000 r/min离心15 min后,取上清,检测血清肌酐值和血清尿素氮值。
1.5 扶肾方含药血清的制备方法采用清洁级雄性SD大鼠,按照人的临床剂量折算大鼠的灌胃量,每组连续灌胃7 d,在最后1次灌胃后2 h,取血分离含药血清,同时取正常组大鼠血,0.45 μm微孔滤膜过滤除菌,56 ℃,30 min灭活补体,制成含药血清冰箱保存备用,-20 ℃含药血清有效成分的浓度及有效成分由南开大学高分子化学研究所采用高效液相色谱法测定。
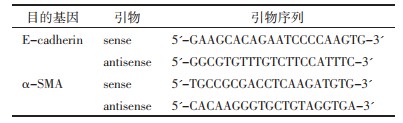
1.6 检测指标采用逆转录-聚合酶链反应(RT-PCR)法检测E-钙黏素(E-cadherin)和α-平滑肌肌动蛋白(α-SMA),提取组织总RNA,将总RNA逆转录为cDNA。PCR的总反应体系为20 uL,将样品放入PCR仪,设定反应参数后开始进行实验数据的采集,引物序列见表 2;采用酶联免疫吸附(ELISA)法检测TGF-β1含量的变化;采用碱性苦味酸比色法测定大鼠血清肌酐、尿素氮含量。
取大鼠壁层腹膜组织,常规固定、脱水、石蜡包埋、切片后,行苏木精-伊红(HE)染色,光镜下观察大鼠腹膜形态改变。
1.8 统计学方法采用SPSS 20.0软件进行分析,实验数据中的计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD法,P < 0.05认为差异有统计学意义。
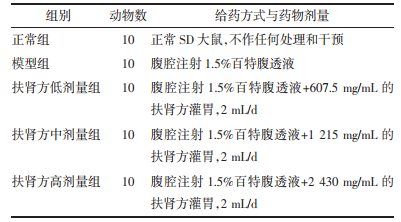
2 结果 2.1 动物模型鉴定在尿毒症模型复制过程中,若血清肌酐和尿素氮较正常组明显升高,则视为尿毒症模型成功。本实验检测血清肌酐和尿素氮,实验结果显示,与正常组相比,模型组血清肌酐、尿素氮均明显升高,结果有统计学差异(P < 0.01或P < 0.05),符合尿毒症模型的特征;而与模型组相比,扶肾方中、高剂量组肌酐及尿素氮的含量有降低的趋势,且高剂量组的降低趋势更为明显,差异有统计学意义(P < 0.05),说明不同剂量的扶肾方均有降低血清肌酐和血清尿素氮的作用。见表 3。
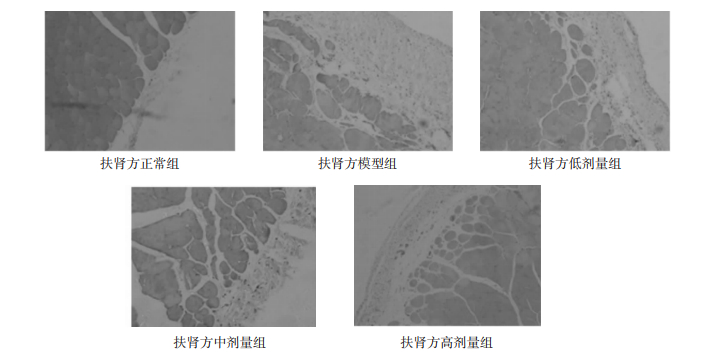
HE染色结果显示,正常组的大鼠壁层腹膜组织结构相对完整,间皮下基质较薄。与正常组相比,模型组有腹膜间皮细胞的变性、脱落,间皮下基质明显增厚,炎症细胞浸润以及血管增生。治疗组相对模型组,腹膜间皮细胞相对连续,炎症细胞浸润和血管新生现象明显减少,尤高剂量组的效果最为明显。见图 1。
|
| 图 1 大鼠腹膜HE染色结果(×200) Fig. 1 HE staining of rat peritoneum(×200) |
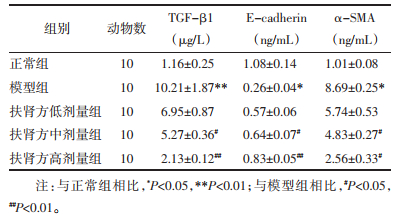
结果显示,模型组E-cadherin较正常组表达下降,差异有统计学意义(P < 0.05),TGF-β1、α-SMA较正常组表达上调,差异有统计学意义(P < 0.01)。与模型组相比,扶肾方干预后的各组E-cadherin表达均有所上调,且以高剂量组上调最为明显(P < 0.01);TGF-β1、α-SMA中、高剂量组有统计学差异(P < 0.05或P < 0.01),低剂量组较正常组有下调趋势,但结果无统计学意义。见表 4。
据中国慢性肾脏病流行病学调查,中国有1.2亿慢性肾脏病人口和不少于100万的尿毒症患者群体[1]。腹膜透析(PD)作为一种对终末期肾脏病(ESRD)的有效治疗方式[2],具有利于残余肾功能保护,中分子溶质清除较好,早期生存率、生活质量更优,患者疾病负担小,可以更大程度回归社会等优势,已在国家医疗卫生层面和人民健康的战略层面占据越来越重要的地位。据中国研究数据服务(CNRDS)数据,截止2013年底中国有腹膜透析患者4.6万人;而在全球范围,腹膜透析患者已超25万人。由于临床最常用的腹膜透析液以葡萄糖为渗透剂,使得腹膜间皮细胞长期浸润在腹透液中,而腹透液属于生理不相容溶液,容易发生上皮EMT,导致腹膜纤维化,使得腹膜失去超滤能力,发生超滤衰竭。
腹膜纤维化以细胞外基质过度沉积、组织结构重塑为主要特征,是导致脏器功能丧失的主要原因之一[3]。目前纤维化疾病的发生及发展机制尚不明确,有研究提示炎症反应的激活、某些促纤维化因子的活化包含在纤维化的过程当中[4-5],部分分子信号通路已被证实参与腹膜纤维化的形成,包括TGFβ介导的信号通路,如Smad通路、PI3k/AKT/ mTOR通路、MEK/ERK/NKκB通路、受体酪氨酸激酶(RTKs)介导的信号通路、Wnt/β-catenin信号通路和Notch信号通路等[6-7]。
EMT被认为发生于腹膜纤维化的早期阶段并在腹膜纤维化中起到了关键性的作用[8]。EMT以细胞间连接丢失(E-cadherin表达下调)、细胞骨架重塑(α-SMA表达上调),从而导致细胞极性丢失及梭形结构的形成为特征。而作为长程PD患者的常见并发症,腹膜纤维化可导致维持性PD患者出现腹膜超滤与转运功能衰竭,腹膜结构和功能丧失,最终掉队退出治疗[9]。
随着透析时间增长,腹膜结构和功能改变的机制仍未完全明了,研究表明在纤维化早期有可能阻止甚至逆转其病变,但具体都经由何机制得以逆转亦不确切可知。故而在此背景下,探寻能够有效干预甚至逆转长程PD基础上腹膜纤维化进程的分子机制即成为当前亟待解决的重要临床与科研现实问题。
研究发现[9],上皮-EMT是早期腹膜损伤的关键一步,这个过程表现为细胞间连接受损、骨架重排以及基底膜降解,进而细胞呈现游走性和侵袭性的特征,此时,细胞间黏附连接蛋白E-cadherin表达进行性下降,α-SMA作为一种细胞转分化为肌成纤维细胞的标记蛋白表达增强[10-11],能够促进上皮细胞EMT的发生,同时还能增加细胞外基质的合成,减少细胞外基质的降解,从而导致其过度沉积,是引起腹膜纤维化发生的关键因子之一。本实验在SD大鼠尿毒症模型的基础上制备腹膜纤维化的模型,此模型贴近临床实际。通过检测动物模型的肌酐及尿素氮指标,其值明显升高,HE染色见腹膜间皮细胞的变性、脱落,间皮下基质增厚,炎症细胞浸润以及血管增生,腹膜转分化的相关指标E-cadherin表达下调,α-SMA表达呈现明显的上调趋势,符合腹膜纤维化特征。而在给予不同剂量的扶肾方用药干预后,炎症细胞浸润以及血管增生现象较模型组明显减少,E-cadherin表达上调,α-SMA表达呈现明显的下调趋势,研究结果提示腹膜EMT与E-cadherin和α-SMA的表达密切相关。
TGF-β1是转化生长因子-β(TGF-β)生长因子家族成员之一,分布在多种细胞内,在肾脏表达量最高,活性最强,是一种多向性,多效性的细胞因子,通过细胞表面的受体信号转导途径调节细胞生长周期、增殖分化、细胞外基质的形成以及免疫等功能[12-13],是一种有助于调节腹膜纤维化的促细胞因子[14],能够促进上皮细胞EMT的发生,同时还能通过增加细胞外基质的合成并减少细胞外基质的降解,从而导致其过度沉积,最终导致相关组织的纤维化。长期腹膜透析的患者AGEs在腹膜周围存在大量蓄积,并伴有TGF-β1的产生,最终导致腹膜纤维化的发生[15]。
本实验TGF-β1的检测结果中,经扶肾方干预后,TGF-β1的表达出现下调趋势,提示扶肾方通过抑制受体复合物的形成而抑制腹膜纤维化。
中医理论认为,慢性肾脏病的病变根本是肾气亏虚,病机关键在于肾脏主水封藏功能和失职所致。其中阴阳失调是核心,“阴平阳秘,精神乃治”,是肾脏乃至全身脏器免受病变侵害的关键。正如《素问·生气通天论》所谓“阴平阳秘”,即人体阴阳动态平衡协调是健康的根本。腹膜透析系慢性肾功能衰竭终末期的替代治疗手段,此时患者病程迁延,多呈脾肾亏虚,正气不足之象,同时久病血瘀,经络涩滞,水湿不运,浊毒化生,日久瘀浊互结,癥瘕内见,而呈邪实留恋之势。因此,该阶段临床遣方用药尤须慎重精当,以免偏颇丛生,影响疾病向愈。因此治疗中应在调补阴阳的基础上,重视和解少阳,调和气血,即运用“和法”,和缓地调整机体的阴阳失调、升降失常、气血失和。
和法是中医传统治疗八法之一, 是利用药物的疏通调和作用, 以达解除病邪, 或调和脏腑、阴阳、表里失调之证得以解除, 属于调整人体机能的一种方法[16]。扶肾方以中医学“和法”理论为宗,以疗效确切的经方对药为基础,融“和”、“补”、“消”为一体[17],组方合理精当, 选药简约质朴。其以和法为总则,用药和缓,平调阴阳;补泻兼施,扶正祛邪,性质平和,统筹兼顾。方用陈皮、半夏、黄芪、当归、仙灵脾、丹参、大黄、鬼箭羽等组方。既往研究证实扶肾颗粒可有效延缓腹膜纤维化进程,进而提高透析效能,改善患者生存质量[18-19]。
综上所述,本课题研究结果显示,扶肾方各组与模型组对比,抑制TGF-β1表达,促进E-cadherin表达,其表达进行性上调,同时抑制α-SMA表达,进行性下调α-SMA表达,且随着扶肾方剂量的加大,其作用更加明显,说明扶肾方在腹膜组织纤维化EMT过程中起着一定作用。为临床上进一步运用中医药减轻腹膜损伤,延缓腹膜纤维化提供了理论支持,也为提高患者的生活质量,延长生存期提供了可能。
| [1] | Zhang L, Wang F, Wang L, et al. Prevalence of chronic kidney disease in China:a cross-sectional survey[J]. Lancet, 2012, 379 (9818): 815–822. DOI:10.1016/S0140-6736(12)60033-6 |
| [2] | Kawanishi H, Moriishi M, Tsuchiya S. Evaluation of dialysis dose during combination therapy with peritoneal dialysis and hemodialysis[J]. Adv Perit Dial, 2007, 23 (5): 135–139. |
| [3] | Korte MR, Sampimon DE, Lingsma HF, et al. Dutch Multicenter EPS Study. Risk factors associated with encapsulating peritoneal sclerosis in Dutch EPS study[J]. Perit Dial Int, 2011, 31 (3): 269–278. DOI:10.3747/pdi.2010.00167 |
| [4] | Kitamura M, Nishino T, Obata Y, et al. New insights into therapeutic strategies for the treatment of peritoneal fibrosis:learning from histochemical analyses of animal models[J]. Acta Histochemica Et Cytochemica, 2014, 47 (4): 133–143. DOI:10.1267/ahc.14025 |
| [5] | Strippoli R, Morenovicente R, Battistelli C, et al. Molecular mechanisms underlying peritoneal EMT and fibrosis[J]. Stem Cell International, 2016, 2016 (4): 1–11. |
| [6] | Zhou Q, Bajo MA, Del Peso G, et al. Preventing peritoneal membrane fibrosis in peritoneal dialysis patients[J]. Kidney Int, 2016, 90 (3): 515–524. DOI:10.1016/j.kint.2016.03.040 |
| [7] | 唐雅娜, 丁劲松. 腹腔给药在腹膜纤维化防治中的应用[J]. 中南药学, 2017, 15 (11): 1577–1581. DOI:10.7539/j.issn.1672-2981.2017.11.016 |
| [8] | Liu J, Zeng L, Zhao Y, et al. Selenium suppresses lipopolysaccharide-induced fibrosis in peritoneal mesothelial cells through inhibition of epithelial-to-mesenchymal transition[J]. Biological Trace Element Research, 2014, 161 (2): 202–209. DOI:10.1007/s12011-014-0091-8 |
| [9] | Aruga S, Hamada C, Inuma J, et al. Patterns of matrix metalloproteinases and transforming growth factor-beta 1 expression during peritoneal repair in chlorhexidine induced peritoneal fibrosis mice[J]. Hong Kong Journal of Nephrolo, 2012, 14 (1): 7–16. DOI:10.1016/j.hkjn.2012.01.002 |
| [10] | Zeisberg M, Neilson EG. Biomarkers for epithelial-mesenchymal transitions[J]. Clin Invest, 2009, 119 (6): 1429–1437. DOI:10.1172/JCI36183 |
| [11] | 邓英辉, 林琼真, 于洁, 等. 黄芪注射液改善肾间质纤维化的作用机制研究[J]. 中国中西医结合肾病杂志, 2008, 9 (5): 393–396. |
| [12] | 赵俊芳, 刘成, 刘成海. 转化生长因子β胞内信号转导与Smads蛋白[J]. 中国病理生理学杂志, 2002, 18 (3): 321–325. |
| [13] | 倪露露, 杨佳, 骆莹滨, 等. TGF-β通过不同机制对肿瘤侵袭转移影响的研究述评[J]. 辽宁中医杂志, 2014, 41 (8): 1606–1608. |
| [14] | Margetts PJ, Oh KH, Kolb M. Transforming growth factor -beta:im-portance in long-term peritoneal membrane changes[J]. Perit Dial Int, 2005, 25 (Suppl 3): S15–S17. |
| [15] | 陈磊. 晚期糖基化终末产物在纤维化中的作用机制[J]. 西部医学, 2008, 20 (3): 643–644. |
| [16] | 时乐, 吴晓琦, 李云. 浅论和法的内涵与外延[J]. 新疆中医药, 2003, 21 (1): 1–2. |
| [17] | 李洁, 杨洪涛, 杨波. 扶肾颗粒基于"和、消、补"中医三法防治腹膜纤维化的组方分析[J]. 中国中西医结合肾病杂志, 2014, 15 (8): 737–738. |
| [18] | 杨洪涛, 张建朋, 赵菁莉, 等. 扶肾颗粒对腹膜透析相关性腹膜纤维化的影响及其作用机制的实验研究[J]. 中国中西医结合肾病杂志, 2012, 13 (6): 482–486. |
| [19] | 杨洪涛, 曹式丽, 赵菁莉, 等. 扶肾颗粒提高腹透患者生存质量、防治腹膜纤维化相关研究[J]. 天津中医药, 2013, 30 (11): 659. DOI:10.11656/j.issn.1672-1519.2013.11.06 |
 2018, Vol. 35
2018, Vol. 35