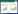文章信息
- 戎萍, 彭博, 张喜莲, 赵伟, 张雪荣, 王伟, 张雪竹, 马融
- RONG Ping, PENG Bo, ZHANG Xilian, ZHAO Wei, ZHANG Xuerong, WANG Wei, ZHANG Xuezhu, MA Rong
- 基于益肾填精法的茸菖胶囊对无镁诱导癫痫模型自噬相关蛋白影响的研究
- Effects of Rongchang capsule on autophagy-related proteins in epilepsy model induced by magnesium-free-treatment based on enriching kidney essence method
- 天津中医药, 2018, 35(7): 531-534
- Tianjin Journal of Traditional Chinese Medicine, 2018, 35(7): 531-534
- http://dx.doi.org/10.11656/j.issn.1672-1519.2018.07.15
-
文章历史
- 收稿日期: 2018-02-20
2. 天津大学, 天津 300072;
3. 新疆伊犁州中医医院儿科, 伊犁 835000;
4. 湖北省中医院儿科, 武汉 430061
癫痫是小儿神经系统的常见病之一,以反复癫痫发作为共同特征的慢性脑部疾病状态。癫痫发作与神经元损伤密切相关。一方面,神经细胞坏死、缺失、结构异常等使脑细胞维持电位稳定的能力下降,一旦有诱发因素则易引发癫痫。另一方面,长期或反复的癫痫活动,可对未成熟大脑的发育、神经元功能、可塑性相关基因表达造成长期不良影响[1-2]。细胞自噬被称为Ⅱ型程序性细胞死亡,其在癫痫等神经系统疾病中的作用正成为研究的热点。细胞自噬的作用具有双重性,低水平的自噬对细胞具有保护作用,过度的自噬可致神经元损害。Beclin-1是自噬的正调节蛋白,是介导其他自噬蛋白定位于前自噬小体的关键因子。研究表明反复惊厥新生大鼠皮质Beclin-1水平明显上调,自噬抑制剂3-甲基腺嘌呤(3-MA)通过抑制Beclin-1表达,参与自噬途径的调控[3]。B细胞淋巴瘤-2(Bcl-2)能够减弱Beclin-1与Vps34的相互作用,使其他自噬相关蛋白难以结合到自噬体膜上,从而抑制自噬的发生[4]。课题组前期研究已证实,以“益肾填精法”为主的茸菖胶囊抗癫痫及改善认知损害疗效显著[5],在保护受损神经细胞方面具有明显优势[6-7],其机制是否与调控海马神经元自噬过程相关尚未研究。本研究通过构建无镁诱导的癫痫模型,观察茸菖胶囊干预后6、12、24、72 h对海马Beclin-1、Bcl-2蛋白表达的影响,探讨其抗癫痫和神经保护作用的自噬调控机制。
1 实验材料 1.1 实验动物健康成年大耳白家兔30只,雌雄均可,体质量2~2.5 kg,购自北京金牧阳实验动物养殖有限责任公司[合格证号:SCXK(京)2015-0005]。24 h内新生SD大鼠50只,购自北京芳元缘养殖场。
1.2 实验药品与试剂茸菖胶囊(由天津中医药大学第一附属医院提供,批件号:津药制字Z20070735);3-MA(Sigma公司)。5x SDS凝胶加样缓冲液、显影液、定影液、胰酶细胞消化液等购自碧云天生物技术公司;30%丙烯酰胺Acr/Bic、过硫酸铵、十二烷基硫酸钠、甘氨酸、三羟甲基氨基甲烷等购自Ameresco公司;吐温、MgCl2·6H2O、NaCl、CaCl2等购自Sigma公司;PageRuler Prestained Protein Ladder(Thermo scientific);ECL发光液(普利莱基因技术有限责任公司)、甲醇(国药集团)、丽春红(碧云天生物技术研究所)。
2 实验方法 2.1 脑脊液提取家兔予茸菖胶囊灌胃3 d,每日剂量按生药为3.64 g/kg,于末次给药1 h后取脑脊液。耳缘动脉注入空气处死后,于小脑延髓池穿刺针穿刺成功后,用一次性1 mL注射器吸取600~800 μL清亮脑脊液,放入灭菌后的EP管中,于冰箱-70 ℃冻存。
2.2 原代海马神经元的培养取新生SD大鼠海马,乙醇消毒后断头取脑,浸置于冰磷酸盐缓冲液(PBS)溶液中,钝性分离出海马,剥离脑膜后快速剪成碎块,用胰蛋白酶消化20 min,加入冰PBS溶液终止消化,加入种植培养液,以每毫升2×105~3×105个的浓度将神经元接种于L-多聚赖氨酸包被好的培养皿中,置于37 ℃、5%CO2孵箱中培养4 h,之后更换维持培养液。
2.3 海马神经元癫痫模型建立参照Sombati等[8]人的癫痫模型制备方法将体外培养至第9天时用无镁HBSS替代含镁正常培养基,温箱中孵育3 h,建立癫痫细胞模型。继而将HBSS溶液再次换为含镁Neurobasal培养基继续培养。该实验模型建立后需要电生理实验鉴定模型建立是否成功。
2.4 实验分组当海马神经元培养至第9天时,将其分为下述6组并进行相应处理。正常组、模型组、3-MA组、5%茸菖胶囊组、10%茸菖胶囊组、20%茸菖胶囊组,分别将原维持液更换为含镁HBSS、无镁细胞外液、无镁细胞外液中加入3-MA(5mmol/L)、无镁外液中加入5%茸菖胶囊、10%茸菖胶囊、20%茸菖胶囊脑脊液,培养3 h后更换为Neurobasal培养液继续培养6、12、24、72 h用于实验。
2.5 蛋白免疫印迹(Western blot)法检测目标蛋白表达提取细胞总蛋白并测定蛋白浓度后,将样品蛋白进行凝胶电泳、转膜、封闭、一抗孵育(内参抗体稀释度为1:1 000)、二抗孵育(二抗稀释比例为1:10 000)等步骤,ECL法显色(暗室操作),凝胶图像分析系统测定光密度值,用ImageJ 1.43软件分析灰度值。
2.6 统计学处理采用SPSS 17.0统计软件,计量数据以均数±标准差(x±s)表示,不同时间点比较采用重复测量方差分析,多组间两两比较采用LSD检验。P < 0.05为差异有统计学意义。
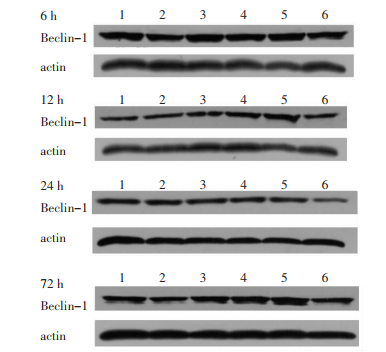
3 结果 3.1 各组大鼠海马Beclin-1蛋白表达比较经重复测量方差分析,各组间海马Beclin-1蛋白表达水平总体均数差异有统计学意义(P < 0.05),各时间点Beclin-1蛋白表达水平总体均数差异有统计学意义(P < 0.01),时间和分组不具有交互作用(P > 0.05)。同一组内,各时点Beclin-1蛋白比较差异均无统计学意义(P > 0.05)。与同一时点正常组比较,模型组Beclin-1蛋白表达无显著变化(P > 0.05);与同一时点模型组比较,6 h 20%茸菖胶囊组及72 h 5%茸菖胶囊组显著升高(P < 0.05)。见图 1、表 1。
|
| 图 1 不同时点各组Beclin-1蛋白电泳图 Fig. 1 Electrophoretogram of Beclin -1 protein in each group at different time 1:正常组;2:模型组;3:5%茸菖组;4:10%茸菖组;5:20%茸菖组;6:3-MA组 |
|
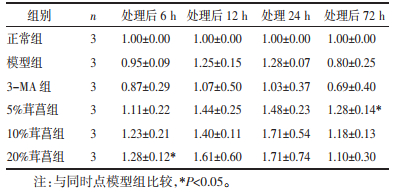
经重复测量方差分析,各组间海马Bcl-2蛋白表达水平总体均数差异有统计学意义(P < 0.01),各时间点Bcl-2蛋白表达水平总体均数差异有统计学意义(P < 0.01),时间和分组不具有交互作用(P > 0.05)。同一组内,各时点Bcl-2蛋白比较差异均无统计学意义(P > 0.05)。与同一时点正常组比较,6 h模型组Bcl-2蛋白表达显著降低(P < 0.01)。与同一时点模型组比较,12 h 20%茸菖胶囊组,24 h 20%茸菖胶囊组,72 h 5%茸菖胶囊组、10%茸菖胶囊组、20%茸菖胶囊组Bcl-2蛋白表达均显著增强(P < 0.05或P < 0.01)。72 h茸菖胶囊高、中、低三个浓度比较,20%茸菖胶囊组Bcl-2蛋白表达较5%茸菖胶囊组和10%茸菖胶囊组显著增强(P < 0.05),5%茸菖胶囊组与10%茸菖胶囊组比较无统计学差异(P > 0.05)。见图 2、表 2。
|
| 图 2 不同时点各组Bcl-2蛋白电泳图 Fig. 2 Electrophoretogram of Bcl-2 protein in each group at different time 1:正常组;2:模型组;3:5%茸菖组;4:10%茸菖组;5:20%茸菖组;6:3-MA组 |
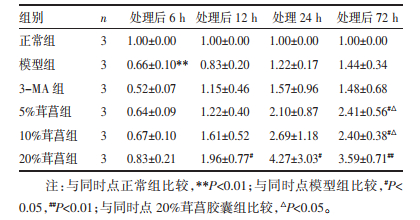
|
与同一时点正常组比较,12 h模型组海马神经元LC3B蛋白表达显著增强(P < 0.05)。与同一时点模型组比较,12 h 20%茸菖胶囊组LC3B蛋白表达显著下降(P < 0.05)。见表 3。
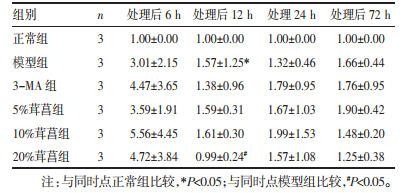
|
近年来自噬在癫痫发生、发展过程中的重要作用逐渐受到认识。癫痫发作会引起氧化应激、离子通道异常、谷氨酸神经兴奋毒性、三磷腺苷耗竭、肿瘤坏死因子-α升高等,在这些情况下都会导致神经元自噬的发生。自噬被过度激活,可致神经元死亡,加重海马损伤及癫痫发作,并造成学习记忆及情感障碍[9-10]。在自噬启动阶段,Beclin-1是自噬的调控基因,发挥自噬正调节作用。而Bcl-2则能够抑制自噬的发生[11]。Beclin-1与Bcl-2作用而调控自噬与凋亡之间的平衡,自癫痫发作12~8 h Beclin-1蛋白水平开始升高,而Bcl-2蛋白水平自癫痫发作24~48 h逐渐下降[12]。研究表明,自噬抑制剂能够通过调节自噬相关蛋白Beclin-1、Bcl-2的表达,调控癫痫或惊厥大鼠海马自噬活性,从而减少海马神经元的损伤,起到抗癫痫及神经保护作用[3, 13-14]。
传统中医认为,癫痫的病机关键为风痰闭阻,多采用熄风豁痰开窍法治疗。马融教授认为,癫痫发作对于发育期的儿童而言,造成的神经损害更明显,且长期反复的癫痫发作常导致认知障碍的发生,因此治疗小儿癫痫应抗痫与益智并举。根据小儿“肾常虚”的生理特点及肾与脑的密切关系,提出小儿癫痫伴认知障碍的病机关键在于“肾精亏虚、风痰闭阻”。据此研制了茸菖胶囊(原名抗痫增智颗粒),重在抗痫与益智并举。课题组前期研究已证实,以“益肾填精法”为主的茸菖胶囊抗癫痫及改善认知损害疗效显著,在保护受损神经细胞方面具有明显优势,但这是否与茸菖胶囊调控受损神经元自噬活性有关尚未研究。本研究结果显示:1)茸菖胶囊可影响Beclin-1蛋白表达。高浓度茸菖胶囊脑脊液可在短时间内促进Beclin-1蛋白表达明显,低浓度茸菖胶囊脑脊液在维持Beclin-1蛋白表达作用较优。2)茸菖胶囊可促进Bcl-2蛋白表达抑制细胞自噬,其促进作用与给药浓度相关。综上所述,基于益肾填精法的茸菖胶囊可能通过影响Beclin-1表达干预自噬过程,促进Bcl-2蛋白表达抑制细胞自噬,发挥抗癫痫及保护海马神经元的作用。
| [1] | Dub CM, Zhou JL, Hamamura M, et al. Cognitive dysfunction after experimental febrile seizures[J]. ExpNeurol, 2009, 215 (1): 167–177. |
| [2] | 李超, 倪宏, 王浙东, 等. 运动训练对发育期大鼠反复惊厥所致认知损害的干预及机制研究[J]. 中国康复医学杂志, 2010, 25 (3): 205–210. |
| [3] | 巩勇, 倪宏, 陶陆阳. 3-甲基腺嘌呤对反复惊厥新生大鼠大脑皮层自噬相关蛋白Beclin-1表达的影响[J]. 实用儿科临床杂志, 2009, 26 (16): 1261–1263. |
| [4] | Sinha S, Levine B. The autophagy effector Beclin 1:a novel BH3-only protein[J]. Oncogene, 2008, 27 (Suppl 1): S137–S148. |
| [5] | 戎萍, 张喜莲, 马融, 等. "从肾论治"小儿癫痫的临床研究[J]. 天津中医药大学学报, 2012, 31 (3): 140–143. DOI:10.11656/j.issn.1673-9043.2012.03.04 |
| [6] | 杨常泉, 王伟, 马融. 茸菖胶囊对癫痫后认知障碍幼年大鼠神经发生的影响[J]. 中医杂志, 2013, 63 (4): 321–325. |
| [7] | 杨常泉, 王伟, 马融. 茸菖胶囊对幼年大鼠癫痫后NRSF和BDNF蛋白表达的影响[J]. 天津中医药, 2015, 32 (9): 555–557. DOI:10.11656/j.issn.1672-1519.2015.09.12 |
| [8] | Sombati S, Delorenzo RJ. Recurrent spontaneous seizure activity in hippocampal neuronal networks in culture[J]. Journal of neurophysiology, 1995, 73 (4): 1706. DOI:10.1152/jn.1995.73.4.1706 |
| [9] | Cao L, Xu J, Lin Y, et al. Autophagy is upregulated in rats with status epilepticus and partly inhibited by vitamin E[J]. Biochem Biophys Res Commun, 2009, 379 (4): 949–953. DOI:10.1016/j.bbrc.2008.12.178 |
| [10] | Dadakhujaev S, Jung EJ, Noh HS, et al. Interplay between autophagy and apoptosis in TrkA-induced cell death[J]. Autophagy, 2009, 5 (1): 103–105. |
| [11] | 熊维希, 吴梦倩, 张乐, 等. 非典型海马硬化中自噬流异常阻滞的初步研究[J]. 癫痫杂志, 2017, 3 (5): 380–384. DOI:10.7507/2096-0247.20170058 |
| [12] | Li Q, Ying H, Du J, et al. Alterations of apoptosis and autophagy in developing brain of rats with epilepsy:Changes in LC3, P62, Beclin-1 and Bcl-2 levels[J]. Neuroscience Research, 2017, 130 : 47–55. |
| [13] | 曹丽丽, 董艳, 徐婧婧, 等. Wortmannin通过抑制癫痫大鼠海马自噬活性发挥神经保护作用[J]. 中国病理生理杂志, 2010, 26 (8): 1548–1588. |
| [14] | 倪宏, 闫建珍, 张乐玲. Cathepsin B抑制剂对发育期惊厥大鼠海马自噬相关蛋白表达的调节[J]. 中华急诊医学杂志, 2011, 20 (3): 255–258. |
2. Tianjin University, Tianjin 300072, China;
3. Department of Pediatrics, Xinjiang Yili State Hospital of Traditional Chinese Medicine, Yili 835000, China;
4. Department of Pediatrics, Hubei Provincial Hospital of Traditional Chinese Medicine, Wuhan 430061, China
 2018, Vol. 35
2018, Vol. 35