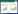文章信息
- 卢鹏, MAIKHONEVILAKHAMXAY, 任静, 邢月, 王舒雅, 薛志峰, 刘志东
- LU Peng, MAIKHONE VILAKHAMXAY, REN Jing, XING Yue, WANG Shuya, XUE Zhifeng, LIU Zhidong
- 黄芩苷纳米混悬剂大鼠体内药代动力学研究
- Pharmacokinetics of baicalin nanosuspension in rats
- 天津中医药, 2018, 35(7): 535-538
- Tianjin Journal of Traditional Chinese Medicine, 2018, 35(7): 535-538
- http://dx.doi.org/10.11656/j.issn.1672-1519.2018.07.16
-
文章历史
- 收稿日期: 2018-03-23
2. 天津中医药大学, 天津市现代中药重点实验室-省部共建国家重点实验室培育基地, 天津 300193
黄芩(Scutellaria Baicalensis Georgi)来源于唇形科植物黄芩的干燥根[1]。黄芩含有黄酮类、酚酸类、氨基酸、甾醇、精油、微量元素等成分[2],其中黄酮是其主要的有效成分。目前从黄芩属药材中已发现40多种黄酮类成分[3-4],主要有黄芩苷、黄芩素、汉黄芩苷、汉黄芩素、千层纸素苷、千层纸素等[5]。黄芩苷的含量是黄芩药材及其制剂的主要质量控制指标,也是给药后体内药物的重要检测指标。现代研究表明,黄芩苷具有抗肿瘤、抗炎、抗病毒、保肝和抗动脉粥样硬化等药理作用[6-7],但黄芩苷不溶于水且脂溶性较差,导致其口服生物利用度低,限制了其药效的发挥及临床应用。目前,已有通过脂质体、磷脂复合物、包合物、聚合物胶束、滴丸及固体分散等制剂技术提高黄芩苷生物利用度的研究[8-9],但这些技术仍存在成本较高、载药量低等问题。有研究发现,纳米混悬剂能增加药物的溶出度与稳定性,进而提高药物的生物利用度和药效等。本实验建立了液相色谱-质谱联用(LC-MS/MS)的方法测定大鼠血浆中黄芩苷的血药浓度,对大鼠灌胃给予黄苓(BL-NSPS)后黄芩苷的药代动力学进行了研究。
1 材料AH100D高压均质机(奥地利,ATS公司);FA25高剪切分散乳化机(德国,FLUKO公司),液质联用仪(美国,Agilent公司,包括1290型高效液相色谱仪、6460型三重四级杆质谱仪、MassHunter工作站);XW-80A型涡旋混合仪(上海沪西分析仪器厂有限公司);XP205型十万分之一天平(METTLER TOLEDO);ST16R型通用台式离心机(美国,Thermo公司)。黄芩苷原料药(天津中新药业研究中心,纯度85.0%);泊洛沙姆-188(Poloxamer,德国,巴斯夫公司);黄芩苷标准品(中国食品药品检定研究院,批号110715-201318,含量以93.3%计);卡马西平(中国食品药品检定研究院,批号100142-201105,含量以99.7%计);肝素钠(北京索莱宝科技有限公司,批号325D024,效价≥140单位/mg);甲酸为色谱纯(购自东京化成工业株式会社),甲醇、乙腈均为色谱纯(购自Fisher Scientific公司)。
SD大鼠,雄性,180~220 g,购自天津中医药大学实验动物中心,动物许可证号:SCXK(军)2014-004。大鼠随机分成2组,每组6只,分别为黄芩苷原料药(BL-Bulk)组、BL-NSPS组。
2 方法 2.1 BL-NSPS的制备采用高压均质法制备黄芩苷纳米混悬剂。分别称取黄芩苷原料药0.5 g,Poloxamer-188 0.2 g,加入蒸馏水50 mL,使用高剪切分散乳化机进行5次搅拌,每次600 r/min,2 min,直至完全溶解,然后在1 200 bar压力下高压乳匀15个循环,得到BL-NSPS。
2.2 样品测定色谱条件及质谱条件 2.2.1 色谱条件色谱柱:Waters ACQUITY UPLC® HSS C18柱(1.8 μm,2.1 mm×50 mm,美国Waters公司);柱温:30 ℃;流速:0.3 mL/min;进样量:5 μL;流动相:0.1%甲酸水(A)-乙腈(B);梯度洗脱(0~4 min,5%~32%B;4~4.1 min,32%~20%B;4.1~4.5 min,20%~30%B;4.5~9 min,30%~50%B;9~9.1 min,50%~5%B;9.1~10 min,5%~5%B)。
2.2.2 质谱条件离子源:采用电喷雾离子源(ESI源);检测方式:正离子检测;扫描方式:多反应离子监测(MRM);干燥气:氮气;干燥气温度:350 ℃;干燥气流量:11 L/min;雾化气压力:15 psi;毛细管电压:3 500 V,具体参数见表 1。
取100 μL血浆加入200 μL内标溶液(卡马西平40 ng/mL),涡旋3 min,12 000 r/min离心10 min,取上清液进LC-MS/MS分析。
2.4 专属性考察取空白血浆、空白血浆加对照品(黄芩苷1 250 ng/mL)、给药后血浆样品,按2.3项下方法处理,在2.2项条件下进样测定,记录质谱图。
2.5 标准曲线的绘制取对照品溶液100 μL,氮气吹干,加入空白血浆100 μL,使黄芩苷浓度为4 950、2 475、1 237.5、618.75、309.375、123.75、24.75 ng/mL,按照2.3项下方法处理后进样,建立标准曲线。以黄芩苷浓度(ng/mL)为横坐标,黄芩苷与卡马西平的峰面积比值为纵坐标,加权(W=1/x)法进行回归运算,求得黄芩苷的标准曲线。
2.6 提取回收率与基质效应取对照品溶液100 μL,氮气吹干,按2.3项下的方法分别制备低、中、高3个浓度的质量控制样品(n=6),在2.2项条件下进样测定,所得样品浓度与取空白血浆,按2.3项下的方法处理,后加入对照品溶液,制备低、中、高3个浓度的质量控制样品(n=6)浓度相比,测定提取回收率。取对照品溶液100 μL,氮气吹干,按2.3项下的方法分别制备低、中、高3个浓度的质量控制样品(n=6),在2.2项条件下进样测定,所得样品浓度与取对照品溶液100、200 μL甲醇,分别制备低、中、高3个浓度的质量控制样品(n=6)浓度相比,测定基质效应。
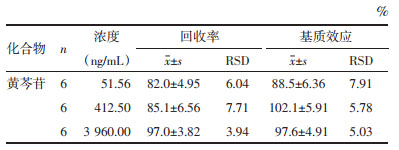
2.7 精密度及准确度取空白血浆100 μL,按2.3项下的方法分别制备低、中、高3个浓度的质量控制样品(n=6),分别在同日内和连续3 d用同1条标准曲线进行处理、分析,得到日内精密度RSD、日间精密度RSD和准确度RE。
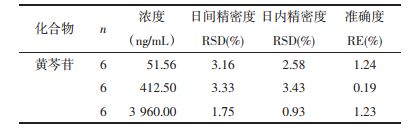
2.8 稳定性取空白血浆100 μL,按2.3项下的方法分别制备低、中、高3个浓度的质量控制样品(n=6),考察样品4 ℃放置24 h、室温下放置8 h、-20 ℃反复冻融3次、-20 ℃冻融30 d。
2.9 给药及血样采集成年雄性SD大鼠12只,饲养1周后,随机分成2组,每组6只,实验前禁食12 h,自由饮水。取大鼠称质量并编号,第1组按50 mg/kg的剂量灌胃给予黄芩苷原料药溶液;第2组按50 mg/kg的剂量灌胃给予BL-NSPS。分别在大鼠给药后的0.083、0.25、0.5、0.75、1、1.5、2、3、4、6、8、10、12、24 h时,经眼睑静脉丛取血0.3 mL,置1.5 mL的离心管中,4 000 r/min离心10 min,取上层血浆置另一1.5 mL离心管中,置冰箱-20 ℃保存备用。
2.10 数据处理采用SPSS 22.0和WinNonlin 6.0版药动学软件进行数据分析,统计学分析采用两独立样本t检验,P < 0.05为差异有统计学意义。
3 结果 3.1 专属性本研究方法分离效果好,专属性强,血浆中内源性物质不干扰测定。
3.2 标准曲线黄芩苷在血浆浓度24.75~4 950.00 ng/mL,线性关系良好。回归方程为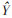
结果显示该方法的提取回收率均在(82.0±4.95)%~(97.0±3.82)%之间,RSD < 10%符合生物样品测定要求,同时结果显示不存在明显的基质效应,结果见表 2。
黄芩苷日内精密度RSD < 5%、日间精密度RSD < 5%,准确度偏差RE值均在±5%以内,均符合目前生物样品分析方法指导原则的有关规定,结果见表 3。
黄芩苷稳定性RE值均在±5%以内,表明黄芩苷在上述条件下可保持稳定,结果见表 4。
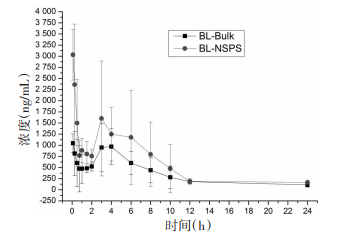
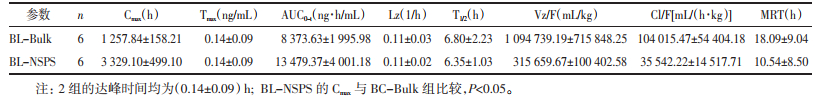
大鼠血浆中黄芩苷的血药浓度-时间曲线见图 1,经WinNonlin 6.0版药动学软件计算得到的药物动力学参数见表 5。由图 1和表 5可知,大鼠灌胃给药后,BL-Bulk在8.4 min达到峰浓度(1 257.84±158.21)ng/mL,0~24 h的药时曲线下面积为(8 373.63±1 995.98)ng·h/mL。与BL-Bulk相比,BL-NSPS的达峰时间未发生变化,峰浓度和0~24 h的药时曲线下面积分别为(3 329.10±499.10)ng/mL、(13 479.37±4 001.18)ng·h/mL。BL-NSPS的达峰血药浓度和药-时曲线下面积较BL-Bulk有了显著提高,即BL-NSPS提高了黄芩苷的体内生物利用度。
|
| 图 1 大鼠分别灌胃给药BL-Bulk和BL-NSPS后黄芩苷血浆药物浓度-时间曲线(n=6) Fig. 1 Concentration-time curve of baicalin in plasma of rats after intragastric administration of BL-Bulk and BLNSPS(n=6) |
|
目前,检测黄芩苷的方法主要包括紫外分光光度法、高效液相色谱法、液质联用法、阻抑-催化褪色光度法等。其中高效液相色谱或LC-MS/MS准确度高、灵敏度高,也是黄芩苷的药代动力学研究中血浆药物浓度法最常用的分析手段[10-11]。本实验对血浆样品中黄芩苷的提取方法进行了考察,结果发现甲醇沉淀无内源性物质干扰,重现性好,可达实验测定要求。实验所建立的流动相梯度洗脱程序能有效地将黄芩苷和内源性成分分离。本实验发现大鼠灌胃给药后,血浆中黄芩苷的药时曲线出现双峰,说明黄芩苷在大鼠体内存在肝肠循环。大鼠药代动力学实验结果显示,BL-NSPS的达峰浓度较BL-Bulk也有了显著提高,说明纳米混悬剂增加了药物的吸收速率,可能是因为BL-NSPS的溶出速率有了较大提高。BL-NSPS的相对生物利用度为(160.97±47.78)%,与BL-Bulk相比,BL-NSPS吸收有所提高,可能是由于纳米混悬剂药物粒径小,比表面积大,溶解度高,对黏膜的黏附性强,增加药物在胃肠道中的吸收,提高药物的生物利用度。由此证明,纳米级药物在很大程度能够提高药物的溶解度与溶出速度,进而促进药物吸收并提高药效。
| [1] | 国家药典委员会. 中华人民共和国药典(一部)[S]. 北京: 中国医药科技出版社, 2015: 301. |
| [2] | Li HB, Jiang Y, Chen F. Separation methods used for Scutellaria baicalensis active compo-nents[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2004, 812 (1-2): 277–290. DOI:10.1016/S1570-0232(04)00545-8 |
| [3] | Horvath CR, Martos PA, Saxena PK. Identification and quantification of eight flavones in root and shoot tissues of the medicinal plant Huang-qin (Scutellaria baicalensis Georgi) using high-performance liquid chromatography with diode array and mass spectrometric detection[J]. Journal of Chromatography A, 2005, 1062 (2): 199–207. DOI:10.1016/j.chroma.2004.11.030 |
| [4] | Wei F, Wang X, Zhang XY. Application of graphene oxide as a catalyst to accelerate extraction of total flavonoids and the hydrolysis of baicalin from Radix scutellaria[J]. Sep & Purif Tech, 2014, 133 : 421–428. |
| [5] | 徐杨璐, 赵胜男, 刘素丽, 等. 液质联用法测定不同贮存期黄芩中6种黄酮类化合物含量[J]. 医药导报, 2015, 34 (7): 955. |
| [6] | Xu Z, Mei J, Tan Y. Baicalin attenuates DDP (cisplatin) resistance in lung cancer by down-regulating MARK2 and p-Akt[J]. Int J Oncol, 2017, 50 (1): 93–100. DOI:10.3892/ijo.2016.3768 |
| [7] | Fu S, Xu L, Li S, et al. Baicalin suppresses NLRP3 inflammasome and nuclear factor-kappa B (NF-κB) signaling during Haemophilus parasuis infection[J]. Vet Res, 2016, 47 (1): 80. DOI:10.1186/s13567-016-0359-4 |
| [8] | Yang W, Li H, Cong X, et al. Baicalin attenuates lipopolysaccharide induced inflammation and apoptosis of cow mammary epithelial cells by regulating NF-κB and HSP72[J]. Int Im-munopharmacol, 2016, 40 : 139–145. DOI:10.1016/j.intimp.2016.08.032 |
| [9] | Yao J, Cao X, Zhang R, et al. Protective effect of baicalin against experimental colitis via suppression of oxidant stress and apoptosis[J]. Pharmacogn Mag, 2016, 12 (47): 225–34. DOI:10.4103/0973-1296.186342 |
| [10] | 范晓萍, 戴其昌. 一阶导数光谱法测定芩苓子洗液中黄芩苷的含量[J]. 中国药师, 2003, 6 (2): 90–91. |
| [11] | 韩秋伟. 紫外-可见分光光度法测定双黄连颗粒中黄芩苷的含量[J]. 牡丹江医学院学报, 2012, 33 (2): 21–23. |
2. Tianjin State Key Laboratory of Modern Chinese Medicine-Province and Ministry Co-established State Key Laboratory Cultivation Base, Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China
 2018, Vol. 35
2018, Vol. 35