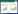文章信息
- 刘华明, 李丽, 马文娟, 贾琪, 欧阳慧子, 何俊
- LIU Huaming, LI Li, MA Wenjuan, JIA Qi, OUYANG Huizi, HE Jun
- 三七总皂苷对杠柳毒苷药代动力学的影响
- Effects of Panax notoginsenosides on pharmacokinetics of Periplocin
- 天津中医药, 2018, 35(7): 539-542
- Tianjin Journal of Traditional Chinese Medicine, 2018, 35(7): 539-542
- http://dx.doi.org/10.11656/j.issn.1672-1519.2018.07.17
-
文章历史
- 收稿日期: 2018-03-05
2. 天津中医药大学第一附属医院, 天津 300193
香加皮(Cortex Periplocae),又名北五加皮、杠柳皮,是萝藦科植物杠柳(Periploca Sepium Bge)的干燥根皮[1],最早记载于《神农本草经》,《中国药典》自1977年起均有收载[2]。杠柳毒苷为香加皮的主要有效、有毒成分,经口服代谢后可转化成杠柳次苷和杠柳苷元[3]。研究表明,杠柳毒苷具有强心[4]、抑制肿瘤细胞增殖[5]等药理作用,同时也具有一定的毒副作用,过量使用会出现室性早博、心室颤动、心房颤动、房室传导阻滞等不良反应[6],临床主要用于风湿、慢性充血性心力衰竭和心源性水肿的治疗[7]。目前,国内外已有研究采用高效液相色谱-紫外检测器(HPLC-UV)法[8]和液相色谱-质谱联用(LC-MS/MS)[9]法测定大鼠血浆中杠柳毒苷的含量,但HPLC-UV法的专属性差、灵敏度低,易受血浆内源性杂质的干扰;而在本课题组已报道的LC-MS/MS法[9]中,本研究采用单次灌胃给药的方式,结果显示杠柳毒苷的代谢物杠柳次苷和杠柳苷元存在一定的药动学规律,但原型药物杠柳毒苷的药动学行为仍旧不清晰。因此,为了更加深入了解杠柳毒苷在大鼠体内的代谢过程,本研究对原有的LC-MS/MS法进行了优化,使其能应用于配伍给药方式的药动学研究,希望能够阐明不同配伍比例的三七总皂苷对杠柳毒苷在大鼠体内的药动学过程的影响,为临床上香加皮配伍三七提供药动学理论依据。
1 仪器与材料 1.1 仪器Agilent 1200型高效液相色谱仪(美国,Agilent公司);Agilent 6430三重四级杆串联质谱仪(美国,Agilent公司);Agilent MassHunter分析软件(美国,Agilent公司);AX 205型十万分之一天平(瑞士,Mettler Toledo公司);Milli-Q超纯水制备仪(Millipore公司);3K15型高速离心机(美国,Sigma公司);XW-80A型旋涡混合器(上海沪西分析仪器厂)。
1.2 试药杠柳毒苷(成都德思特生物技术有限公司,批号:DST170907-041,纯度≥98%);补骨脂素(中国食品药品检定研究院,批号:110739-201416,纯度≥98%);三七总皂苷(成都德思特生物技术有限公司,其中Rb1、Rb2、Rc、Rd、Re、Rf和Rg1总量大于65%);色谱纯甲醇、色谱纯乙腈(美国Thermo Fisher Scientific Inc);甲酸(美国ROE scientific Inc.);分析纯乙酸乙酯(天津康科德科技有限公司);超纯水自制。
1.3 实验动物及给药方式健康雄性SD大鼠(220~230)g,SPF级,购自北京华阜康实验动物技术有限公司,实验动物质量合格证号:No.11401300070656,许可证号:SCXK (京) 2014-0004。18只大鼠被分为杠柳毒苷单独给药组(A组)、杠柳毒苷和低剂量三七总皂苷配伍组(B组)、杠柳毒苷和高剂量三七总皂苷配伍组(C组)。杠柳毒苷给药剂量为10 mg/(kg·d),三七总皂苷给药量分别为0.74 g/(kg·d)和2.22 g/(kg·d)(分别相当于香加皮和三七的比例为1:1和1:3,前期实验获得的换算因子为8.11)。采用灌胃给药的方式,连续给药7 d。
2 方法与结果 2.1 色谱条件色谱柱:Waters CORTECSTM C18柱(2.1 mm×50 mm, 2.7 μm);流动相:乙腈(B)-0.1%甲酸水(A);梯度洗脱,洗脱程序为:0~7 min,19%~50% B;7~9 min,50% ~50% B;洗脱时间9 min;流速为0.3 mL/min;柱温:30 ℃;进样量:5 μL。
2.2 质谱条件离子源为电喷雾离子源(ESI),检测模式为多反应离子监测(MRM),正离子监测;Delta EMV(+):500 V;Gas Temp:300 ℃;Gas Flow:11 L/min;Nebulizer:15 psi。杠柳毒苷定量离子对为719.4→719.4,碎裂电压135 V,碰撞能量3 V;内标补骨脂素定量分析离子对为187.0→131.1,碎裂电压115 V,碰撞能量25 V。
2.3 溶液的配制 2.3.1 杠柳毒苷标准溶液精密称取杠柳毒苷10.03 mg于10 mL容量瓶中,用甲醇溶解稀释至刻度,配制为1.003 mg/mL的储备液,4 ℃冰箱储存备用。精密量取一定体积的杠柳毒苷储备液,用甲醇依次稀释成质量浓度为5、10、25、50、125、500、2 000、2 500 ng/mL的系列标准溶液备用。
2.3.2 内标溶液量取补骨脂素对照品10.01 mg于10 mL容量瓶中,用甲醇溶解稀释为1.001 mg/mL的储备液,4 ℃冰箱储存备用。量取一定的补骨脂素储备液用甲醇稀释成1 μg/mL的内标溶液备用。
2.4 血浆样品预处理精密量取血浆样品100 μL,加入内标溶液20 μL(补骨脂素,1 μg/mL),20 μL甲醇,涡旋混匀,再加入2 mL乙酸乙酯涡流振荡5 min,14 000 r/min离心10 min后,取上清液2 mL氮气吹干,用100 μL 50%甲醇复溶,涡旋振荡5 min,14 000 r/min离心10 min,取上清液5 μL进行LC-MS/MS分析。
2.5 方法学考察 2.5.1 专属性精密量取空白血浆100 μL,加甲醇40 μL,其他按2.4项下处理并取上清进样分析,得色谱图 1(A);将一定浓度的杠柳毒苷对照品溶液及内标溶液加入空白血浆中,依同法处理,得色谱图 1(B);取大鼠灌胃后的血浆样品,依同法处理,得色谱图 1(C)。杠柳毒苷和内标补骨脂素的保留时间分别是3.35 min和4.31 min。血浆样品中内源性成分目标性成分互不干扰,结果如图 1。
|
| 图 1 大鼠血浆中杠柳毒苷(1)和内标(2)的MRM图 Fig. 1 Representative MRM chromatograms of Periplocin (1) and IS (2) in rats plasma |
精密量取大鼠空白血浆100 μL,加入一系列浓度的杠柳毒苷对照品溶液20 μL,再加入20 μL的内标溶液后,配制成血浆中杠柳毒苷浓度分别为1、2、5、10、25、100、400、500 ng/mL的血浆样品,按照2.4项下的血浆样品处理方法进行处理,取上清液进行分析并记录色谱图,以杠柳毒苷与内标的峰面积比值(
精密量取空白血浆100 μL,分别加入3种不同浓度的杠柳毒苷对照品溶液,使他们的终浓度为2、25、400 ng/mL,每个浓度溶液各6份,按照2.4项下进行处理,连续测定3 d,并与标准曲线同时进行,记录峰面积,计算日内、日间精密度,得杠柳毒苷日内、日间精密度RSD值分别小于13.94 %和8.94 %,准确度在91.87%~101.36 %之间。
2.5.4 回收率及基质效应量取大鼠空白血浆100 μL,按2.4项下的处理方法,制备成浓度为2、25、400 ng/mL的低、中、高3种浓度血浆样品各6份,进样量为5 μL,记录下峰面积(A1);另取空白血浆100 μL,加入40 μL甲醇,按照2.4项下的方法处理后,用相应低、中、高3个浓度的杠柳毒苷对照品复溶,进样量为5 μL,记录下峰面积(A2),则提取回收率为R=A1/A2×100%;同样条件下进相应的低、中、高3个浓度杠柳毒苷对照品溶液,记录下相应峰面积(A0),则基质效应为M=A2/A0。3个浓度QC样品的回收率分别为(86.20±0.06)%、(94.15±0.03)%和(90.23±0.04)%;内标补骨脂素的提取回收率为(90.65±0.04)%。3个浓度QC样品的基质效应分别为(90.54±0.06)%、(84.60±0.04)%和(93.86±0.03)%;内标补骨脂素的基质效应为(91.49±0.09)%。
2.5.5 稳定性考察取大鼠空血浆100 μL,配成低、中、高3种浓度(2、25、400 ng/mL)的QC样品各3份,按照2.4项下的方法处理,分别考察其在室温下6 h再处理,血浆样品处理后放置自动进样器12 h,反复冻融3次,血浆样品-70 ℃冰箱中冷冻14 d稳定性。杠柳毒苷准确度在93.35 %~113.13 %之间,RSD值在1.79 %~14.66 %之间。结果表明杠柳毒苷在上述条件下稳定性良好。
2.6 药动学研究18只健康雄性SD大鼠,在最后1次给药前禁食12 h,期间可自由饮水,分别在最后1次给药前以及给药后0.033、0.083、0.167、0.25、0.5、1、2、4、6、8、10、12、24、36、48 h经大鼠目内眦取血,置于肝素离心管中,6 000 r/min离心10 min,取上清后置于-70 ℃冰箱储存,直至进样分析。3种给药方式下杠柳毒苷的平均血药浓度-时间曲线见图 2,采用DAS 1.0软件计算3组大鼠口服杠柳毒苷后的药动学参数,见表 1。实验数据经SPSS 19.0统计软件处理,采用单因素方差分析比较各组间的药动学参数差异。
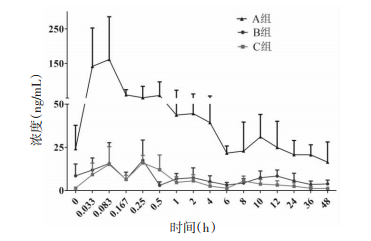
|
| 图 2 大鼠灌胃给药后杠柳毒苷的平均血药浓度-时间曲线(x±s, n = 6) Fig. 2 Mean plasma concentration-time curve of Periplocin in rats after oral administration (x±s, n = 6) A 组:杠柳毒苷单独给药组;B 组:杠柳毒苷和低剂量三七总皂苷配伍组;C 组:杠柳毒苷和高剂量三七总皂苷配伍组 |

|
本实验对原有的LC-MS/MS法进行了优化,该方法专属性好,灵敏度高,线性范围广(1~500 ng/mL),线性关系良好(r=0.994 9),和原方法相比运行时间短。经方法学验证,本方法符合生物样品的测定要求,满足大鼠血浆中杠柳毒苷的含量测定。
Jia等[10]采用静脉注射和腹腔注射的给药方式,利用LC-MS/MS法测定大鼠血浆和组织中杠柳毒苷的含量,结果显示杠柳毒苷的药代动力学行为存在一定规律,各组织样品中杠柳毒苷的含量均能被检测到,但在大多数组织中,90%的杠柳毒苷在60 min后被降解;而本课题组[9]采用单次灌胃给药方式,利用LC-MS/MS法测定大鼠血浆中杠柳毒苷及其代谢物杠柳次苷和杠柳苷元的含量,结果发现,杠柳毒苷仅在大鼠给药后很短的时间内可被检测到,无法拟合完整的药时曲线。而本研究中,大鼠被连续灌胃给药7 d后,检测大鼠血浆中杠柳毒苷的含量,结果表明,给药后各时间点的血浆样品中的杠柳毒苷均能被检测到;且与三七总皂苷配伍给药后,杠柳毒苷的药代动力学行为有明显改变,主要表现为两个配伍组与杠柳毒苷单独给药组的Cmax、AUC0-t和AUC0-∞存在显著性差异,杠柳毒苷和低剂量三七总皂苷配伍组与杠柳毒苷单独给药组的Tmax值也存在显著性差异;随着配伍的三七比例增大,杠柳毒苷的T1/2、AUC0-t和AUC0-∞值呈递减趋势。上述结果说明连续灌胃给药可以使杠柳毒苷在大鼠体内的代谢速度发生改变,三七总皂苷对杠柳毒苷的药动学过程存在一定影响。
| [1] | 佟玲, 谭晓杰, 林景瑞, 等. RP-HPLC法测定香加皮中异香草醛、杠柳毒苷和4-甲氧基水杨醛的含量[J]. 药物分析杂志, 2009, 29 (6): 961–963. |
| [2] | 李瑞雪, 吴飞, 张继全, 等. 一测多评法用于香加皮药材质量标准的研究[J]. 安徽医药, 2017, 21 (7): 1199–1203. |
| [3] | 陈浩浩, 王晓明, 潘桂湘, 等. 杠柳毒苷、杠柳次苷、杠柳苷元与人血浆蛋白结合率测定[J]. 辽宁中医药大学学报, 2017, 19 (7): 32–35. |
| [4] | 张辉云, 贺清华, 童珊珊, 等. 香加皮活性成分及其药理作用研究进展[J]. 药学进展, 2013, 37 (9): 449–453. |
| [5] | 丁菲菲, 张晓静, 邓雁如. 杠柳毒苷体外抑制肝癌细胞和乳腺癌细胞增殖的实验研究[J]. 药物评价研究, 2014, 37 (1): 30–33. |
| [6] | 欧明, 王宁生. 中药及其制剂不良反应大典[M]. 沈阳: 辽宁科学技术出版社, 2005: 135. |
| [7] | 李超, 潘桂湘, 何新. 香加皮的化学成分及药理作用研究进展[J]. 药物评价研究, 2010, 33 (1): 36–41. |
| [8] | 阚红玉, 谢跃生, 王跃飞, 等. HPLC法测定小鼠血浆中杠柳毒苷的血药浓度[J]. 中草药, 2008, 39 (10): 1493–1496. DOI:10.3321/j.issn:0253-2670.2008.10.017 |
| [9] | He J, Bo F, Tu YR, et al. A validated LC-MS/MS assay for the simultaneous determination of periplocin and its two metabolites, periplocymarin and periplogeninin rat plasma:application to a pharmacokinetic study[J]. J Pharm Biomed Anal, 2015, 114 : 292–295. DOI:10.1016/j.jpba.2015.06.008 |
| [10] | Jia YM, Wang XY, Chu Y, et al. A Validated Liquid Chromatography with Tandem Mass Spectrometry Method for Pharmacokinetics and Tissue Distribution of Periplocin in Rats[J]. Lat Am J Pharm, 2015, 34 (4): 694–701. |
2. The First Teaching Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China
 2018, Vol. 35
2018, Vol. 35