文章信息
- 张弘, 陶森, 段毅力, 曹武奎, 王泓午
- ZHANG Hong, TAO Sen, DUAN Yili, CAO Wukui, WANG Hongwu
- 慢性丙肝不同肝纤维化程度中医证候相关分析
- Correlation analysis of traditional Chinese medicine syndromes for different liver fibrosis in chronic hepatitis C
- 天津中医药, 2018, 35(8): 576-579
- Tianjin Journal of Traditional Chinese Medicine, 2018, 35(8): 576-579
- http://dx.doi.org/10.11656/j.issn.1672-1519.2018.08.05
-
文章历史
- 收稿日期: 2018-03-17
2. 天津中医药大学第一附属医院, 天津 300193;
3. 天津中医药大学, 天津 300193
丙型肝炎病毒(HCV)感染呈全球流行性,不同性别、年龄、种族人群均对HCV易感。HCV感染慢性化率为55%~85%,肝纤维化贯穿HCV感染全过程,评估肝纤维化对于慢性丙型肝炎(CHC)患者的处理是首要措施[1]。肝脏瞬时弹性成像技术(TE)是目前多个国家推广的无创评估肝纤维化的手段[2-4]。本研究对CHC不同肝硬度水平中医证候分布情况进行聚类分析,探讨CHC患者不同肝纤维化程度中医证素特征,为中医药抗纤维化辨证治疗提供依据。
1 材料与方法 1.1 材料 1.1.1 病例来源天津市第二人民医院门诊或住院患者,病例收集时间为2015年1月—2016年3月,接受临床调查的CHC患者452例。
1.1.2 西医诊断标准CHC及丙肝后肝硬化(代偿期)的诊断标准参考2004年中华医学会肝病学分会、中华医学会传染病与寄生虫学分会修订的《丙型肝炎防治指南》[5]。
1.1.3 中医辨证标准中医辨证分型参考2004年中华中医药学会内科肝病专业委员会宜昌会议《病毒性肝炎中医辨证标准》[6]。
1.1.4 纳入标准1)抗-HCV持续阳性及半年内至少1次HCV RNA≥103 U/mL。2)能配合完成调查问卷及各项化验检查。3)于调查之日完成肝硬度检测者。
1.1.5 排除标准1)失代偿期肝硬化(近3个月内出现胸腹腔积液、消化道出血、肝性脑病等)。2)重叠HBV(乙肝病毒)或HIV(人免疫缺陷病毒)感染者。3)原发性肝癌肝脏或可疑占位性病变同时甲胎蛋白(AFP)>100 ng/mL。4)其他病因(包括自身免疫性、药物性、酒精性、中毒性、寄生虫性)导致的慢性肝炎。5)合并其他严重的全身性疾病和精神病患者。6)妊娠或哺乳期妇女。7)转氨酶水平<3正常值上限(ULN);血清总胆红素水平<2 ULN。8)拒绝接受调查或化验结果不全者。
1.1.6 检测仪器FibroScan检测仪由法国埃克森公司生产,由内蒙古福瑞公司提供。本研究所使用探头型号均为M型,频率为3.5 MHz。
1.2 研究方法 1.2.1 肝硬度检测患者空腹或进餐2 h后进行。
检测方法与步骤:患者取仰卧位,右臂抬起,右侧腋前线或腋中线的第7、8、9肋间隙为检测区域。局部涂抹超声耦合剂,探头紧贴且垂直于皮肤,成功检测10次,选取中位数为最终检测的硬度结果,单位为kPa。检测数据质量控制标准:要求四分位数间距(IQR)必须小于中位数的三分之一,并且成功率必须大于等于60%。
FibroScan结果判读参照2013年瞬时弹性成像技术诊断肝纤维化专家意见[2]:LSM>14.6 kPa诊断肝硬化;7.3≤LSM≤14.6 kPa诊断显著肝纤维化;LSM<7.3 kPa无明显肝纤维化。
1.2.2 中医症状、体征的收集参照文献研究设计并制定出本次研究的临床调查表。采用该调查表对纳入的患者进行中医四诊信息的采集,对所获得的中医症状采取分级量化的方法,根据症状轻重分别赋予0、1、2和3分。经过培训的2名医师指导患者进行CHC中医症状调查表填写,完成症状填写后由中级资格以上中医医师对患者进行体征、舌苔、脉象判定。由2名医生对调查表填写是否完整进行核实。
1.2.3 实验室检查生化指标检测在HITACHI 7180进行;丙氨酸氨基转移酶(ALT)、天门冬氨酸转移酶(AST)、谷氨酰转肽酶(GGT)、总胆红素(TBIL)试剂由日本和光线药工业株式会社生产;总胆固醇(CHO)检测试剂由上海德赛诊断系统有限公司提供;白蛋白(Alb)检测由四川迈克生物有限公司提供;血细胞计数全自动模块式血液体液分析仪Sysmex XN2000,由希森美康株式会社制造。
1.2.4 统计方法数据录入软件采用Epidata3.0,对数据进行双录入。用SPSS 19.0进行统计学分析,计量资料以均数±标准差(x±s)表示,组间比较采用单因素方差分析;计数资料组间比较采用卡方检验;中医症状、体征采取聚类分析法。所有的统计检验均采用双侧检验,P<0.05将被认为所检验的差别有统计学意义。
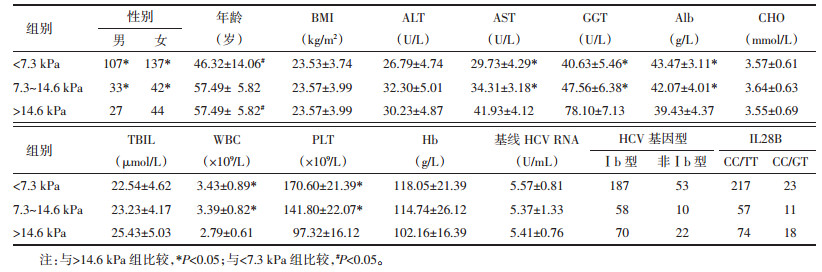
2 结果 2.1 基本情况收集452例,因调查资料填写不完整剔除35例,化验结果不全剔除27例,最终纳入390例。其中,男167例,女223例。以LSM 7.3~14.6 kPa为界分成3组:LSM<7.3 kPa 244例;LSM 7.3~14.6 kPa 75例;LSM>14.6 kPa 71例。3组在体重指数(BMI)、CHO、ALT、TBIL、血红蛋白(Hb)比较无统计学差异(P>0.05),在年龄、男女比例及AST、Alb、GGT、白细胞计数(WBC)、血小板计数(PLT)比较有统计学差异(P<0.05)。结果详见表 1。
根据聚类分析结果将LSM<7.3 kPa慢性丙肝中医证候归类,见表 2。
LSM<7.3 kPa慢性丙肝中医阳性证候较少,中医证候以肝郁脾虚为主要表现。
2.2.2 LSM在7.3~14.6 kPa慢性丙肝患者中医证候聚类分析根据聚类分析结果将7.3 kPa≤LSM≤14.6 kPa CHC中医证候归类,见表 3。

|
CHC肝纤维化明显者中医症状、体征特征性表现:舌下络脉曲张、手足抽搐、口淡、皮肤瘙痒等。中医证候以肝郁脾虚为主,部分患者出现血瘀肾虚。
2.2.3 LSM>14.6 kPa CHC患者中医证候聚类分析结果见表 4。
根据聚类分析结果将LSM>14.6 kPa CHC中医证候进行归类。
CHC LSM显著增高者中医症状、体征特征性表现为:蜘蛛痣、肌肤甲错、尿液异常、舌下络脉曲张、唇甲紫暗等。中医证候以气虚血瘀、肝肾阴虚为主兼有肝郁脾虚。
3 讨论肝硬度是由法国埃克森公司的专利产品Fibroscan进行肝脏无创弹性测量,反映肝纤维化程度。肝硬度指数越高,肝纤维化程度越严重[7-10]。
HCV多为隐匿感染,感染早期多无明显自觉不适。CHC发展及转归与人体的免疫状态密切相关,此外与感染HCV的年龄、性别等因素有关[11-12]。肝纤维化的发生和发展是CHC的主要病理后果。本研究显示,不同肝纤维化程度的CHC患者年龄、男女比例有统计学差异,肝纤维化程度重者多见于年长者,且男性多于女性,这与其他研究报道相符[13-14]。此外,CHC肝纤维化程度不同者AST、Alb、GGT、WBC、PLT比较有统计学差异,考虑与HCV感染后活动性炎症损伤,病情发展至肝纤维化、肝硬化阶段,出现肝细胞损伤、肝功能合成功能降低及脾功能亢进有关。
对390例不同水平LSM CHC患者进行中医证候研究发现,LSM值处于正常水平范围的CHC患者阳性症状、体征少,中医症状主要表现为乏力、厌食、情志抑郁等表现,病位证素主要是肝、脾,病性证素主要是肝郁脾虚、肝肾阴虚。随着LSM值增高,肝纤维化程度加重,出现口干、口淡、目干、舌下络脉曲张、眼花、手足抽搐等表现,病位证素除肝、脾外累及肾,病性证素主要是瘀、虚。虚主要表现为阴虚、气虚、血虚。当LSM值达到肝硬化诊断阈值水平,蜘蛛痣、面色晦暗、唇甲紫暗、尿液异常等血瘀及肾虚证更为突出。不同的肝纤维化程度反映CHC不同病程阶段。根据不同LSM水平中医证素情况,将CHC中医病机演变归纳为疫毒之邪侵袭肝脏,首先影响到肝主疏泄的功能,肝失疏泄,气机不畅而出现情志抑郁等肝郁表现;肝气横逆脾土,致使脾失健运,则水谷不化,表现为倦怠乏力、口淡、便溏、皮肤瘙痒等。肝失疏泄,藏血失职,气滞血瘀。瘀血阻滞肝脉是中重度肝纤维化的病理学基础。清代吴澄言:“积瘀凝滞,不问何经,总属于肝。盖肝主血也。”肝主藏血,邪郁日久,必壅塞肝络,瘀血内停。“肝肾同源”,肝纤维化病久,出现肾虚。正气不足是此病的发病基础,“肝病传脾”是肝纤维化必然的演变过程,肝肾不足是肝纤维化发展的必然趋势。丙型肝炎肝纤维化的病位在肝,与脾肾关系密切,其病理因素主要有气滞、郁、虚、瘀,但本研究显示湿、热非主要病理因素,这与CHC肝纤维化病因病机有所差异[15]。但成人感染乙肝病毒90%以上可自行清除,而感染HCV慢性化率高达55%~85%,而且40岁以上成人感染HCV病情进展迅速,说明HCV感染较HBV更易引起机体免疫功能下降。因此,笔者认为CHC肝纤维化治疗以扶持人体的正气,以增强机体的免疫系统为根本。
本研究主要研究CHC及丙肝后肝硬化(代偿期)患者,且部分患者为接受抗病毒治疗出现病毒学应答患者,为避免对肝硬度检测值影响,排除有明显活动性肝损伤患者,上述排除因素可能对中医证候及证素研究造成偏倚影响,今后需要进一步扩大样本量进行研究。
| [1] | European Association for Study of Liver. EASL Clinical Practice Guidelines:management of hepatitis C virus infection[J]. J Hepatol, 2014, 60 (2): 392–420. DOI:10.1016/j.jhep.2013.11.003 |
| [2] | 肝脏硬度评估小组. 瞬时弹性成像技术诊断肝纤维化专家意见[J]. 中华肝脏病杂志, 2013, 21 (6): 420–424. DOI:10.3760/cma.j.issn.1007-3418.2013.06.009 |
| [3] | Kemp W, Levy M, Weltman M. AustralianLiver Association(ALA)expert consensus recommendations for the use of transient elastography in chronic viral hepatitis[J]. J Gastroenterol Hepatol, 2015, 30 (3): 453–462. DOI:10.1111/jgh.2015.30.issue-3 |
| [4] | European Association for Study of Liver, Association Latinoamericana para el Estudio del Higado. EASL-ALEH Clinical Practice Guidelines:Non-invasive tests for evaluation of liver disease severity and prognosis[J]. J Hepatol, 2015, 63 (1): 237–264. DOI:10.1016/j.jhep.2015.04.006 |
| [5] | 中华医学会肝病学分会, 中华医学会传染病与寄生虫病学分会. 丙型肝炎防治指南[J]. 中华肝脏病杂志, 2004, 12 (4): 194–198. DOI:10.3760/j.issn:1007-3418.2004.04.002 |
| [6] | 中国中医药学会内科肝病专业委员会. 病毒性肝炎中医辨证标准(试行)[A]. 第十二次全国中医药学会内科肝病学术会议论文汇编[C]. 南宁: 2004. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=ZZYZ199205026&dbname=CJFD&dbcode=CJFQ |
| [7] | Houot M, Ngo Y, Munteanu M, et al. Systematic review with meta-analysis:direct comparisons of biomarkers for the diagnosis of fibrosis in chronic hepatitis C and B[J]. Aliment Pharmacol Ther, 2016, 43 (1): 16–29. DOI:10.1111/apt.2016.43.issue-1 |
| [8] | Denise CP, Adriana A, Daniel FCM, et al. Concordance of non-invasive mechanical and serum tests for liver fibrosis evaluation in chronic hepatitis C[J]. World J Hepatol, 2017, 9 (8): 436–442. DOI:10.4254/wjh.v9.i8.436 |
| [9] | Obara N, Ueno Y, Fukushi K, et al. Transient elastography for measurement of liver stiffness measurement can detect early significant hepatic fibrosis in Japanese patients with viral and non-viral liver diseases[J]. J Gastroenterol, 2008, 43 (9): 720–728. DOI:10.1007/s00535-008-2225-2 |
| [10] | Laharie D, Zerbib F, Adhoute X, et al. Diagnosis of liver Fibrosis by transient elastography (FibroScan) and non-invasive methods in Crohn's disease patients treated with methotrexate[J]. Aliment Pharmacol Ther, 2006, 23 (11): 1621–1628. DOI:10.1111/apt.2006.23.issue-11 |
| [11] | Mohan P, Barton BA, Narkewicz MR, et al. Evaluating progressionof liver disease from repeat liver biopsies in children with chronichepatitis C:a retrospective study[J]. Hepatology, 2013, 58 (5): 1580–1586. DOI:10.1002/hep.26519 |
| [12] | Kim WR, Potemcha JJ, Benson N, et al. The impact of competingrisks on the observed rate of chronic hepatitis C progression[J]. Gastroenterology, 2004, 127 (3): 749–755. DOI:10.1053/j.gastro.2004.06.052 |
| [13] | 曹东晖. 中山市某医院2006~2010年接诊丙型肝炎病例流行特征分析[J]. 中国热带医学, 2012, 12 (1): 94–95. |
| [14] | 边藏丽, 王华国. 6280例体检人员丙型肝炎病毒感染调查分析[J]. 中国感染控制杂志, 2005, 4 (4): 320–323. DOI:10.3969/j.issn.1671-9638.2005.04.010 |
| [15] | 刘瑶, 吴同玉, 李东良, 等. 早期乙型肝炎肝硬化中医证素特征及其与血浆CTGF、PDGF的相关性研究[J]. 广州中医药大学学报, 2015, 32 (1): 4–9. |
2. Hepatology Department, The First Teaching Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300381, China;
3. Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China
 2018, Vol. 35
2018, Vol. 35